2018-08-24 東京大学,岐阜大学
1.発表者:
長江 雅倫(東京大学大学院薬学系研究科 特任研究員)
木塚 康彦(岐阜大学研究推進・社会連携機構生命の鎖統合研究センター 准教授)
2.発表のポイント:
◆ヒトのがんの悪性化を促進する糖鎖合成酵素である GnT-V の立体構造を世界で初めて明ら かにした。
◆GnT-V の研究は世界中で行われているが、その詳しい働き方は不明だった。今回立体構造を 明らかにしたことで、この酵素が働く仕組みがわかった。
◆働き方の詳細が明らかになったことで阻害剤のデザインが可能になり、がん悪性化のメカニ ズムに対する理解と、がんの悪性化を抑える薬剤の開発が進むことが期待される。
3.発表概要:
私たちの体は様々な細胞でできていますが、全ての細胞の表面は糖鎖(注1)で覆われてい ます。糖鎖は細胞の状態を反映していることから、「細胞の顔」と呼ばれています。例えば、 がんになると細胞の糖鎖が変化するので、それががんマーカーとして使われています。また疾 患に伴って糖鎖が変化すると細胞の働きが変わるので、糖鎖の変化を抑えればがんなどの治療 に有効であると考えられます。しかし糖鎖が変わっていく仕組みについては十分にわかってお らず、そのために糖鎖を標的にした新しい薬を作ることが困難になっています。それは、糖鎖 を作る酵素である糖転移酵素(注2)の「かたち」の情報が不足しているからです。東京大学 大学院薬学系研究科の長江雅倫特任研究員、岐阜大学研究推進・社会連携機構生命の鎖統合研 究センターの木塚康彦准教授らは、がんを悪性化する糖転移酵素、GnT-V に着目し、X 線結晶 構造解析(注3)と呼ばれる手法を用いて、世界で初めて本酵素の立体構造を明らかにしまし た。これにより、GnT−V によって糖鎖が変化していく仕組みの詳細が明らかになりました。 今後、がんの悪性化に伴う糖鎖の変化を抑える新しい治療薬の開発につながると期待されます。
4.発表内容:
糖鎖は、グルコースなどの糖が鎖状につながったもので、タンパク質などにつながって存在 しています。タンパク質の 50%以上は糖鎖を持っており、全ての細胞の表面は糖鎖で覆われて います。また糖鎖には様々な種類があり、タンパク質や細胞の機能を調節することや、様々な 疾患に関連してその姿を変えることが知られています。特にがんとのかかわりが深く、私たち が受診する検診でもがんマーカーとして広く使われています。 本研究が対象とする N-acetylglucosaminyltransferase-V (略称 GnT-V)は、N-アセチルグ ルコサミンと呼ばれる糖をタンパク質上の糖鎖につけ、糖鎖の枝分かれを増やす働きがありま す。GnT-V によってできた糖鎖の枝分かれは 1-6 分岐と呼ばれ、タンパク質の機能に大きな 影響を与えます(図1)。特に細胞のがん化とがんの悪性化を進行させる役割を果たすことが 明らかになっており、世界中で GnT-V を対象にした研究が盛んにおこなわれています。しか し、GnT-V がどのように基質となる糖鎖やタンパク質を認識して糖の転移反応を行うのかはほ とんど分かっていませんでした。そこで東京大学大学院薬学系研究科の長江雅倫特任研究員、 岐阜大学研究推進・社会連携機構生命の鎖統合研究センターの木塚康彦准教授らは、ヒト由来 の GnT-V の立体構造を、X 線結晶構造解析(注3)によって世界で初めて決定し、基質とな る糖鎖がどのように GnT-V に結合しているのかを原子レベルで明らかにしました。X 線結晶 構造解析を行うためには、大量の GnT-V を高純度に調製する必要があります。しかし、GnT-V のような糖鎖を合成する酵素は、細胞内のゴルジ体と呼ばれる特定の場所で働くため、酵素の 大量調製が難しいとされています。今回研究チームは、AMED「創薬等ライフサイエンス研究 支援基盤事業」の一環である創薬等先端技術支援基盤プラットフォーム(BINDS)の支援を受 け、培養細胞を用いて GnT-V を大量に調製しました。こうして得られた GnT-V を結晶化し、 大型放射光施設(注4)スプリング8(兵庫県佐用郡)およびフォトンファクトリー(茨城県 つくば市)の高輝度 X 線を用いてデータ収集を行い、立体構造の決定に成功しました。GnT-V の構造は図 X のようなクローバー形をしており、類似の反応を行う酵素とは大きく形が異なる ことがわかりました。また基質の類似体と結合した状態のGnT-V の立体構造も併せて決定し、 GnT-V はクローバー形の構造のちょうど真ん中で反応を行うことを突き止めました(図2)。 興味深いことに、クローバー形の中心に深い窪みがあり、そこに基質となる糖鎖が嵌り込んで GnT-V と強く相互作用していました。以前の酵素学的な研究から、GnT-V は特定の構造を持 つ糖鎖にしか働かないことが知られていましたが、今回得られた立体構造から、この窪みに入 ることのできる糖鎖の種類は限られており、そのため他の多くの糖鎖は GnT−V による作用を 受けないことが裏付けられました。また GnT-V は、特定のタンパク質の特定の糖鎖にしか作 用しないことも知られていましたが、その現象も GnT-V が持つ深い窪みに合致するかどうか で決まることが示唆され、GnT-V は働くべきタンパク質やその上の特定の糖鎖を取捨選択して いる可能性が示されました(図3)。
今回の研究によって、GnT-V がこれまで知られている酵素とは形や反応の仕組みが大きく異な っていることが明らかになりました。このため GnT-V の立体構造を利用することで特異性の 高い阻害剤のデザインが可能になります。こうした発展研究によって、糖鎖とがんの悪性化の 関連性が今後明らかにされ、また糖鎖を標的としたがん治療薬開発へつながる可能性がありま す。
5.発表雑誌:
雑誌名:Nature Communications
論文タイトル:Structure and mechanism of cancer-associated N-acetylglucosaminyltransferase-V
著者:Masamichi Nagae* , # , Yasuhiko Kizuka# , Emiko Mihara, Yu Kitago, Shinya
Hanashima,Yukishige Ito, Junichi Takagi, Naoyuki Taniguchi and Yoshiki
Yamaguchi ( #equal contribution, *corresponding author)
DOI 番号:10.1038/s41467-018-05931-w
アブストラクト URL:http://www.nature.com/ncomms
6.問い合わせ先:
<研究に関すること>
東京大学大学院薬学系研究科
特任研究員 長江 雅倫(ながえ まさみち)
岐阜大学研究推進・社会連携機構生命の鎖統合研究センター
准教授 木塚 康彦(きづか やすひこ)
<報道担当>
東京大学大学院薬学系研究科 庶務チーム
岐阜大学総合企画部総務課広報室
7.用語解説:
(注1)糖鎖:グルコースなどの糖が複数個、鎖状に連結してつながったもの。バクテリアか らヒトまであらゆる生物に存在し、様々な種類がある。
(注2)糖転移酵素:糖を糖鎖に結合させる酵素で、ヒトでは数百種類が知られている。
(注3)X 線結晶構造解析:原子レベルの立体構造を決定する手法の一つ。高純度で調製した タンパク質などを溶液中で結晶にしてX線を照射することで生じる回折現象を利用して決定 する。
(注4)大型放射光施設:放射光とは電子を光に近い速度まで加速させ、強力な磁石によって 進行方向を曲げた時に生じる X 線などの電磁波のこと。タンパク質の結晶は小さく不完全な ため大型放射光施設によって生じる強力な X 線が実験には必要不可欠である。日本には兵庫 県播磨郡にあるスプリング8と茨城県つくば市のフォトンファクトリーなどがある。
8.添付資料:
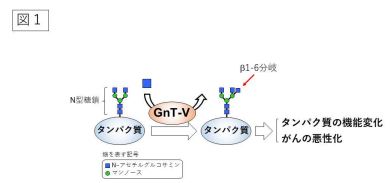
図1:GnT-V はタンパク質上の N 型糖鎖に 1-6分岐を作り、がんの悪性化などに関与する
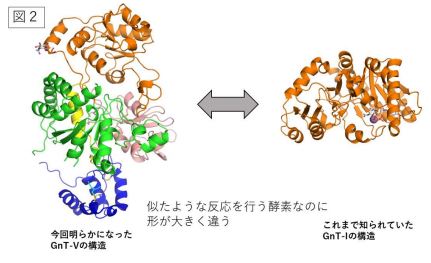
図2:今回明らかになった GnT-V の立体構造(左側)とこれまでに知られていた類縁酵素 GnT-I の立体構造(右側)
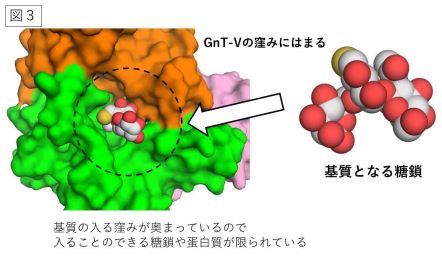
図3:GnT-V の基質ポケット付近の構造