2018-11-05 理化学研究所
理化学研究所(理研)開拓研究本部佐甲細胞情報研究室の平林義雄客員主幹研究員、脳神経科学研究センター神経細胞動態研究チームの金然正研究員、細胞機能探索技術研究チームのグレイメル・ペーター専任研究員らの研究グループ※は、パルミチン酸[1]存在下において、Gタンパク質共役受容体(GPCR)[2]の一つの「GPRC5B[3]」と細胞膜構成脂質であるスフィンゴミエリン[4]の合成酵素「SMS2」の相互作用が、「インスリン抵抗性[5]」を誘導することを明らかにしました。
本研究結果は、今後、肥満による2型糖尿病[6]などの新たな予防・治療法の開発に貢献すると期待できます。
肥満などが原因でインスリン抵抗性が引き起こされることは知られていましたが、その仕組みは複雑でよく分かっていませんでした。今回、GPRC5B遺伝子の欠損細胞を用いて、高脂質食に含まれるパルミチン酸が及ぼす細胞脂質代謝の変動を調べたところ、GPRC5BがSMS2を介して、生理活性脂質ジアシルグリセロール(DAG)の産生制御に関わることが分かりました。GPRC5BとSMS2が相互作用すると、リン酸化酵素Fyn[7]によりSMS2のリン酸化が促進されます。SMS2は本来不安定で壊れやすいタンパク質ですが、リン酸化されると安定します。その結果、SMS2により産生されるDAGの量が増大して、インスリンの作用が阻害されることが示されました。
本研究は、米国のオンライン科学雑誌『iScience』(10月26日号)に掲載されました。
※研究グループ
理化学研究所
開拓研究本部
佐甲細胞情報研究室
客員研究主幹 平林 義雄(ひらばやし よしお)
脳神経科学研究センター
神経細胞動態研究チーム
研究員 金 然正(キム ヨンジョン)
細胞機能探索技術研究チーム
専任研究員 グレイメル・ペーター(Peter Greimel)
背景
食物を過剰摂取すると、栄養の蓄積-消費のバランスが崩れて肥満状態となり、糖尿病、高脂血症、高血圧症などさまざまな病気の発症リスクが高まります。肥満患者は近年増加の一途をたどっており、これらの病気の予防・治療に向けて、肥満に関わるメカニズムを理解することが求められています。
インスリンは、細胞外のブドウ糖(グルコース)を速やかに細胞内に運ぶ過程で重要なホルモンです。2型糖尿病の原因の一つである「インスリン抵抗性」とは、肥満などが原因でインスリンが働きにくくなり、ブドウ糖が細胞に十分取り込まれなくなった状態のことです。
最近の研究により、高脂質食に含まれるパルミチン酸のような飽和脂肪酸[1]が、インスリン抵抗性を引き起こすことが分かっています。2012年に平林義雄チームリーダー(研究当時)らは、マウスを用いた実験から、脂肪細胞[8]表面に分布するGタンパク質共役受容体(GPCR)の一種である「GPRC5B」がインスリン抵抗性に深く関わっていることを突き止めました注1)。今回、研究グループは、GPRC5Bの機能を詳しく調べることで、パルミチン酸が引き起こすインスリン抵抗性の分子機構の解明に挑みました。
注1)2012年11月21日プレスリリース「肥満に関わる膜タンパク質GPRC5Bの機能を解明」
研究手法と成果
研究グループはまず、GPRC5Bの機能とインスリン感受性(インスリンに対する反応)との関係を調べました。パルミチン酸は、細胞内のさまざまな脂質の性質や量の変動をもたらします。その代表的なものに生理活性脂質であるセラミド[9]の蓄積があり、セラミド蓄積はインスリン抵抗性の直接的な原因として考えられてきました。そこで、GPRC5B遺伝子を欠損したマウス線維芽細胞を作製し、野生型細胞とGPRC5B欠損細胞に、それぞれパルミチン酸を添加し培養しました。その結果、GPRC5B欠損細胞ではセラミド蓄積が見られず、野生型細胞に比べてインスリン感受性が高いことが分かりました(図1)。
セラミドは、「スフィンゴミエリン合成酵素2(SMS2)」により、細胞膜の主な脂質成分であるスフィンゴミエリン(SM)に変換されます。SMS2遺伝子を欠損した細胞にパルミチン酸を添加し培養したところ、セラミドが蓄積したにもかかわらず、インスリン抵抗性は見られないことが分かりました。そこで、細胞培養液にパルミチン酸を添加し培養後、GPRC5BとSMS2の相互作用を共鳴蛍光エネルギー移動(FRET)法[10]で調べた結果、それらの相互作用が強まることが示されました(図2A)。 また、リン酸化酵素Fynを動員しないGPRC5B変異体を発現する細胞にパルミチン酸を添加し培養したところ、SMS2リン酸化の促進は見られませんでした(図2B)。これらの結果から、パルミチン酸が存在するとGPRC5BはFynを動員することで、SMS2のリン酸化を促進することが分かりました。
SMS2は、セラミドとリン脂質のホスファチジルコリンからSMを合成します。その反応の副産物として産生されるジアシルグリセロール(DAG)は、リン酸化酵素のプロティンキナーゼCを活性化します。そこで、SMS2に対するとリン酸化の影響に着目して研究を進めた結果、リン酸化されていないSMS2は不安定で、ユビキチン化[11]により分解されやすい反面、リン酸化されたSMS2は分解されにくいことが分かりました(図3A,B)。さらに、SMS2にリン酸化類似体を導入したSuper-SMS2は、野生型SMS2よりもさらにユビキチン化が抑制されることが分かりました(図3C)。
次に、SMS2のリン酸化がパルミチン酸によるインスリン抵抗性に関与するかを確かめるため、GPRC5B欠損細胞にSMS2またはSuper-SMS2を発現させ、パルミチン酸を添加し培養した後インスリン感受性を調べました。その結果、Super-SMS2の発現とインスリン抵抗性の間に強い相関が認められました(図4A)。また、SMS2の活性産物であるホスファチジルコリン由来のDAGを測定した結果、Super-SMS2を発現している細胞から高いDAGの産生が見られました(図4B)。これらの結果から、パルミチン酸存在下において、GPRC5BはSMS2の発現を増大させることでDAGの量が増加し、その結果、SMS2のリン酸化が進み、インスリン抵抗性が誘導されるという新しい分子機構が明らかになりました(図5)。
今後の期待
これまで、飽和脂肪酸によるインスリン抵抗性は、主にセラミド蓄積が直接的な原因であるとされてきましたが、本研究により、SMの生合成とその反応過程で生じる生理活性脂質DAGが重要な役割をすることが明らかになりました。GPRC5BとSMS2が肥満を原因とする疾患の新たな標的であることが示され、今後の新しい予防・治療法の開発に貢献すると期待できます。
原論文情報
Yeon-Jeong Kim, Peter Greimel, Yoshio Hirabayashi, “GPRC5B-mediated sphingomyelin synthase 2 phosphorylation plays a critical role in insulin resistance”, iScience, 10.1016/j.isci.2018.10.001
発表者
理化学研究所
主任研究員研究室 佐甲細胞情報研究室
客員研究主幹 平林 義雄(ひらばやし よしお)
脳神経科学研究センター 神経細胞動態研究チーム
研究員 金 然正(キム ヨンジョン)
脳神経科学研究センター 細胞機能探索技術研究チーム
専任研究員 グレイメル・ペーター(Peter Greimel)
報道担当
理化学研究所 広報室 報道担当
補足説明
-
- パルミチン酸、飽和脂肪酸
- パルミチン酸は炭素数16個の飽和脂肪酸である。飽和脂肪酸とは、分子内に二重結合を持たない脂肪酸のこと。
-
- Gタンパク質共役受容体(GPCR)
- Gタンパク質共役受容体は、細胞表面に発現して、Gタンパク質を介して細胞外シグナルを細胞内に伝達する膜タンパク質である。細胞外側のリガンド結合部位と細胞膜内の7回膜貫通ヘリックスドメインからなる特徴的な共通構造を持っている。多くの疾患に関与しているため、新薬開発の主要な標的とされている。そのうち、クラスCのGPCRは、グルタミン酸受容体およびGABA受容体など、脳の生理機能に重要な受容体が集まっている。GPCRは、G Protein-Coupled Receptorの略。
-
- GPRC5B
- クラスCに属するGPCRの一つで、細胞の形質膜やゴルジ体、また細胞外分泌小胞(エクソソーム)に分布する。
-
- スフィンゴミエリン
- 動物細胞における細胞膜の主要な構成脂質。スフィンゴミエリンは生理活性脂質であるセラミドやスフィンゴシン1-リン酸の前駆体であるとともに、コレステロールとともに特徴的な脂質ドメイン「脂質ラフト」を形成する。脂質ラフトは情報伝達や膜輸送において重要な役割を果たしていることが示されている。
-
- インスリン抵抗性
- すい臓から分泌されるインスリンは、肝臓や筋肉に糖分を取り込ませることで血糖値を下げる作用がある。このインスリンが正常に作用しなくなった状態のことをインスリン抵抗性と呼ぶ。インスリン抵抗性はインスリン感受性(インスリンに対する反応)を低下させ、すい臓が食後の高血糖値を感知してインスリンを分泌しても、筋肉や肝臓が血液中の糖分をあまり取り込めないため、血糖値が下がらない。肥満や敗血症はインスリン抵抗性を誘導する。
-
- 2型糖尿病
- 糖尿病とは、インスリン作用の低下により、慢性的に高血糖が持続する病気である。正しく治療されないと、さまざまな臓器が侵され合併症をきたす。糖尿病に特有の糖尿病網膜症、腎症、神経障害といった細小血管症に加え、全身の太い血管にも動脈硬化が進みやすくなり、心筋梗塞や脳梗塞を引き起こす。なかでも2型糖尿病は、インスリン分泌低下とインスリン抵抗性(インスリンの働きが悪くなること)が合わさることによって血糖値が上昇し、糖尿病になるタイプである。発症には、遺伝因子(家系)と環境因子(過食、肥満、運動不足などの生活習慣)の両者が深く関わっていることが知られている。
-
- Fyn
- リン酸化酵素のSrcファミリーチロシンキナーゼの一種。脂質ラフトに存在する代表的な酵素であり、タンパク質相互作用により、その酵素活性が制御される。細胞の増殖および情報伝達システムに重要な役割を担っている。
-
- 脂肪細胞
- 脂肪を中に貯蔵する細胞。白色脂肪細胞と褐色脂肪細胞に分けられるが、肥大化して肥満をもたらすのは白色脂肪細胞で、脂肪細胞の約99%を占める。褐色脂肪細胞は、脂肪を燃焼して熱を産生する細胞である。特にことわりがない場合、脂肪細胞とは白色脂肪細胞のことを指す。
-
- セラミド
- スフィンゴミエリンと糖脂質の前駆体であり、細胞死およびインスリン抵抗性を引き起こす生理活性脂質。皮膚の角層においては、透過バリアを構成する重要な成分である。
-
- 共鳴蛍光エネルギー移動(FRET)法
- 二つの蛍光分子がごく近接して存在する場合、一つの蛍光分子(ドナー)からもう一つの蛍光分子(アクセプター)へエネルギーが移行する。これを蛍光共鳴エネルギー移動(FRET)と呼ぶ。FRET法とは、FRETを利用してタンパク質間の相互作用を検出する実験手法。FRETはFluorescence Resonance Energy Transferの略。
-
- ユビキチン化
- 細胞内で不要になったタンパク質は、プロテアソームとリソソームに運ばれ分解される。ユビキチン修飾は分解すべきタンパク質の修飾タグである。ユビキチン修飾を受けたタンパク質は速やかにプロテアソームとリソソームに運ばれる。
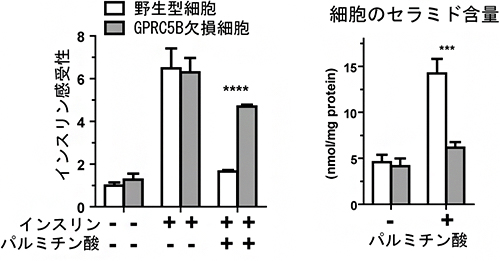
図1 パルミチン酸によるインスリン感受性(左)とセラミド蓄積(右)
野生型細胞とGPRC5B欠損細胞にパルミチン酸を添加し、16時間培養した後、インスリン感受性とセラミド含量を調べた。その結果、GPRC5B欠損細胞は野生型細胞に比べて、インスリン感受性が高く、セラミドも蓄積されなかった。
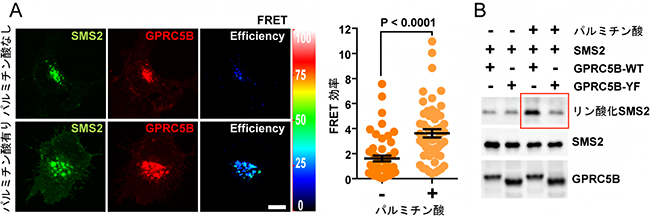
図2 パルミチン酸存在下におけるGPRC5B依存的SMS2のリン酸化
(A)細胞培養液にパルミチン酸を添加し、16時間培養した後、GPRC5Bとスフィンゴミエリン合成酵素2(SMS2)の相互作用を共鳴蛍光エネルギー移動(FRET)法で検出した。パルミチン酸存在下では、GPRC5BとSMS2の相互作用が強まることが分かった。緑と赤はそれぞれSMS2とGPRC5Bの分布を示し、青は相互作用の程度を示す。
(B)細胞培養液にパルミチン酸を添加し、8時間培養した後、SMS2のリン酸化を検出した。Fynを動員しないGPRC5Bの変異体(GPRC5B-YF)では、パルミチン酸存在下でも、SMS2リン酸化の促進が見られなかった。
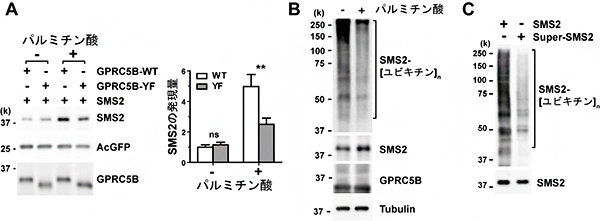
図3 パルミチン酸存在下でのGPRC5B依存的SMS2のリン酸化とSMS2発現量
(A)細胞培養液にパルミチン酸を添加し、16時間培養した後、SMS2の発現量を測定した。野生型GPRC5B(GPRC5B-WT)ではSMS2の発現量が著しく増大したのに対し、Fynを動員しないGPRC5B変異体(GPRC5B-YF)では微増したのにとどまった。
(B)細胞培養液にパルミチン酸を添加し、8時間培養した後、SMS2のユビキチン化を検出した。SMS2のユビキチン化は抑制された。
(C)SMS2のリン酸化類似体であるSuper-SMS2では、ユビキチン化が抑制された。
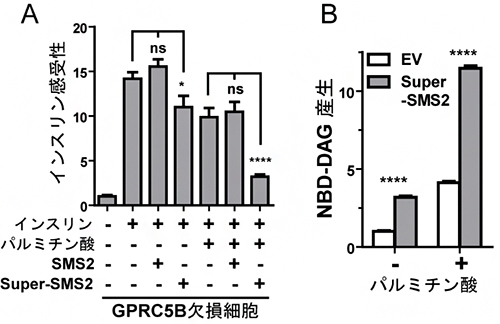
図4 パルミチン酸存在下でのGPRC5B依存的SMS2リン酸化によるSMS2発現の増大
(A)GPRC5B欠損細胞にSMS2またはSuper-SMS2を発現させ、インスリン感受性を評価した。Super-SMS2を発現させた細胞ではパルミチン酸を添加すると、インスリン感受性が低下しインスリン抵抗性を示した。
(B)GPRC5B欠損細胞にSuper-SMS2を発現させ、その活性産物であるジアシルグリセロール(NBD-DAG)を定量した。パルミチン酸を添加すると、DAGが多く産生された。
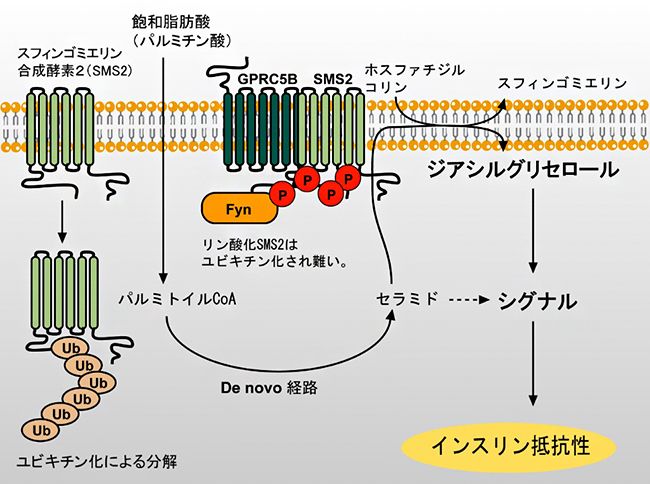
図5 インスリン抵抗性を示す分子機構
パルミチン酸による脂質変動は、GPRC5BとSMS2の相互作用を強める。GPRC5Bにより動員されたFynはSMS2をリン酸化する。リン酸化されていないSMS2は不安定でユビキチン化により分解されるが、リン酸化SMS2はユビキチン化されにくく安定であり、高い発現量を維持する。一方、パルミチン酸によってセラミドの生合成が増加し、その一部はSMS2によりスフィンゴミエリンに変換される。この過程で産生されるジアシルグリセロールがインスリン抵抗性を引き起こすと考えられる。