GPCRを標的とした創薬研究に大きく貢献
2018-12-14 京都大学
木下正弘 エネルギー理工学研究所教授、村田武士 千葉大学教授、安田賢司 同特任助教、小林拓也 関西医科大学教授、寿野良二 同講師、岩田想 医学研究科教授らの研究グループは、ヒトGPCRであるムスカリンM2受容体やプロスタグランジンEP4受容体に対する耐熱化変異体(耐熱化置換体)を同定し、X線結晶構造解析を用いて両受容体の立体構造の解明に成功しました。また、これらの耐熱化変異体では、アゴニスト(作動薬)やアンタゴニスト(阻害剤)に対する結合親和性が変化していることが見出されました。
本研究成果により、本耐熱化変異体を用いることにより立体構造解析が可能となるばかりでなく、阻害剤等のスクリーニングが容易となり、GPCRを標的とした創薬研究への貢献が期待されます。
本研究成果は、2本の論文として、2018年11月12日および12月3日に、国際学術誌「Nature Chemical Biology」のオンライン版に掲載されました。
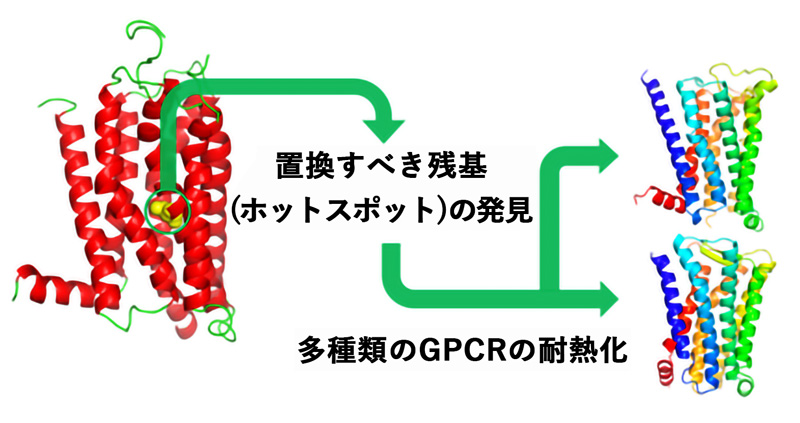
図:本研究の概要図
詳しい研究内容について
―GPCR を標的とした創薬研究に大きく貢献―概要京都大学エネルギー理工学研究所 木下正弘 教授は、千葉大学大学院理学研究院 村田武士 教授、安田賢司 同特任助教らと協力して、先に開発した統計熱力学に基づく理論的予測法(エントロピー基盤法注 1))を用い ることにより、重要な創薬標的ファミリーである G タンパク質共役型受容体 (GPCR)を耐熱化することがで きる共通のアミノ酸置換箇所を発見することに成功していました。この成果を踏まえて本研究では、関西医科 大学 清水(小林)拓也 教授、寿野良二 同講師、京都大学 岩田想 教授らと共同で、ヒト GPCR であるムス カリン M2 受容体やプロスタグランジン EP4 受容体に対する耐熱化変異体 (耐熱化置換体)を同定し、X 線結 晶構造解析注 2)を用いて両受容体の立体構造の解明に成功しました。これらの耐熱化変異体では、アゴニスト (作動薬)注 3)やアンタゴニスト (阻害剤)注 4)に対する結合親和性が変化していました。このことから、本耐 熱化変異体を用いることにより立体構造解析が可能となるばかりでなく、阻害剤等のスクリーニングが容易と なり、GPCR を標的とした創薬研究に大きく貢献できると期待されます。
本研究成果は、2018 年 11 月 12 日および 12 月 3 日に国際学術誌「Nature Chemical Biology」にオンライ ン公開されました。
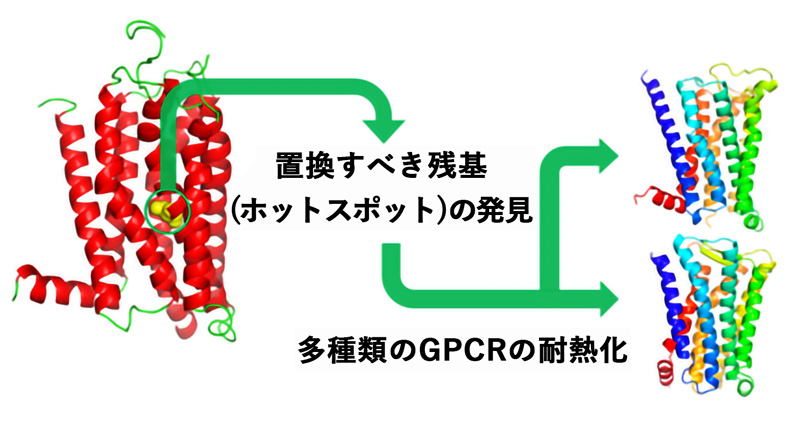
図. 研究成果全体の概要図1.背景
人の体の中には約 800 種類もの G タンパク質共役型受容体 (GPCR)が存在し、生体膜内外の情報伝達に大切な役割を果たしています。このため GPCR は重要な創薬標的ファミリーであり、現在市販されている薬の約 30%以上は GPCR を標的としていることが知られています。GPCR を安定かつ大量に調製できるようになれば、その機能の解明や薬のスクリーニング、X線結晶構造解析等による立体構造決定が容易になります。しかし、GPCR は一般に熱安定性が低いため取り扱いが難しく、大量調製が困難でした。私たちは最近、GPCR を 含む膜タンパク質を耐熱化させるアミノ酸置換を経験則に頼らずに純理論的に予測する方法 (エントロピー基 盤法注 1))を開発しました(国内特許登録済:第 6359656 号、国際特許出願中:WO2015/1991621A1) (図 1)。本研究では、複数の GPCR に対してエントロピー基盤法による耐熱化変異体の予測を行うことにより、多 くの GPCR の耐熱化に繋がる共通のアミノ酸置換箇所すなわち「ホットスポット」を発見しました。2.研究手法・成果
本研究では、アデノシン A2a 受容体 (A2aR)、M2 ムスカリン受容体 (M2R)、プロスタグランジン EP4 受 容体 (EP4R)を含む 8 種類のヒト GPCR にエントロピー基盤法を適用し、それぞれの耐熱化変異体を予測し ました。その結果、Ballesteros-Weinstein (BW)番号注 5)が 3.39 に位置するアミノ酸残基が 「ホットスポッ ト」であり、それのアルギニンまたはリジンへの置換により耐熱化すると予測されました(図 2)。そこで、 A2aR、M2R、EP4R について実際に置換を導入し、変性温度を測定したところ、A2aR では 9℃、M2R では 5℃、EP4R では 6.5℃の熱変性温度の上昇が観測されました。また、これらの耐熱化変異体はアゴニスト注 3) に対する結合親和性が低下する一方で、特定のアンタゴニスト注 4)(阻害剤)に対する結合親和性は向上して いました。これらの変異体を用いて化合物スクリーニングを行うことにより、特定の阻害剤の選別が容易にな ると期待されます。さらに、M2R 変異体では、アンタゴニスト結合型の結晶構造の分解能が 3Åから 2.3Åへ 向上し、新規の選択的アンタゴニスト結合型の結晶構造解析に成功しました (図 3)。EP4R 変異体に関しても X 線回折分解能が 6Åから 3.4Åへ向上し、新規の結晶構造の解明に成功しました(図 4)。3.波及効果、今後の予定
本研究により、複数の GPCR を耐熱化できる共通のアミノ酸置換箇所の発見に成功しました。この BW 番 号 3.39 のアミノ酸残基は多くの Class A の GPCR において保存されており、これらの GPCR に関しても同様 に耐熱化できる可能性が期待されます。本研究で発見されたアミノ酸置換により、今まで大量調製が難しかっ た多くの創薬標的の GPCR を耐熱化させ、大量生産することが可能になります。ただし、ホットスポット以外 のアミノ酸残基を置換した方がより大きな安定化に繋がる場合や、ホットスポットの置換では安定化が得られ ない場合も見つかっています。いずれにせよ、アゴニスト注 3)やアンタゴニスト注 4)に対する結合親和性が変 化する耐熱化置換箇所を数多く発見することができています。これらの性質の異なる耐熱化変異体を活用する ことにより、薬剤探索や機能解析 構造解析が飛躍的に進展すると期待できます。そしてこれらの構造機能情 報は多くの波及効果をもたらし、関連する生命機能や疾病原因の理解から医薬品開発までの我が国のライフサ イエンスの推進に大きく貢献できると考えています。
4.研究プロジェクトについて
本研究は、内閣府の総合科学技術 イノベーション会議が主導する革新的研究開発推進プログラム (ImPACT)、日本医療研究開発機構の創薬等先端技術支援基盤プラットフォーム(BINDS)等の支援を受け て行われました。
<研究者のコメント>
ホットスポットのアルギニンまたはリジンへの置換により,すでにかなり多くの GPCR の耐熱化に成功して います。ホットスポット以外のアミノ酸を置換する方がより大きな耐熱化に繋がる場合や,ホットスポットの 置換では耐熱化が得られない場合も見出されていますが,そのような場合でさえ,私たちの理論により大きな 耐熱化に繋がるアミノ酸置換を特定することができています。
<用語解説>
注 1)エントロピー基盤法
膜タンパク質を耐熱化させるアミノ酸置換を理論的に予測する方法。生体膜を形成するリン脂質の炭化水素鎖 の並進配置エントロピーに初めて着目した点に特徴があり、可能なあらゆるアミノ酸単置換の中から耐熱化の 可能性の高い候補を短時間で予測することができる。単置換のみならず、多重置換を吟味することもできる。
注 2)X線結晶構造解析
解析対象のタンパク質を結晶化し、X線照射によって得られる回折データから、タンパク質の原子レベルでの 立体構造を決定する手法。
注 3)アゴニスト(作動薬)
受容体に結合し、神経伝達物質やホルモンなどの生体内物質(リガンド)と同様の機能を示す物質のこと。
注 4)アンタゴニスト(拮抗剤)
受容体には結合するが、受容体の作用自体は起こさない物質で、本来結合すべき生体内物質が受容体に結合す ることを阻害する。
注 5)Ballesteros-Weinstein(BW)番号
GPCR 中のアミノ酸残基の位置を指定する番号。X 番目のヘリックスに対して、それぞれ GPCR の間で最も保 存されている残基を X.50 と命名する。そのヘリックス上の他のすべての残基は、この保存された位置を基準 として番号付けされる。
<本研究グループによる関連先行研究> タイトル:Hot-Spot Residues to be Mutated Common in G Protein-Coupled Receptors of Class A: Identification of Thermostabilizing Mutations Followed by Determination of ThreeDimensional Structures for Two Example Receptors(クラス A の G タンパク質共役型受容体 (GPCR)に共通の置換すべき残基 (ホットスポット):耐熱化に繋がる置換の特定と 2 種類の GPCR に対する 3 次元立体構造の決定)
著 者:Satoshi Yasuda, Yuta Kajiwara, Yosuke Toyoda, Kazushi Morimoto, Ryoji Suno, So Iwata, Takuya Kobayashi, Takeshi Murata, and Masahiro Kinoshita
掲 載 誌:The Journal of Physical Chemistry B DOI:10.1021/acs.jpcb.7b02997 *2017 年 6 月 23 日公 開
<論文のタイトルと著者>
[1]
タイトル:Structural insights into the subtype-selective antagonist binding to the M2 muscarinic receptor (脂質二重層界面におけるヒトプロスタグランジン受容体 EP4 へのリガンド結合)
著 者 :Ryoji Suno, Sangbae Le, Shoji Maeda, Satoshi Yasuda, Keitaro Yamashita, Kunio Hirata, Shoichiro Horita, Maki S. Tawaramoto, Hirokazu Tsujimoto, Takeshi Murata, Masahiro Kinoshita, Masaki Yamamoto, Brian K Kobilka, Nagarajan Vaidehi, So Iwata, Takuya Kobayashi
掲 載 誌:Nature Chemical Biology DOI:10.1038/s41589-018-0152-y
[2]
タイトル:Ligand binding to human prostaglandin E receptor EP4 at the lipid-bilayer interface(選択的ア ンタゴニスト結合型ヒトムスカリン M2 受容体の構造的解明)
著 者 :Yosuke Toyoda, Kazushi Morimoto, Ryoji Suno, Shoichiro Horita, Keitaro Yamashita, Kunio Hirata, Yusuke Sekiguchi, Satoshi Yasuda, Mitsunori Shiroishi, Tomoko Shimizu, Yuji Urushibata, Yuta Kajiwara, Tomoaki Inazumi, Yunhon Hotta, Hidetsugu Asada, Takanori Nakane, Yuki Shiimura, Tomoya Nakagita, Kyoshiro Tsuge, Suguru Yoshida, Tomoko Kuribara, Takamitsu Hosoya, Yukihiko Sugimoto, Norimichi Nomura, Miwa Sato, Takatsugu Hirokawa, Masahiro Kinoshita, Takeshi Murata, Kiyoshi Takayama, Masaki Yamamoto, Shuh Narumiya, So Iwata, Takuya Kobayashi
掲 載 誌:Nature Chemical Biology DOI:10.1038/s41589-018-0131-3
<参考図>
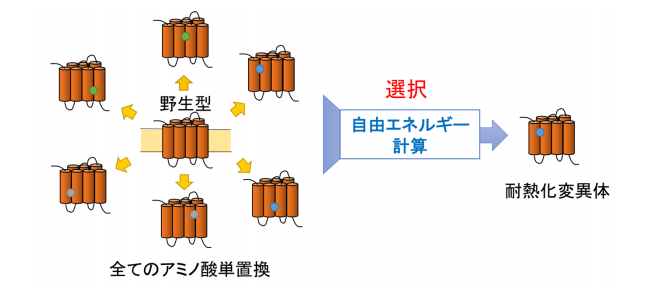
図 1 エントロピー基盤法の概念図 GPCR の可能なあらゆるアミノ酸単置換を施した変異体を計算機上で発生させる。それらのアミノ酸置換に伴う自由エネ ルギー変化を計算し、変化量が十分大きな負の値になる置換が耐熱化をもたらすと予測する。単置換のみならず、多重置 換を吟味することもできる。
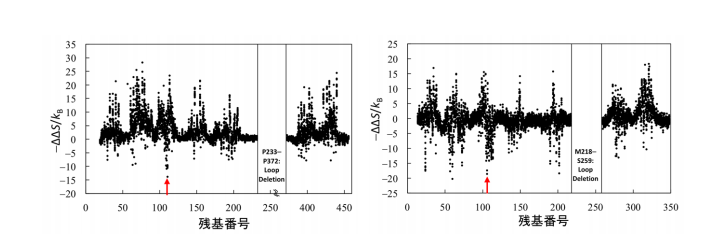
図 2 エントロピー基盤法による耐熱化変異体予測の計算結果 左図が M2 ムスカリン受容体に対する計算結果、右図がプロスタグランジン EP4 受容体に対する計算結果である。ホット スポットである BW 番号 3.39 のアミノ酸残基を赤矢印で示す。
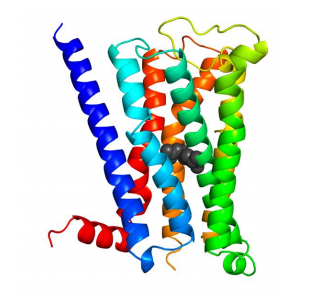
図 3 M2 ムスカリン受容体の耐熱化変異体の結晶構造 M2 ムスカリン受容体の結晶構造のリボン図。アミノ酸置 換により挿入した BW 番号 3.39 の位置のアルギニン残基 を黒色の球で表示している。
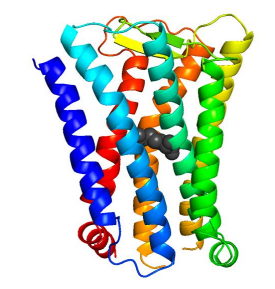
図 4 プロスタグランジン EP4 受容体の耐熱化変異体の結 晶構造 プロスタグランジン EP4 受容体の結晶構造のリボン図。 アミノ酸置換により挿入した BW 番号 3.39 の位置のアル ギニン残基を黒色の球で表示している。