2018-12-28 理化学研究所
理化学研究所(理研)開拓研究本部岩崎RNAシステム生化学研究室の岩崎信太郎主任研究員、生命機能科学研究センター翻訳構造解析研究ユニットの伊藤拓宏ユニットリーダーらの国際共同研究グループ※は、抗がん作用を持つ植物由来の翻訳阻害剤「ロカグラミドA」の作用分子メカニズムを解明しました。 現在、ロカグラミドAは有効な抗がん剤として研究が進められており、本研究成果により、将来、より効果的な抗がん剤の設計が可能になると期待できます。
「アグライア」と呼ばれる植物由来の小分子化合物ロカグラミドAは、標的である翻訳開始因子[1]「eIF4A[2]」に新しいRNA[3]配列特異性を与え、アデニン(A)やグアニン(G)塩基の連続したRNAに特異的に結合するタンパク質へと変化させます。これにより、選択的に翻訳が阻害されることがロカグラミドAによる抗がん作用の原因であると考えられています。しかし、これまでその作用分子メカニズムは全く分かっていませんでした。今回、国際共同研究グループは、ロカグラミドA、ヒトeIF4A、A・Gの連続配列を持つRNA、ATPアナログ[4]の4分子を含む複合体の結晶構造を解明し、ロカグラミドAはeIF4Aに結合しつつ、直接RNAにも結合し、塩基配列を見分けていることを発見しました。また、アグライアのeIF4A遺伝子を新たに同定し、アグライアeIF4AではロカグラミドAと結合しないように、結合位置が変異していることが明らかになりました。これは進化上、植物が有用な化合物を発達させたと同時に自身の身を守る機構を獲得したことを示しています。
本研究は、米国の科学雑誌『Molecular Cell』(2月21日号)の掲載に先立ち、オンライン版(12月27日付け:日本時間12月28日)に掲載されます。
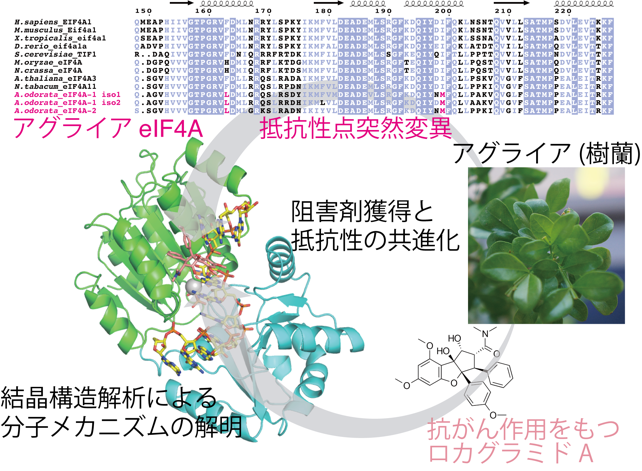
図 ロカグラミドAとeIF4Aの共結晶構造と、アグライアeIF4Aが持つ点変異
※国際共同研究グループ
理化学研究所
開拓研究本部
岩崎RNAシステム生化学研究室
主任研究員 岩崎 信太郎(いわさき しんたろう)
特別研究員 七野 悠一(しちの ゆういち)
テクニカルスタッフI 水戸 麻理(みと まり)
袖岡有機合成化学研究室
主任研究員 袖岡 幹子(そでおか みきこ)
専任研究員 闐闐 孝介(どど こうすけ)
特別研究員 藤原 広一(ふじわら こういち)
生命機能科学研究センター
翻訳構造解析研究ユニット
ユニットリーダー 伊藤 拓宏(いとう たくひろ)
専任研究員 岩崎 わかな(いわさき わかな)
リサーチアソシエイト 髙橋 真梨(たかはし まり)
技師 坂本 恵香(さかもと あやこ)
制御分子設計研究チーム
チームリーダー 本間 光貴(ほんま てるき)
研究員 渡邉 千鶴(わたなべ ちづる)
兵庫県立大学 工学部・大学院工学研究科
教授 今高 寛晃(いまたか ひろあき)
星薬科大学 薬品物理化学教室
准教授 福澤 薫 (ふくざわ かおり)
カルフォルニア大学サンフランシスコ校 Department of Cell and Tissue Biology Helen Diller Family Comprehensive Cancer Center
助教授 スティーブン・フロー(Stephen N. Floor)
カルフォルニア大学バークレー校 Department of Molecular and Cell Biology
助教授 ニコラス・インゴリア(Nicholas T. Ingolia)
※研究支援
本研究は、本研究は、日本学術振興会(JSPS)科学研究費補助金若手研究A「翻訳開始因子パラログによる選択的翻訳の網羅的解析(研究代表者:岩崎信太郎)」、同新学術領域研究「Chasing translation along the time by novel ribosome profiling(研究代表者:岩崎信太郎)」、同新学術領域研究「ピコルナウイルスの2Aペプチドの終止コドン非依存的翻訳終結の構造基盤(研究代表者:伊藤拓宏)」、同新学術領域研究「ウイルスが引き起こす非標準的な翻訳機構の構造基盤(研究代表者:伊藤拓宏)」、同基盤研究B「HCV IRESによるリボソーム・ハイジャックの分子機構(研究代表者:伊藤拓宏)」、武田科学振興財団ライフサイエンス研究奨励「抗がん作用をもつ翻訳阻害剤Rocaglamide Aの作用機序の解明(研究代表者:岩崎信太郎)」、同ライフサイエンス研究奨励「真核生物の翻訳開始制御機構の解明(研究代表者:伊藤拓宏)」による支援を受けて行われました。
背景
特定のRNA配列に結合する小分子化合物は、従来標的とすることのできなかったタンパク質やRNA、あるいはそれらの複合体に対する新たな戦略として注目を集めています。しかし、そのような活性を示す小分子の例はこれまでほとんど報告されてきませんでした。
特異的RNA配列を標的とする小分子化合物の数少ない例として、「ロカグラミドA」が報告されています。ロカグラミドAは、標的である翻訳開始因子に結合します。もともと翻訳開始因子「eIF4A」はRNA結合タンパク質ですが、「RNA配列特異性」を持ちません。しかし、ロカグラミドAと結合したeIF4Aには、これまで持っていなかったアデニン(A)やグアニン(G)塩基が連続した配列(ポリプリン配列)に対する新しいRNA配列特異性が生じます。最終的にロカグラミドAは、ポリプリン配列を持つRNAからの翻訳を抑制します。ロカグラミドAは抗がん作用を持つことで知られており、以上のような配列特異性が抗がん作用の原因であると考えられてきました。
しかし、どのようなメカニズムでロカグラミドAが新しいRNA配列特異性をeIF4Aに付与しているのか、といった基本的な作用分子メカニズムは全く分かっていませんでした。また、ロカグラミドAは「アグライア(Aglaia odorata、和名:樹蘭)」と呼ばれる植物が持つ二次代謝産物[5]ですが、なぜアグライアではロカグラミドAによる翻訳の阻害が生じないのかという点も未解明のままでした。今回、国際共同研究グループは、これらの謎の解明に挑みました。
研究手法と成果
国際共同研究グループはまず、X線結晶構造解析[6]によりロカグラミドA、ヒトeIF4A、A・G塩基連続配列を持つRNA、ATPアナログの4分子を含む複合体の立体構造を解明しました(図1A)。この解析により、ロカグラミドAは標的であるeIF4AとA・G連続配列を持つRNAが形成する特異的な「ポケット」に結合していることが明らかになりました。
また、ロカグラミドAはeIF4AとRNAの塩基の両方に直接結合し、特に、ウラシル(U)・シトシン(C)塩基にはないA・G塩基中の窒素原子と直接水素結合をすることによって、塩基を特異的に認識していることが分かりました(図1B)。これらの結果は、ロカグラミドAによる新しいRNA配列特異性の原理を原子レベルで解明できたことを示しています。
また、アグライアからRNAを単離し、次世代シーケンサー[7]で解析することで、アグライアのトランスクリプトーム[8]を再構築することにより、アグライアのeIF4A遺伝子の配列を明らかにしました。X線結晶構造解析から、ロカグラミドAが結合するeIF4A上のアミノ酸残基が明らかになりましたが、アグライアeIF4Aは正にそのアミノ酸残基が点突然変異[9]により変異していることが分かりました(図2)。実際に、そのような点突然変異をヒトeIF4Aに付与するとロカグラミドAによる翻訳抑制は起こらなくなりました。つまりアグライアeIF4Aでは、ロカグラミドAと結合しないように結合位置が変異していたのです。
以上の結果から、アグライアは進化上、有用な二次代謝産物であるロカグラミドAを生産するようになった過程で、自分自身を攻撃しないよう翻訳開始因子を変異させたことが明らかになりました。
今後の期待
現在、ロカグラミドAは抗がん剤として有望視されている小分子化合物です。本研究で明らかになった結晶構造から、より効果の高いロカグラミドA誘導体を設計し、抗がん剤として展開することが期待できます。また、アグライアで見られるような点突然変異はヒトにもまれに見つかることから、そのような点突然変異を事前に調べることで、ロカグラミドAががん細胞に効きやすいかを事前に診断できると考えられます。
原論文情報
Shintaro Iwasaki, Wakana Iwasaki, Mari Takahashi, Ayako Sakamoto, Chiduru Watanabe, Yuichi Shichino, Stephen N. Floor, Koichi Fujiwara, Mari Mito, Kosuke Dodo, Mikiko Sodeoka, Hiroaki Imataka, Teruki Honma, Kaori Fukuzawa, Takuhiro Ito, and Nicholas T. Ingolia, “The translation inhibitor Rocaglamide targets a bimolecular cavity between eIF4A and polypurine RNA”, Molecular Cell, 10.1016/j.molcel.2018.11.026
発表者
理化学研究所
主任研究員研究室 岩崎RNAシステム生化学研究室
主任研究員 岩崎 信太郎(いわさき しんたろう)
生命機能科学研究センター 翻訳構造解析研究ユニット
ユニットリーダー 伊藤 拓宏(いとう たくひろ)
報道担当
理化学研究所 広報室 報道担当
補足説明
-
- 翻訳開始因子
- 翻訳の開始に必須なタンパク質群を指す。特に真核生物の翻訳開始因子はeukaryotic translation initiation factor(eIF)と略される。タンパク質合成装置であるリボソームを、メッセンジャーRNA(mRNA)上にリクルートする役割を持つ。
-
- eIF4A
- 翻訳開始因子の一つであるDEAD-box型RNA結合タンパク質。mRNAの5非翻訳領域に結合し、RNAの二次構造を解きほぐすなどの機能により、翻訳開始を促進すると考えられている。
-
- RNA
- ゲノムは細胞が持つ全遺伝情報であり、DNA(デオキシリボ核酸)という生体高分子に4種類の塩基の配列として記録されている。ゲノムの中の遺伝情報が記録(コード)された領域が遺伝子である。遺伝子領域の情報は、DNAを鋳型としてRNA(リボ核酸)が合成(転写)されることで読み出される。
-
- ATPアナログ
- アデノシン三リン酸(ATP)は水中で徐々に分解されてしまうため、生体分子のATP結合状態を解析する際には、水によって分解されにくいATPに類似した構造を持つ化合物を用いて実験を行うことがあり、この化合物をATPアナログという。今回はATPアナログの一つであるβ,γ-イミドアデノシン三リン酸(AMPPNP)を用いた。
-
- 二次代謝産物
- 生物体を構成、維持する上で重要な物質を一次代謝産物と呼ぶ。一方、生育そのものには必要とされない代謝産物を二次代謝産物と呼び、抗生物質などが含まれる。
-
- X線結晶構造解析
- タンパク質などの結晶を作製し、その結晶にX線を照射して得られる回折データを解析することにより、分子の内部の原子の立体的な配置を調べる方法。この方法によって、分子の立体構造や内部構造を知ることができる。
-
- 次世代シーケンサー
- DNAの塩基配列を決定するための装置で、DNA断片の塩基配列を同時並行的に、より高速高精度に決定することができる。
-
- トランスクリプトーム
- ゲノムDNAを鋳型としてRNA分子が合成されることを転写(トランスクリプション)と呼び、転写の結果合成されたRNA分子のことを転写産物と呼ぶ。細胞中にはさまざまなRNA分子がそれぞれの量で存在している。このようなRNA分子の総体を、転写産物を表す「トランスクリプト」に、総体を表す接尾語「オーム」をつなげて「トランスクリプトーム」と呼ぶ。
-
- 点突然変異
- ゲノム塩基配列中で一塩基のみ変異したもの。点変異ともいう。
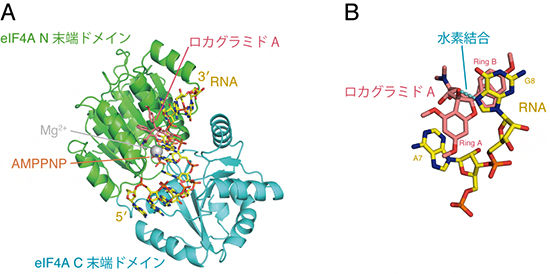
図1 ロカグラミドAとeIF4Aの結合
A ロカグラミドA、ヒトeIF4A、A・G塩基連続配列を持つRNA、ATPアナログ(AMPPNP)の4分子を含む複合体の立体構造。ロカグラミドAは標的であるeIF4AとA・G連続配列を持つRNAが形成する特異的な「ポケット」に結合している。
B ロカグラミドAの水素原子とRNAのA・G塩基中の窒素原子間で形成される水素結合。この水素結合により塩基が特異的に認識される。
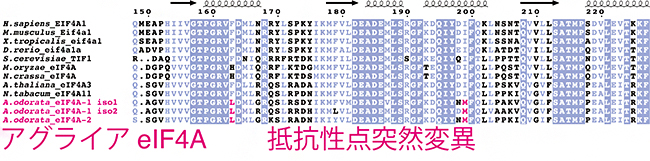
図2 アグライアeIF4Aの抵抗性点突然変異
上から9行目までが代表的な真核生物のeIF4Aの配列で、その下の3行がアグライアeIF4Aの配列。アグライアeIF4A配列中のピンクで示したアミノ酸(L:ロイシンとM:メチオニン)が、点突然変異による変異を示している。


