2019-01-30 理化学研究所
理化学研究所(理研)生命医科学研究センター免疫シグナル研究チームの今西貴之研究員、斉藤隆チームリーダーらの国際共同研究グループ※は、T細胞[1]の病原体センサーが抗ウイルス応答を誘導し、抗腫瘍免疫に重要な役割を果たすことを明らかにしました。
本研究成果は、感染症やがんの新たな治療法の開発に貢献すると期待できます。
ウイルスや細菌が私たちの体の細胞の中(細胞質)に侵入すると、病原体センサーの「STING」が感知し、Ⅰ型インターフェロン[2]の産生を介して抗ウイルス応答を誘導し、病原体を排除することが知られています。この抗ウイルス応答は、主に樹状細胞[3]やマクロファージ[4]などの自然免疫[5]を担当する細胞が行い、その後の抗原特異的な獲得免疫[5]を誘導すると考えられています。さらに、STINGの活性化は感染免疫応答だけでなく、抗腫瘍免疫にも重要な役割を果たすことが報告されています。
今回、国際共同研究グループは、STINGが獲得免疫を担うT細胞に強く発現していることを発見し、その機能解析を行いました。その結果、STINGの活性化により、T細胞が強力なⅠ型インターフェロン応答を誘導するとともに、T細胞増殖を阻害すること、さらにT細胞のSTINGが抗腫瘍免疫に重要な役割を果たすことが明らかになりました。
本研究成果は、国際科学雑誌『Life Science Alliance』(2月号)に掲載されるに先立ち、オンライン版(1月25日付け)に掲載されました。
※国際共同研究グループ
理化学研究所 生命医科学研究センター
免疫シグナル研究チーム
チームリーダー 斉藤 隆(さいとう たかし)
研究員 今西 貴之(いまにし たかゆき)
テクニカルスタッフⅠ 海野 緑(うんの みどり)
テクニカルスタッフ(研究当時)小林 若菜(こばやし わかな)
(現:粘膜免疫研究チーム テクニカルスタッフⅡ)
テクニカルスタッフⅡ 米田 奈津美(よねだ なつみ)
メタボローム研究チーム
チームリーダー 有田 誠(ありた まこと)
副チームリーダー 池田 和貴(いけだ かずたか)
関西医科大学 付属生命医学研究所
准教授 松田 達志(まつだ さとし)
金沢大学 がん進展制御研究所
教授 平尾 敦(ひらお あつし)
助教(研究当時)星居 孝之(ほしい たかゆき)
(現:ハーバード大学ダナファーバーがん研究所)
東京大学 医科学研究所
教授 三宅 健介(みやけ けんすけ)
マイアミ・ミラー医学研究院
教授 グレン・バーバー(Glen N. Barber)
医薬基盤・健康・栄養研究所 ワクチン・アジュバント研究センター
センター長 石井 健(いしい けん)
大阪大学 免疫学フロンティア研究センター
教授 審良 静男(あきら しずお)
※研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金 基盤研究C「細胞質DNAセンサーによるT細胞の活性化制御機構の解明(研究代表者:今西貴之)」、基盤研究S「T細胞活性化制御の時空間的構造的解析(研究代表者:斉藤隆)」による支援を受けて行われました。
背景
私たちの体の細胞には、病原体の侵入を見分ける免疫システムとしてパターン認識受容体[6]が備わっています。パターン認識受容体は、病原体に特有の構造を認識して、迅速な自然免疫応答を誘導するとともに、その後の抗原特異的な獲得免疫の活性化を効果的に誘導することが知られています。「STING」はパターン認識受容体の一つで、細菌が細胞質に侵入した際に放出する環状ジヌクレオチド[7]や、ウイルスが細胞質に侵入した際に宿主細胞(抗原提示細胞)で生成されるcGAMP[8]を認識して、Ⅰ型インターフェロンを産生することにより抗ウイルス応答を誘導します。さらに、STINGは感染免疫のみならず、さまざまな自己免疫疾患[9]や細胞の老化、がん免疫応答に重要であることが近年示されています。
斉藤チームリーダーらは、これまで獲得免疫の担い手であるT細胞におけるパターン認識受容体の役割を解析してきました。パターン認識受容体のToll様受容体2(TLR2)が細胞内に寄生する病原体の排除に重要なヘルパーT細胞[10]のTh1細胞を直接活性化すること注1)や、TLRのリガンド(受容体に相互作用する分子)の一種である核酸が、アレルギー反応に重要なTh2細胞の分化を誘導すること注2)などを明らかにしてきました。しかし、STINGのT細胞における役割は不明でした。そこで今回、国際共同研究グループはSTINGの活性化がT細胞の機能に及ぼす影響を調べました。
注1)Imanishi, T., et al. TLR2 directly triggers Th1 effector functions. J. Immunol. 178:6715-6719, 2007.
注2)2014年4月10日プレスリリース「アレルギー反応を引き起こす新たな誘導因子を発見」
研究手法と成果
国際共同研究グループがT細胞におけるSTINGの発現を調べたところ、T細胞は自然免疫を担う樹状細胞と同じ程度にSTINGを発現していることを見いだしました。そこで、T細胞がSTINGのリガンドのcGAMPに反応して、Ⅰ型インターフェロンを産生できるかを調べた結果、自然免疫細胞とは異なり、ナイーブT細胞[11]をcGAMPだけで刺激しても、Ⅰ型インターフェロンは産生されませんでした(図1A)。しかし、T細胞を活性化するT細胞抗原受容体(TCR)[12]の刺激とともにナイーブT細胞をcGAMPで刺激すると、多量のⅠ型インターフェロンを産生することが分かりました(図1B)。さらに、ナイーブT細胞が分化したエフェクターT細胞(Th1細胞や、ウイルスや腫瘍の排除に重要な活性化したCD8T細胞)を同様に刺激すると、自然免疫細胞の10倍も多量のⅠ型インターフェロンが産生されることが分かりました(図1C)。興味深いことに、TCR刺激で誘導されるT細胞の増殖がcGAMP刺激により強く阻害されました(図1B)。
そこで、STINGの活性化によるT細胞の増殖阻害のメカニズムについて調べました。TCR刺激によるT細胞の増殖シグナルには、栄養センサーのmTOR複合体1(mTORC1)[13]の活性化が必須であるため、cGAMP存在下におけるmTORC1シグナルの活性化を調べました。その結果、mTORC1の下流で働く分子(4E-BP1、S6キナーゼ1)の活性化が、cGAMP刺激により部分的に阻害されることが分かりました(図2A)。さらに、Ⅰ型インターフェロン受容体の阻害抗体存在下では、cGAMPによるT細胞の増殖が部分的に回復することから、T細胞から産生されたⅠ型インターフェロンもT細胞の増殖阻害に関与していることも明らかになりました(図2B)。
また、cGAMPによるⅠ型インターフェロンの産生にTCRシグナルが必要なメカニズムを調べました。その結果、Ⅰ型インターフェロンの産生に必須の転写因子[14]IRF3が、TCR刺激により持続的に活性化されることが明らかになりました。さらに、mTORC1の阻害剤ラパマイシンの存在下では、TCRとcGAMP刺激によるⅠ型インターフェロンが全く産生されなくなることから、cGAMP刺激によるⅠ型インターフェロンの産生にTCR刺激によるmTORC1の活性化が必要であることが明らかになりました(図2C)。
腫瘍を移植したマウスにcGAMPを投与すると、Ⅰ型インターフェロンの産生を介して腫瘍の成長が強く抑制されることが報告されています。そこで、cGAMPの抗腫瘍効果におけるT細胞のSTINGの役割を調べるために、T細胞のないRAG1[15]欠損マウスに正常T細胞またはSTINGを欠損したT細胞を移入したマウスを作り、cGAMPによる抗腫瘍効果を検討しました。その結果、STINGを欠損したT細胞を移入したマウスでは腫瘍の増殖が早く、生存率が低いことが観察されました(図3)。このことから、T細胞のSTINGがcGAMPの抗腫瘍効果に重要であることが分かりました。
cGAMPは、感染や腫瘍の局所での死細胞などから放出されることから、局所における病原体や腫瘍に特異的なT細胞のSTINGを活性化して、Ⅰ型インターフェロンを産生させ、抗ウイルス・抗腫瘍免疫に貢献していると考えられます。
今後の期待
今回の研究成果により、T細胞自身もSTINGの活性化によってⅠ型インターフェロンを産生し、抗ウイルス応答を強力に誘導できることが明らかになりました。近年、PD-1などの抑制性の共刺激受容体を標的とした免疫チェックポイント阻害薬[16]によるがん免疫療法が注目されていますが、これらのがん免疫療法の治療効果にSTINGの経路が重要であることが報告されています。
また、エイズの原因ウイルスであるヒト免疫不全ウイルス(HIV)などのT細胞に感染するウイルスが、T細胞のSTINGを活性化している可能性が考えられます。そのため、本成果は今後、T細胞のSTINGを標的とした新たながん免疫療法や感染症の治療法の開発に発展すると期待できます。
原論文情報
Takayuki Imanishi, Midori Unno, Wakana Kobayashi, Natsumi Yoneda, Satoshi Matsuda, Kazutaka Ikeda, Takayuki Hoshii, Atsushi Hirao, Kensuke Miyake, Glen N. Barber, Makoto Arita, Ken J. Ishii, Shizuo Akira, and Takashi Saito, “Reciprocal regulation of STING and TCR signaling by mTORC1 for T cell activation and functions”, Life Science Alliance, 10.26508/lsa.201800282
発表者
理化学研究所
生命医科学研究センター 免疫シグナル研究チーム
チームリーダー 齊藤 隆(さいとう たかし)
研究員 今西 貴之(いまにし たかゆき)
報道担当
理化学研究所 広報室 報道担当
補足説明
-
- T細胞
- 免疫細胞の一種。細胞表面に発現するT細胞抗原受容体を介して、樹状細胞などの抗原提示細胞が提示する抗原情報を認識し、活性化する。活性化したT細胞は直接他の細胞と相互作用し、また、サイトカインと呼ばれる液性因子を分泌することで、B細胞や他の免疫細胞の細胞分化や機能を調節する。分泌するサイトカインの種類や局在場所の違いによって機能が異なる。
-
- Ⅰ型インターフェロン
- ウイルス感染で誘導される抗ウイルス系のインターフェロンファミリーで、インターフェロンαとインターフェロンβで構成される。ウイルス感染細胞に作用し、ウイルス由来のmRNAやウイルスのタンパク合成を阻害することにより、ウイルスの複製を抑制する。
-
- 樹状細胞
- 皮膚組織や粘膜に存在し、表面に多くの突起を持つ自然免疫を担う免疫細胞。異物を取り込んで活性化するとリンパ節や脾臓などの二次リンパ器官に移動して抗原特異的なT細胞に抗原を提示し、T細胞を活性化する。
-
- マクロファージ
- 体内に侵入した異物を取り込み消化すること(貪食作用)を主な役割とする自然免疫を担う免疫細胞。
-
- 自然免疫、獲得免疫
- 自然免疫は、体に侵入してきた病原体を迅速に感知し、感染初期の生体防御を誘導する機構で、樹状細胞やマクロファージなどが担当する。自然免疫の活性化はその後の獲得免疫の発動にも重要である。獲得免疫は、病原体に感染することにより後天的に形成される免疫で、高度な特異性と病原体の記憶を特徴とし、同じ病原体に感染した際に病原体を効率よく排除する。主にリンパ球のT細胞とB細胞が担当する。
-
- パターン認識受容体
- 病原体に特有の分子パターンを認識する受容体で、Toll様受容体(TLR)、RIG-I様受容体(RLR)、NOD様受容体(NLR)、C型レクチン受容体(CLR)などがある。
-
- 環状ジヌクレオチド
- 細菌に特有の細胞内シグナル伝達物質である環状ジアデノシンリン酸(c-di-AMP)や環状ジグアノシンリン酸(c-di-GMP)などの総称で、STINGを活性化することが知られている。
-
- cGAMP
- 環状GMP-AMPの略称で、ウイルス由来のDNAがcGAMP合成酵素(cGAS)に認識されることにより、合成される。cGAMPは、STINGに結合することにより抗ウイルス応答を誘導する。
-
- 自己免疫疾患
- 免疫系に異常をきたし、自分自身の正常な細胞や組織を異物として認識して、攻撃することにより起こる疾患の総称。代表的なものに関節リウマチがある。
-
- ヘルパーT細胞
- 免疫応答に関与するリンパ球、T細胞の一つ。抗原の情報をB細胞へ伝えて抗体の産生を誘導したり、免疫応答を誘導する液性因子を放出したりすることにより、免疫反応の司令塔として働く。
-
- ナイーブT細胞
- ナイーブT細胞とは、抗原にさらされたことのないT細胞のことで、抗原提示細胞からの抗原刺激を受けることにより、活性化され機能分化したTh1細胞やTh2細胞などのエフェクターヘルパーT細胞に分化する。Th1細胞は、細胞内に寄生する細菌やウイルスなどの病原体の排除を促すエフェクターヘルパーT細胞の一種。Th2細胞は元来、細胞外に寄生する寄生虫などの排除を誘導するエフェクターヘルパーT細胞であるが、花粉やハウスダストなどの異物に対してもアレルギー反応を誘導することが知られている。
-
- T細胞抗原受容体(TCR)
- T細胞の細胞表面に発現する受容体で、抗原提示細胞の細胞表面に提示される主要組織適合抗原複合体(MHC)タンパク質と抗原の複合体を認識して、T細胞を活性化する。
-
- mTOR複合体1(mTORC1)
- mTORは、エネルギーや栄養、増殖因子などの環境シグナルに反応して活性化が調節されるタンパク質リン酸化酵素で、複数のタンパク質による複合体mTORC1およびmTORC2を形成する。mTORC1は、リボソームの生成とタンパク合成経路を活性化するとともに、タンパク質分解を抑えることにより細胞の増殖を促進する。
-
- 転写因子
- DNAに配列特異的に結合し、遺伝子の発現を制御するするタンパク質。
-
- RAG1
- TCRや抗体の遺伝子の再構成に必要なタンパク質で、このタンパク質を欠損するとT細胞とB細胞を欠損した免疫不全症になる。
-
- 免疫チェックポイント阻害薬
- T細胞の活性化を抑制する共刺激分子(PD-1、CTLA-4)およびそのリガンドに結合し、その作用を阻害する抗体の総称で、T細胞の免疫抑制を解除することにより、抗腫瘍免疫応答を増強する。
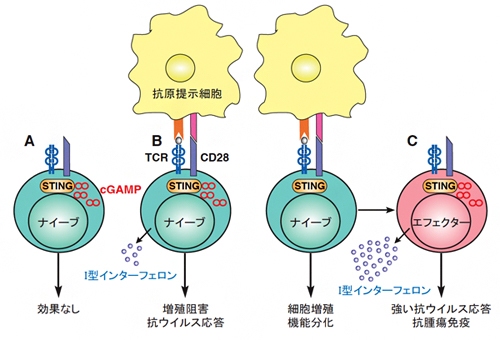
図1 T細胞のSTINGによる抗ウイルス応答の誘導
T細胞のSTINGは、cGAMPのみの刺激ではⅠ型インターフェロンを誘導できない(A)。しかし、抗原提示細胞からの抗原(TCR)刺激があると、Ⅰ型インターフェロンを介した抗ウイルス応答を誘導するとともに、T細胞の増殖を阻害する(B)。ナイーブT細胞がエフェクターT細胞(Th1、活性化CD8T細胞)に分化すると、より強力な抗ウイルス応答を誘導できるようになる(C)。
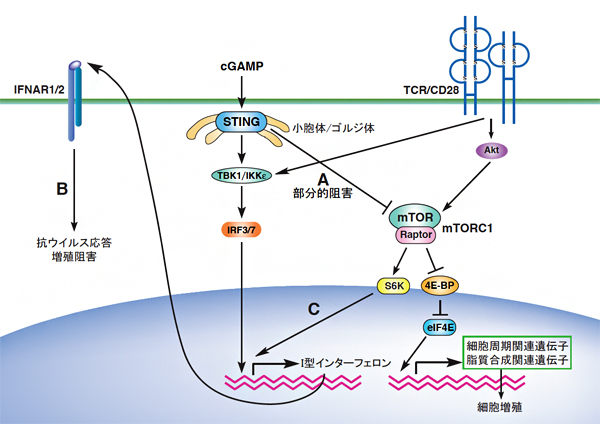
図2 STINGによるT細胞の抗ウイルス応答と細胞増殖抑制の分子メカニズム
T細胞のSTINGは、cGAMP単独刺激ではリン酸化酵素TBK1と転写因子IRF3の一過性の活性化しか誘導できず、Ⅰ型インターフェロンを誘導できない。一方、TCR刺激があると、TBK1とIRF3の持続的な活性化およびmTORC1の活性化が誘導され、Ⅰ型インターフェロンを介した抗ウイルス応答を誘導する。Ⅰ型インターフェロンは、T細胞の増殖阻害も誘導する。また、STINGの活性化は、TCR刺激によるmTORC1の活性化を部分的に阻害することにより、T細胞の増殖を阻害する。
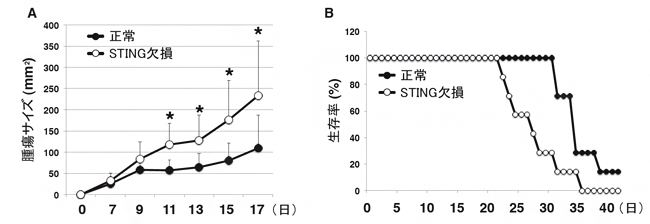
図3 T細胞のSTINGによる抗腫瘍効果
T細胞のないRAG1欠損マウスに、正常T細胞またはSTINGを欠損したT細胞を移入後、メラノーマ(悪性黒色腫)細胞を移植し、cGAMPを投与後の腫瘍の成長(A)および生存率(B)を調べた。その結果、STINGを欠損したT細胞を移入したマウスでは、腫瘍の増殖が早く、生存率が低いことが分かった。