発症に繋がる新たなメカニズムを提案
2019-03-01 京都大学
星美奈子 医学研究科非常勤講師(神戸医療産業都市推進機構先端医療研究センター部長)らの研究グループは、アルツハイマー病の神経毒性物質の形成と伝搬機構を解明しました。
これまで、アルツハイマー病の原因となるアミロイドβ(Aβ)がどこで産生されているか、どこで毒性を持つ凝集体に変わるのかは不明でした。
そこで本研究グループが、成熟神経細胞を用いた実験系を構築し調べた結果、アルツハイマー病の神経細胞死の原因として本研究グループがこれまでの研究で患者の脳から発見した毒性凝集体アミロスフェロイドが、特定の神経細胞で検出され、この毒性凝集体の蓄積に伴って神経細胞内での細胞内輸送が異常になることを示しました。
さらに、本研究では、細胞のタンパク質の構造異常を見張り、異常タンパク質を壊す役割を持つプロテアソームの活性低下が、毒性凝集体の蓄積を起こすことを示し、これまで不明であったアルツハイマー病発症の初期過程に踏み込むことに成功しました。
本研究成果により、将来、新しいメカニズムによる治療薬の開発が可能になると期待されます。
本研究成果は、2019年3月1日に、国際学術誌「iScience」のオンライン版に掲載されました。
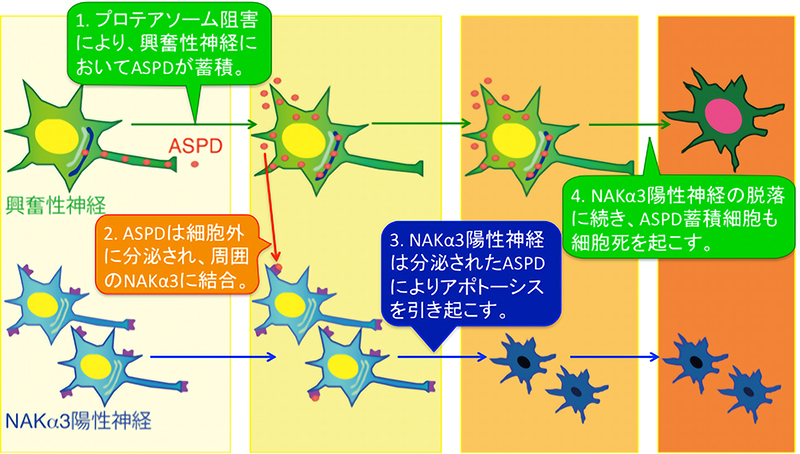
図:本研究の概要
詳しい研究内容について
―発症に繋がる新たなメカニズムを提案―概要
アルツハイマー病の原因となるアミロイド β(Aβ)は、前駆体である APP(アミロイドβ前駆体タンパク 質)が、神経細胞内を輸送される過程で切断されて産⽣されます。これまで Aβ が産⽣されるメカニズムにつ いては殆ど神経細胞以外の細胞を⽤いて解析されてきました。しかし、機能分担に応じて複雑な形態を持ち、 異なる細胞内輸送システムを持つ神経細胞において、Aβ がどこで産⽣されているか、どこで毒性を持つ凝集 体に変わるのかは、未だ不明でした。これを解決するために、京都⼤学⼤学院医学研究科 星美奈⼦ 特定准教 授(研究当時、現:神⼾医療産業都市推進機構先端医療研究センター神経変性疾患研究部⻑、京都⼤学⼤学院 医学研究科⾮常勤講師)らは、成熟神経細胞を⽤いた実験系の構築に着⼿しました。その結果、アルツハイマ ー病の神経細胞死の原因として本研究グループが患者脳から⾒つけた毒性凝集体アミロスフェロイドが、特定 の神経細胞で検出され、この毒性凝集体の蓄積に伴って神経細胞内での細胞内輸送が異常になることを⽰ しました。さらに、本研究では、細胞のタンパク質の構造異常を⾒張り、異常タンパク質を壊す役割を持つプ ロテアソームの活性低下が、毒性凝集体の蓄積を起こすことを⽰し、これまで不明であったアルツハイマー 病発症の初期過程に踏み込むことに成功しています。これにより、将来、新しいメカニズムによる治療薬 の開発が可能になると期待されます。本研究成果は、2019 年 3 ⽉ 1 ⽇に国際学術誌「iScience」にオンライン掲載されました。
 1.背景
1.背景アルツハイマー病は認知症のひとつであり、記憶や思考能⼒が徐々に障害され、最終的に⽇常⽣活にも⽀障 をきたす疾患です。その患者数は世界中で約 5000 万⼈おり、2050 年には約 3 倍に増加すると予想されてい ます(World Alzheimer Report 2018. Alzheimerʼs Disease International)。しかし、未だアルツハイマー病の 原因は明らかになっておらず、明確な治療法もありません。
アルツハイマー病では脳の神経細胞が減少し、脳内に異常な凝集体によるシミ「⽼⼈斑」や、線維状の沈着物 「神経原線維変化」と呼ばれる異常が⾒つかり、最終的には神経細胞同⼠のネットワークが消失してしまいます。 この⽼⼈斑は、アミロイド β(Aβ)と呼ばれるタンパク質の凝集、蓄積により形成されるものであり、Aβ が脳内に蓄積することが、現在アルツハイマー病の原因の⼀つとされています。Aβ は、膜タンパク質である 前駆体 APP(アミロイドβ前駆体タンパク質)が細胞内輸送で運ばれる過程で切断されて形成されてきます が、Aβ がどこで産⽣されているのかについてのこれまでの報告は、神経細胞以外の細胞を⽤いて解析されて きました。神経細胞は情報を外から受け取る樹状突起、情報を処理する細胞体、情報を発信する軸索と、全く 異なる機能を担う部位から形成されており、機能的に異なる部位を作るために、普通の細胞よりも極めて複雑 な細胞内輸送システムを持っています。従って、神経細胞内のどこで Aβ が産⽣されているのかについて調べ ることは、アルツハイマー病を理解する上で、重要な課題となっています。
近年アルツハイマー病の原因として、⽐較的少数のタンパク質が凝集した「オリゴマー」と呼ばれる構造体が 毒性発揮の中⼼的な役割を担うと考えられています。星らの研究グループは、以前 Aβ が 30 個集まった球状 構造体「アミロスフェロイド(amylospheroids; 以下 ASPD と略)」が強い神経毒性を持つことを報告しまし た(Hoshi et al. 2003, PNAS, 100, 6370-6375)。これまでの研究により、ASPD がアルツハイマー病の病態 と相関して脳内の蓄積量が増えることや、神経細胞の⽣存や機能に重要なタンパク質ナトリウム-カリウム ポンプの α3 サブユニット(以下 NAKα3)に結合することで、直接神経細胞を殺す活性があることを⾒ 出してきました(Ohnishi et al. 2015, PNAS, 112, E4465-4474)。また、アルツハイマー病患者脳では、⼀ 部の領域でのみ神経細胞死が起きますが、この神経細胞死が起きる領域と ASPD の蓄積が起きる領域が⼀致 しており、ASPD がアルツハイマー病の病態に重要な働きを持つことがうかがえます。しかし、ASPD が脳内 でどのようにして形成されているかについては不明です。そこで、本研究では、成熟神経細胞を⽤いて、Aβ 及び ASPD が細胞内のどこに蓄積し、どのように伝搬するかを調べました。Aβ オリゴマーの研究が進まない 理由に、Aβ オリゴマーを特異的に検出することができないという点があげられますが、星らは ASPD ⽴体構 造選択的な抗体の作成に成功しており(Noguchi et al. 2009, JBC, 284, 32895-32905)、この抗体を⽤いる ことで、ASPD に関する研究を進めることができました。2.研究⼿法・成果
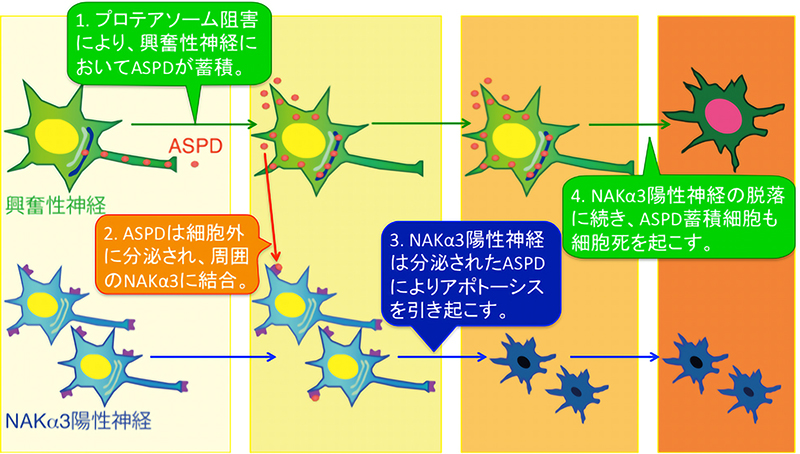
本研究では、ASPD や Aβ が神経細胞内のどこで形成し、どのようにして伝搬するかを調べるため、ASPD を産⽣する成熟神経細胞をモデルとして構築しました。家族性アルツハイマー病で報告されている変異を持つ APP を神経細胞で発現させ、異常タンパク質の分解を⾏う酵素複合体である「プロテアソーム」の働きを阻害 することで、神経細胞内に ASPD が蓄積することを⾒出しました。しかし、この ASPD の蓄積は神経細胞の うち、⼀部の細胞でしか⾒られませんでした。そこで、ASPD を蓄積する細胞がどのような細胞かを調べたと ころ、これらの細胞は神経細胞の活動を活性化する「興奮性神経細胞」であることがわかりました。また、ASPD が細胞内のどこに多く存在するかを調べたところ、通常状態では主に軸索に多く存在していましたが、プロテ アソームの阻害により、主に樹状突起に存在するようになり(図 1 上パネル)、ASPD の蓄積に伴って細胞内 の輸送に異常が出ることが⽰唆されました。実際、ASPD の蓄積は、細胞内で新しく⽣成されたタンパク質の 仕分けに重要な働きを持つ「トランスゴルジネットワーク」に多く⾒られ(図 1 真ん中、下パネル)、細胞内輸 送の異常と ASPD の蓄積が密接に関係していることが⽰唆されました。
次に、興奮性神経細胞内で形成した ASPD が、細胞外に分泌されているかを調べたところ、実際に細胞外に 分泌されていることがわかりました。興奮性神経細胞から細胞外に分泌された ASPD は、周囲の神経細胞の NAKα3 に結合することで NAKα3 を持つ神経細胞の細胞死を引き起こすことが⽰されました。周囲の NAKα3 神経細胞の細胞死を引き起こした ASPD 蓄積細胞は、その後、NAKα3 神経細胞とは異なるメ カニズムで細胞死を起こすことがわかりました。
本研究により、神経細胞における毒性 Aβ オリゴマーの形成と輸送に関して、より理解を深めること ができました。またプロテアソームの活性と ASPD の蓄積に相関があることが⽰唆され、プロテアソー ムの活性がアルツハイマー病の病態に重要な働きを持つ可能性が⽰されました。この結果は、将来的に APP/Aβ の分解を調節することによる、Aβ 凝集体に対するアルツハイマー病治療薬の開発につながる ことが期待できます。
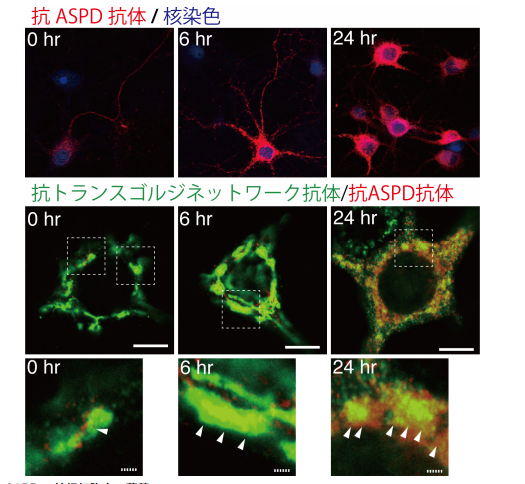
図 1. ASPD の神経細胞内の蓄積
各図左上の時間はプロテアソーム阻害剤の投与時間を⽰している。
上のパネルは ASPD(⾚)の染⾊像を⽰しており、プロテアソーム阻害剤を添加していない時(0 hr)では ASPD が軸索に存在しているのに対し、プロテアソーム阻害剤添加時(6, 24 hr)では ASPD が樹状突起に 存在していることが分かる。
真ん中、下のパネルは ASPD(⾚)のトランスゴルジネットワーク(緑)への存在を⽰しており、ASPD が トランスゴルジネットワークに存在していることが分かる(下のパネルの⽮印で⽰される場所)。
3.波及効果、今後の予定
これまでの研究で ASPD がアルツハイマー病患者脳で蓄積していることが解っていましたが、本研究によ り、神経細胞内で実際に形成されること、さらに神経細胞から分泌され、周囲の細胞の神経細胞死を引き起こ すことがわかり、アルツハイマー病患者脳で起こる神経細胞死のメカニズムについて、より明解に説明するこ とが可能となりました。また、ASPD の蓄積が⼀部の神経細胞でのみ起こることがわかりました。この神経細 胞種による違いは、アルツハイマー病患者脳において、神経の脱落が特定の領域でのみ観察されるという現象 の説明につながる可能性が考えられます。神経細胞種の違いによる ASPD の形成について研究するには、細胞 内における ASPD の形成メカニズムについて理解することが重要な課題です。そこで今後は、ASPD の形成に ついてリアルタイムでモニタリングする実験系を構築し、研究を進めていく予定です。
4.研究プロジェクトについて
本研究は、主に MEXT 科研費(基盤研究(B))、新潟⼤学脳研究所、武⽥科学振興財団(ライフサイエンス 研究助成)の⽀援を受けて⾏われました。
<研究者のコメント>
本研究は、アルツハイマー病患者脳で蓄積が⾒られる ASPD について、神経細胞内での形成、更には神経細 胞からの分泌を初めて確認したもので、実際の脳内で起きている ASPD の形成、伝搬、神経脱落の過程を解明 する上で⼤きな成果です。今後、ASPD の形成機構について更に研究を進めていくことは、ASPD を含む Aβ オリゴマーを対象としたアルツハイマー病治療につながると期待しています。
<論⽂タイトルと著者>
タイトル:Alzheimerʼs Aβ Assemblies Accumulate in Excitatory Neurons Upon Proteasome Inhibition and Kill Nearby NAKα3-Neurons by Secretion アミロイド β タンパク質集合体はプロテアソーム阻害により興奮性神経に蓄積し、分泌されるこ とで周囲の NAKα3 陽性神経を殺す。
著 者:Hitomi Komura, Shota Kakio, Tomoya Sasahara, Yoshie Arai, Naomi Takino, Michio Sato, Kaori Satomura, Takayuki Ohnishi, Yo-ichi Nabeshima, Shin-ichi Muramatsu, Isao Kii, Minako Hoshi
掲 載 誌:iScience DOI:未定
<イメージ図>
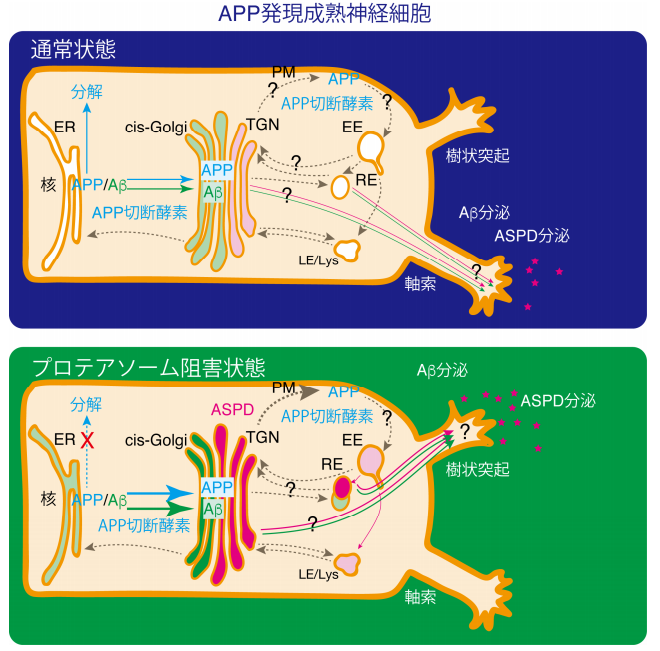
図 2. 本研究より明らかになった APP、Aβ、ASPD の局在
通常状態(上パネル)では、APP は⼩胞体(ER)で合成され、⼀部はすぐに分解される。分解を受けなかっ た APP はシスゴルジ(cis-Golgi)、トランスゴルジネットワーク(TGN)と輸送され、細胞膜に運ばれる。APP は APP 切断酵素により切断され、Aβを産⽣し、更に ASPD を形成する。ASPD は主にトランスゴルジネット ワークに⾒られ、軸索へと輸送される。
プロテアソーム阻害状態(下パネル)では、合成された APP が分解を受けなくなり、APP の量が増加する。 APP 量の増加に伴い、Aβや ASPD の量も増加する。ASPD は主にトランスゴルジネットワークに蓄積し、⼩ 胞体やシスゴルジ、リサイクリングエンドソームにも蓄積する。プロテアソームの阻害により、ASPD の分布 は軸索から樹状突起へと変化する。
ER;⼩胞体、cis-Golgi;シスゴルジ、TGN;トランスゴルジネットワーク、PM;細胞膜、EE;初期エンドソーム、 RE;リサイクリングエンドソーム、LE;後期エンドソーム、Lys;リソソーム