2017-12-22 生理学研究所
研究成果は、米国科学誌「Cell Stem Cell(セル・ステムセル)」電子版に
2017年12月21日正午(米国東部時間)掲載
(日本時間12月22日午前2時)
内容
周産期医療の進歩により新生児の生存率は劇的に改善しましたが、重篤な神経学的後遺症を高率に合併する、低酸素性虚血性脳症などの新生児脳障害は依然として毎年数千人程度発生しています。傷害で失われた神経細胞(ニューロン)を再生させる治療法は未だ無いのが現状であり、新たな治療法の開発が望まれています。
この度、名古屋市立大学大学院医学研究科の 澤本和延教授(再生医学)(自然科学研究機構生理学研究所 客員教授)と、神農英雄研究員(新生児・小児医学)らは、東京医科歯科大学やスペイン・バレンシア大学などとの共同研究により、マウスを用いた実験で、新生児期のみに存在する脳障害後の神経再生メカニズムを世界で初めて発見しました。
「放射状グリア」という、脳の発生期に幹細胞としてはたらき、ニューロンの移動の足場となる細胞は、生後すぐに消失します。研究グループは、新生児期では脳障害後にこの放射状グリアが維持され、脳内に存在する幹細胞から産生されたニューロンが、放射状グリアの長い突起を足場として傷害部へ効率よく移動することを発見しました。さらに、放射状グリアを人工的に模倣した足場を新生児期の傷害脳へ埋め込むことによって、傷害部へのニューロンの移動を促進するとともに、歩行機能を回復させることに成功しました。
新生児期にのみ備わるこの神経再生メカニズムをヒトへ応用することによって、新生児脳障害の再生医療につながることが期待できます。
ポイント
- ・新生児脳障害の新たな治療法の開発が望まれています。
- ・本研究ではマウスを用いた実験で、生後すぐに消失する放射状グリアが、新生児期の脳障害後では維持されることを発見しました。
- ・また、脳内に存在する幹細胞から産生された神経細胞(ニューロン)が、N-カドヘリンという分子を介して放射状グリアと接着することにより、放射状グリアの長い突起を足場として傷害部へ効率よく移動することを明らかにしました。
- ・さらに、放射状グリアを人工的に模倣した足場(N-カドヘリンスポンジ)を傷害脳へ移植することによって、傷害部へのニューロンの移動が促進され、歩行機能の回復に成功しました。
- ・このメカニズムをヒトへ応用することによって、新生児脳障害の再生医療につながることが期待できます。
研究成果の概要
名古屋市立大学大学院医学研究科の澤本和延教授(再生医学)、神農英雄研究員(新生児・小児医学)らは、東京医科歯科大学やスペイン・バレンシア大学などとの共同研究により、マウスを用いた実験で、新生児期のみに存在する脳障害後の神経再生メカニズムを世界で初めて発見しました。
周産期医療の進歩により新生児の生存率は劇的に改善しましたが、脳性麻痺や発達遅滞など重篤な神経学的後遺症を高率に合併する、低酸素性虚血性脳症などの新生児脳障害は依然として年間数千人程度発生しています。傷害で失われた神経細胞(ニューロン)を再生させる治療法は未だ無いのが現状であり、新たな治療法の開発が望まれています。
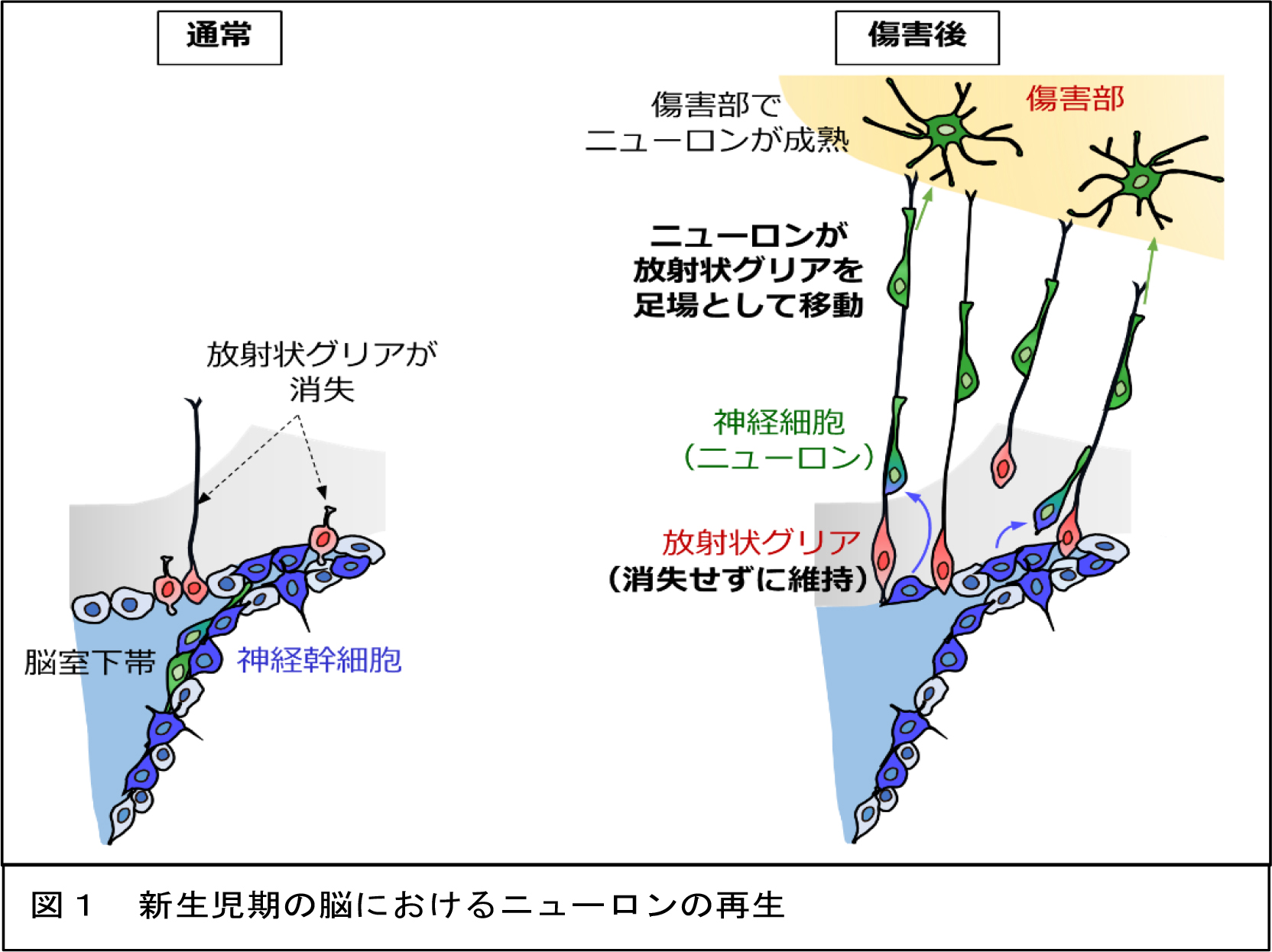 脳の発生期にニューロンを産生し、その移動の足場となる放射状グリアは通常、生後すぐに消失します。研究グループはマウスを用いた実験により、新生児期のみにおいて、脳障害後にこの放射状グリアが消失せず、一時的に維持されることを発見しました(図1)。また、生後の脳でも脳室下帯という部分には神経幹細胞が存在し、ニューロンをたえず産生されていることが知られています。今回の研究では、新生児期の傷害脳では、多くの新生ニューロンが、維持された放射状グリアを足場として傷害部へ移動し、傷害部で成熟することを見出しました(図1)。移動するニューロンと放射状グリアでは、ともにN-カドヘリンという接着分子が発現しており、お互いに結合することによって接着構造を形成していることを明らかにしました(図2)。さらに、アデノウィルスを用いた手法で放射状グリアのN-カドヘリンを不活性化させたところ、この接着構造が減少かつ不規則になり、放射状グリアに沿って移動するニューロンの割合が減少し、移動速度も減少することがわかりました。
脳の発生期にニューロンを産生し、その移動の足場となる放射状グリアは通常、生後すぐに消失します。研究グループはマウスを用いた実験により、新生児期のみにおいて、脳障害後にこの放射状グリアが消失せず、一時的に維持されることを発見しました(図1)。また、生後の脳でも脳室下帯という部分には神経幹細胞が存在し、ニューロンをたえず産生されていることが知られています。今回の研究では、新生児期の傷害脳では、多くの新生ニューロンが、維持された放射状グリアを足場として傷害部へ移動し、傷害部で成熟することを見出しました(図1)。移動するニューロンと放射状グリアでは、ともにN-カドヘリンという接着分子が発現しており、お互いに結合することによって接着構造を形成していることを明らかにしました(図2)。さらに、アデノウィルスを用いた手法で放射状グリアのN-カドヘリンを不活性化させたところ、この接着構造が減少かつ不規則になり、放射状グリアに沿って移動するニューロンの割合が減少し、移動速度も減少することがわかりました。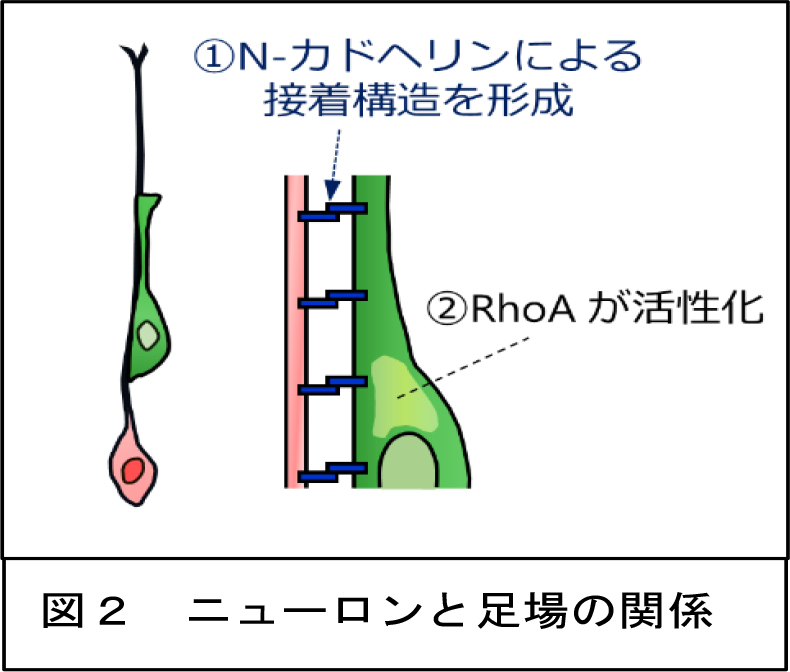 また、脳室下帯由来のニューロンを用いた培養実験の結果、ニューロンがN-カドヘリンを発現している足場の上を移動するときは、RhoA(ローエ―)という細胞の移動を促進させるタンパク質が活性化されることを突きとめました(図2)。このことから、移動するニューロンは、足場となる放射状グリアとともにN-カドヘリンによる接着構造を形成すること、それにより細胞内のRhoAが活性化されることによって、傷害部への効率の良い移動が促進されることが明らかになりました。
また、脳室下帯由来のニューロンを用いた培養実験の結果、ニューロンがN-カドヘリンを発現している足場の上を移動するときは、RhoA(ローエ―)という細胞の移動を促進させるタンパク質が活性化されることを突きとめました(図2)。このことから、移動するニューロンは、足場となる放射状グリアとともにN-カドヘリンによる接着構造を形成すること、それにより細胞内のRhoAが活性化されることによって、傷害部への効率の良い移動が促進されることが明らかになりました。
次に、ニューロン移動の足場を脳内に供給することによって脳障害後のニューロン再生を促進できるか証明するため、放射状グリアを模倣した人工足場(N-カドヘリンスポンジ)を作製しました。N-カドヘリンスポンジを傷害脳へ移植したところ、新生児期のみならず、成体期のマウスにおいても傷害部へ移動するニューロンの数が有意に増加しました。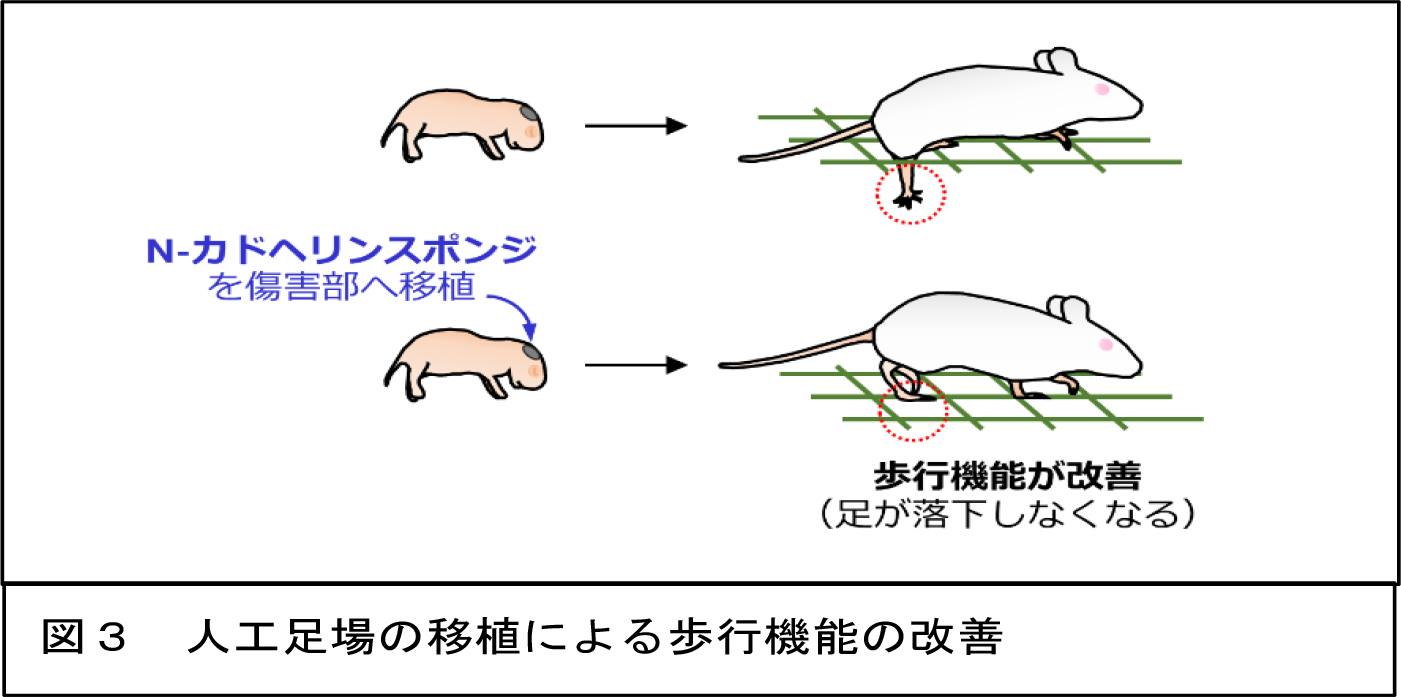 複数の運動機能テストを用いて評価した結果、N-カドヘリンスポンジを移植したマウスにおいて脳障害後の歩行機能が有意に回復しました(図3)。
複数の運動機能テストを用いて評価した結果、N-カドヘリンスポンジを移植したマウスにおいて脳障害後の歩行機能が有意に回復しました(図3)。
今回の研究成果は、通常生後すぐに消失してしまう放射状グリアが、新生児期の脳障害においてニューロン移動とそれに続くニューロン再生・神経学的機能回復に重要な役割を持つことを明らかにしたものです。こうした新生児期にのみ存在する神経再生メカニズムをヒトへ応用することができれば、新生児脳障害の再生医療につながることが期待されます。
研究助成
本研究は、文部科学省・日本学術振興会科学研究費補助金などによる助成を受けて行われました。
掲載された論文の詳細
【論文タイトル】
Radial glial fibers promote neuronal migration and functional recovery after neonatal brain injury
「放射状グリアは新生児脳障害後のニューロン移動と神経学的機能回復を促進する」
【著者】
神農英雄1,2, 澤田雅人1,川瀬恒哉1,2, 金子奈穂子1, Vicente Herranz-Pérez3,4, 宮本拓哉1, 川上 巧5, 宮田卓樹5, 田畑泰彦6, 赤池敏宏7, José Manuel García-Verdugo3,
味岡逸樹8, 齋藤伸治2, 澤本和延1,9* (*Corresponding author)
名古屋市立大学医学研究科再生医学1, 名古屋市立大学医学研究科新生児・小児医学2, Laboratorio de Neurobiología Comparada, Instituto Cavanilles, Universidad de Valencia(バレンシア大学)3, Predepartmental Unit of Medicine, Faculty of Health Sciences, Universitat Jaume I(ジャウメ1世大学)4, 名古屋大学医学系研究科細胞生物学5, 京都大学再生医学研究所生体材料学6, 国際科学振興財団再生医工学バイオマテリアル研究所7, 東京医科歯科大学脳統合機能研究センター8, 自然科学研究機構生理学研究所神経発達・再生機構研究部門9
【掲載学術誌】
「Cell Stem Cell(セル・ステムセル)」
お問い合わせ先
《研究全般に関するお問い合わせ先》
澤本 和延(さわもと かずのぶ)
名古屋市立大学大学院医学研究科 教授
自然科学研究機構 生理学研究所 客員教授
リリース元


名古屋市立大学
自然科学研究機構 生理学研究所
関連部門
関連研究者
澤本 和延
SAWAMOTO, Kazunobu