リン酸化によるDNAシトシン脱アミノ化酵素の活性制御機構
2019-06-07 京都大学
高折晃史 医学研究科教授、白川康太郎 医学部附属病院助教、松本忠彦 医学研究科研究員らの研究グループは、がんに遺伝子変異を導入する酵素APOBEC3Bの分子スイッチを発見しました。
がんは経過とともに蓄積する遺伝子変異によりクローン進化を引き起こし、これによって抗がん剤への治療反応性が失われ、薬剤耐性化を誘導してしまいます。先日、本研究グループは骨髄腫のクローン進化に内在性のDNAシトシン脱アミノ化酵素であるAPOBEC3Bが関与していることを明らかにしました。APOBEC3Bは変異源となり得るため、厳密に酵素活性が調整されているはずですが、現在までこの酵素活性を生理的に抑制する機構は知られていませんでした。
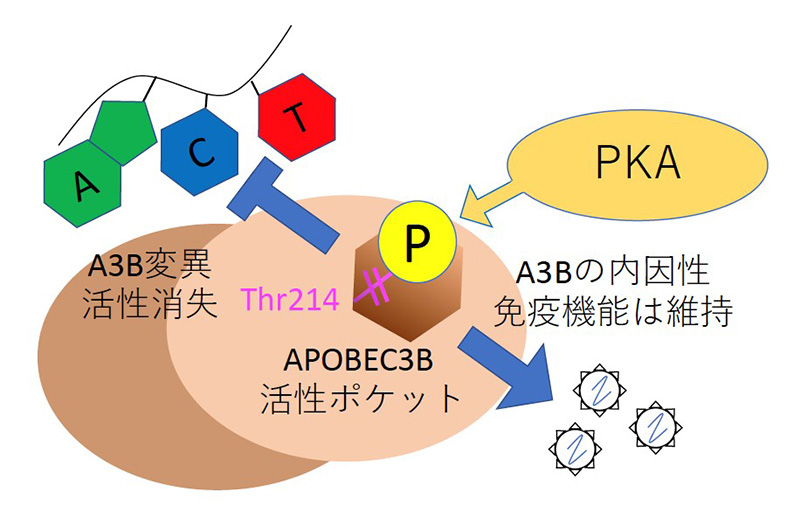
本研究グループはプロテインキナーゼA(PKA)がAPOBEC3Bの214番目のスレオニンをリン酸化することで、その酵素活性がほとんど消失することを発見しました。 一方でこのリン酸化は、APOBEC3Bの有する抗レトロエレメント活性などの内因性免疫機能を依然保持していることをも明らかにしました。APOBEC3Bのリン酸化は「遺伝子変異を制御し、従来の抗がん剤治療への感受性を維持する」という新たなコンセプトのがん治療の一つの戦略となりうることを示唆しています。
本研究成果は、2019年6月5日に、国際学術誌「Scientific Reports」のオンライン版に掲載されました。
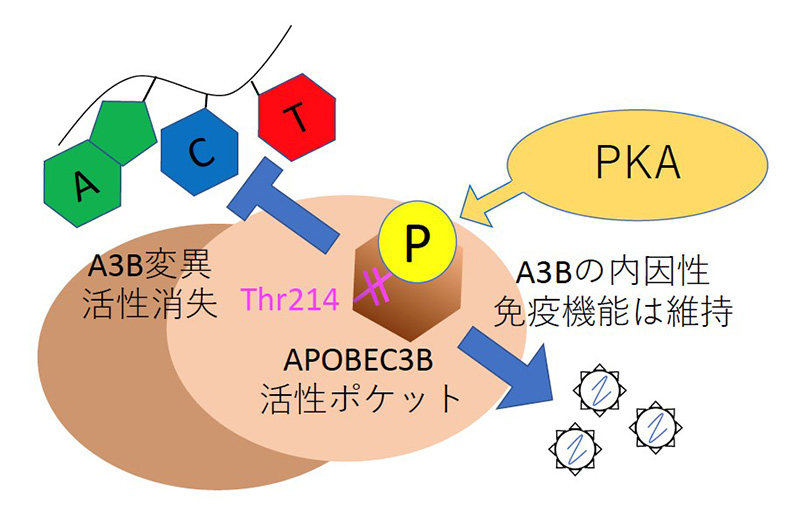
図:研究の概要図
詳しい研究内容について
がんに遺伝子変異を導入する酵素の分子スイッチを発見
―リン酸化による DNA シトシン脱アミノ化酵素の活性制御機構―
概要
高折晃史 医学研究科教授、白川康太郎 医学部附属病院血液内科助教、松本忠彦 医学研究科研究員らの研 究グループは、がんに遺伝子変異を導入する酵素 APOBEC3B の分子スイッチを発見しました。 がんは経過とともに蓄積する遺伝子変異によりクローン進化を引き起こし、これによって抗がん剤への治療 反応性が失われ、薬剤耐性化を誘導してしまいます。先日、本研究グループは骨髄腫のクローン進化に内在性 の DNA シトシン脱アミノ化酵素である APOBEC3B が関与していることを明らかにしました。APOBEC3B は 変異源となり得るため、厳密に酵素活性が調整されているはずですが、現在までこの酵素活性を生理的に抑制 する機構は知られていませんでした。本研究グループはプロテインキナーゼ A が APOBEC3B の 214 番目のス レオニンをリン酸化することで、その酵素活性がほとんど消失することを発見しました。 一方でこのリン酸 化は、APOBEC3B の有する抗レトロエレメント活性などの内因性免疫機能を依然保持していることをも明ら かにしました。APOBEC3B のリン酸化は『遺伝子変異を制御し、従来の抗がん剤治療への感受性を維持する』 という新たなコンセプトのがん治療の一つの戦略となりうると考えています。
本研究成果は、2019 年 6 月 5 日に国際学術誌「Scientific Reports」のオンライン版に掲載されました。
1.背景
がんは日本国民の半数が罹患すると言われる大変頻度の高い疾患です。多くのがん種で新規治療法が日々開 発されているにも関わらず、現在でも多くのがんは根治することが困難です。この難治性の原因の一つが薬剤 耐性化であり、がんの遺伝子に変異が蓄積することで起きるクローン進化が薬剤耐性化に大きく寄与している と考えられています。
APOBEC タンパクは DNA シトシン脱アミノ化反応を触媒し、結果としてシトシンをチミンに変換し、遺伝 子変異を引き起こします。元々はウイルスの遺伝子に変異を導入することで、ウイルス感染に対する内因性免 疫として機能することが知られていましたが、近年様々な報告により APOBEC タンパクが多くのがん種でク ローン進化を引き起こすことが明らかになってきました。しかし APOBEC3B の分子学的性質は十分に解析さ れておらず、生体内で起こりうるタンパクの調節機構も明らかにされていませんでした。他の APOBEC ファ ミリーである、APOBEC3G はプロテインキナーゼ A(PKA)によりリン酸化されその分子学的機能が調整され ていることがすでに知られていました。
2.研究手法・成果
まず APOBEC3B と APOBEC3G の配列を比較することで APOBEC3B に 2 箇所、PKA によってリン酸化さ れうるアミノ酸を同定しました。次に PKA が実際に APOBEC3B をリン酸化することと、リン酸化されるア ミノ酸が 214 番目のスレオニン(Thr214)であることを発見しました。さらに Thr214 のリン酸化によって APOBEC3B の酵素活性が失われることを明らかにしました。その原因として、基質であるシトシンが Thr214 に付加されたリン酸基の負電荷により酵素活性部位に侵入できなくなることが、コンピューターシミュレーシ ョンの結果推定されました(国立感染症研究所病原体ゲノム解析研究センター 横山勝主任研究官、佐藤裕徳室 長との共同研究)。一方でリン酸化を受けても、元来 APOBEC3B が有している内因性免疫機能である抗レトロ トランスポゾン活性、抗レトロウイルス活性は依然保持していました。
3.波及効果、今後の予定
これまで APOBEC3B の翻訳後修飾はサルのウイルスタンパクによるもののみ知られていましたが、本研究 はヒトのタンパク質によるリン酸化が APOBEC3B の分子スイッチとして働くことを世界に先駆けて発見した という点で大変重要な意味を持ちます。この研究結果は、PKA 活性化による APOBEC3B のリン酸化はその内 因性免疫機能を損なうことなく、『遺伝子変異を制御し、従来の抗がん剤治療への感受性を維持する』という 新たなコンセプトのがん治療の一つの戦略となりうることを示唆しています。
4.研究プロジェクトについて
本研究は国立感染症研究所 病原体ゲノム解析センター、セルフリーサイエンス社との共同研究であり、科 研費の助成を受けて行われました。
<研究者のコメント>
APOBEC3B は APOBEC3G とアミノ酸配列が酷似しているため、PKA によるリン酸化は想定していました が、リン酸化によってほとんど活性が検出できなくなったことは大きな驚きで、重要な知見を発見することが できたと思いました。APOBEC3B の生理学的特徴やその制御機構は依然未知の点が多く、今後の研究につな げていきたいと考えています。
<論文タイトルと著者>
タイトル: Protein kinase A inhibits tumor mutator APOBEC3B through phosphorylation (プロテインキナーゼ A はがんの変異源である APOBEC3B をリン酸化することでその活性を阻害 する)
著 者: Tadahiko Matsumoto1 (松本忠彦) , Kotaro Shirakawa1 (白川康太郎) , Masaru Yokoyama2 (横山勝), Hirofumi Fukuda1 (福田寛文) , Anamaria Daniela Sarca1 (アナマリア ダニエラ サルカ), Sukenao Koyabu1 (小藪助直), Hiroyuki Yamazaki1 (山崎寛章) , Yasuhiro Kazuma1 (数馬安浩) , Hiroyuki Matsui1 (松井宏行) , Wataru Maruyama1 (丸山亙) , Kayoko Nagata1 (永田佳代子), Fumiko Tanabe3 (田邊史子), Masayuki Kobayashi1 (小林正行) , Keisuke Shindo1 (新堂啓祐) , Ryo Morishita3 (森下 了) , Hironori Sato2 (佐藤裕徳), Akifumi Takaori-Kondo 1 (高折晃史)
所 属:1京都大学大学院 医学研究科 血液・腫瘍内科学、2国立感染症研究所病原体ゲノム解析研究センタ ー、3セルフリーサイエンス
掲 載 誌:Scientific Reports DOI:未定
<用語解説>
クローン進化:共通の細胞より生じたがん細胞に遺伝子変異が生じてサブクローンが形成され、競合的選択に 曝されることで、自然淘汰され進化すること
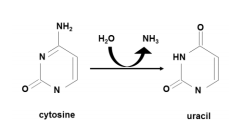 DNA シトシン脱アミノ化酵素:
DNA シトシン脱アミノ化酵素:
DNA のシトシンを脱アミノ化してシトシンに変換する酵素
プロテインキナーゼ A:環状アデノシン一リン酸 (cAMP) により活性化するリン酸化酵素であり、グリコー ゲン、糖、脂質の代謝の調節を含む様々な機能を持っている
内因性免疫:細胞にもともと備わった、病原体を直接認識しその複製を阻害する防御機構