エピゲノム修飾酵素が神経膠腫形成を導くメカニズムを解明
2019-08-20 名古屋大学,日本医療研究開発機構
名古屋大学大学院医学系研究科(研究科長・門松健治)・腫瘍生物学分野の近藤豊(こんどうゆたか)教授、新城恵子(しんじょうけいこ)助教(筆頭著者)、同脳神経外科学の夏目敦至(なつめあつし)准教授、大岡史治(おおおかふみはる)助教(筆頭著者)らは、難治性の脳腫瘍である神経膠腫※1の中で、特定の遺伝子異常がある腫瘍の患者さんにEZH2※2阻害剤が有効である可能性を見出しました。
神経膠腫は、最も多い脳腫瘍の一つで難治性の腫瘍です。低悪性度神経膠腫は、神経膠腫の中では比較的悪性度が低いものの、手術を含めた集学的治療によって完治にいたることが少なく、確実に増大し生命を脅かします。低悪性度神経膠腫のうち、IDH遺伝子の変異がない腫瘍の予後は不良で、有効な治療薬も見つかっていません。本研究では、IDH遺伝子変異※3がない低悪性度神経膠腫においてそれぞれ最も多い遺伝子異常の一つであるp53,NF1遺伝子異常をもち、本腫瘍を発症するMADMマウスモデル※4を使って、腫瘍ができていく時に出現する分子の異常を解析しました。その結果、マウスモデルの神経膠腫の前がん状態からエピゲノム※5修飾酵素EZH2を高発現し、EZH2が多くの重要な遺伝子のエピゲノム異常を引き起こし、腫瘍の形成に重要であることがわかりました。そこで、MADMマウスにEZH2阻害剤を投与したところ、腫瘍の増大を抑えることができました。ヒトのIDH遺伝子変異がない低悪性度神経膠腫でもEZH2は高発現しており、特にp53, NF1遺伝子異常をもつ低悪性度神経膠腫の細胞株ではEZH2阻害剤により細胞増殖が抑えられました。
EZH2阻害剤は、現在血液がん等で治験が行われており、近い将来臨床の現場で使用できる治療薬になる可能性があります。今後、IDH遺伝子変異がない低悪性度神経膠腫の中で、特にp53, NF1遺伝子異常をもつ腫瘍の患者さんに、EZH2阻害剤を有効なプレシジョンメディスン※6として使用できる可能性を初めて見出しました。
この研究成果は、2019年8月20日付け(日本時間午後10時30分)米国癌学会誌「Cancer Research」のオンライン版で掲載されます。
なお、本研究は、国立研究開発法人日本医療研究開発機構(AMED)次世代がん医療創生研究事業(P-CREATE)研究開発課題名「がん細胞の分化制御に関わるエピゲノムを標的とした革新的治療法の開発」の支援のもとでおこなわれたものです。
ポイント
- 現在がんの治療法として個別化精密医療(プレシジョンメディスン)の重要性が強く認識されています。すなわち、がんの治療薬がどのタイプのがんに対して最も適しているのかを見つけ出すことが重要な課題です。
- 脳腫瘍の中で最も高頻度に発生する神経膠腫は、予後不良な腫瘍とされています。神経膠腫の中で比較的悪性度の低い神経膠腫であっても確実に徐々に増大し、最終的には生命を脅かします。低悪性度神経膠腫は、グルタミン代謝に関わるIDH遺伝子に変異が“あり”か“なし”によって大きく2つのサブタイプに分けられ、IDH遺伝子に変異が“ある”場合は予後が比較的良好とされています。一方でIDH遺伝子に変異が“ない”腫瘍の予後は不良であり、有効な治療薬の発見が急がれています。
- 私たちはIDH遺伝子変異がない低悪性度神経膠腫を発症するマウスモデル(MADMマウスモデル)を作成し、腫瘍になる前の異常細胞と腫瘍細胞を解析した結果、エピゲノム修飾酵素であるEZH2が腫瘍の形成に必須であることがわかりました。このマウスにEZH2の阻害剤を投与すると、腫瘍の増大が抑えられました。次に、ヒトのIDH遺伝子変異がない低悪性度神経膠腫についても、EZH2阻害剤は細胞株の増殖を抑えることを確認しました。
- ヒト神経膠腫細胞の研究とマウスモデルの研究を有効に組み合わせることで、IDH遺伝子変異がない特定のタイプの低悪性度神経膠腫の患者さんに、EZH2阻害剤が有効である可能性を初めて示すことができました。
背景
神経膠腫は小児や若年者にもよく見られる脳腫瘍であり、徐々に運動麻痺、言語や意識の障害等を引き起こし死に至らしめるため、有効な治療法の開発は喫緊の課題と考えられています。手術は神経膠腫の重要な治療法の一つですが、いかに手術技術が向上しても安全に全てを取り切ることは難しいことも多く、新しい治療薬の発見が不可欠です。そのため全世界で大規模なヒト神経膠腫の解析研究が急速に進んでいますが、未だ神経膠腫の大部分において新しい治療薬は発見されていないことから、これまでにないアプローチでの研究が必要と考えました。本研究では神経膠腫ができる前から、今後神経膠腫になる細胞を追跡できるシステムを組み込んだMADMマウスモデルを用いました。これにより、これまでのヒト神経膠腫の解析研究では見つけることができなかった神経膠腫の形成に重要な異常分子を同定し、有望な治療薬を見つけることを目的としました。
研究成果
今回用いたMADMマウスモデルでは、IDH遺伝子変異がない低悪性度神経膠腫の中で、それぞれ最も多く見られる遺伝子異常の一つであるp53遺伝子異常とNF1遺伝子異常をもつ細胞が脳内に作り出され、その細胞が徐々にIDH遺伝子変異がない低悪性度神経膠腫を形成します。さらにMADMマウスでは、p53,NF1遺伝子異常をもつ細胞だけが緑色に発光し、腫瘍を形成する前の段階からその細胞だけを回収し解析することができる画期的なモデルです。MADMマウス脳内のp53,NF1遺伝子異常細胞を経時的に回収し解析したところ、脳腫瘍を形成する前の早い段階からエピゲノム修飾酵素であるEZH2が高発現していることがわかりました(図1)。
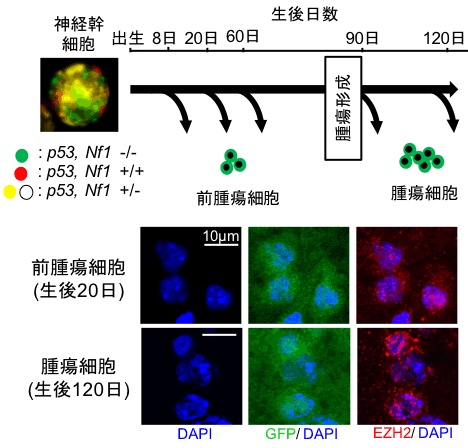
図1.MADMマウスモデルの特徴
腫瘍が形成されていく過程で、EZH2は多くの重要な遺伝子に異常なヒストン修飾(H3K27me3修飾)を引き起こし、それらの遺伝子発現を異常調節していることがわかりました。次いで、遺伝子操作によりMADMマウスのEzh2遺伝子をノックアウトすると、これらの異常なヒストン修飾を受けた遺伝子の発現は正常化し、腫瘍の増大は抑えられました。EZH2は有望な治療標的であると考え、MADMマウスにEZH2阻害剤(EPZ6438)を投与しMRIで腫瘍体積を評価したところ、EPZ6438の投与により腫瘍の増大が抑えられることがわかりました(図2)。また、ヒトでもIDH遺伝子変異がない低悪性度神経膠腫ではEZH2が高発現しており、本腫瘍の中で特にp53,NF1遺伝子異常がある細胞株(TM31)にEPZ6438を投与すると同様に細胞の増殖が抑えられることが明らかになりました。
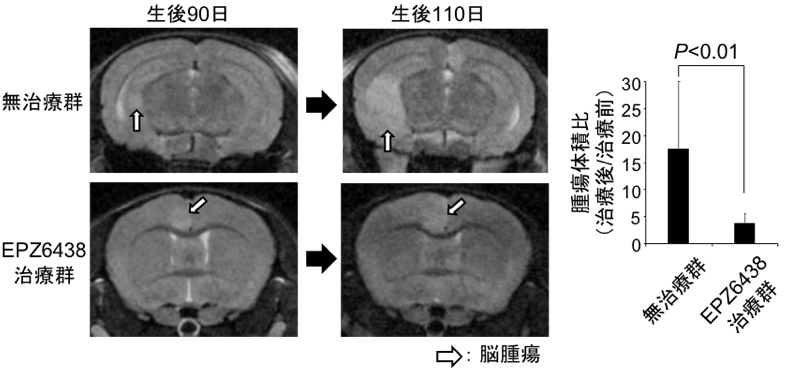
図2.EPZ6438による腫瘍の増大抑制効果
本研究からIDH遺伝子変異がない低悪性度神経膠腫の中で特にp53, NF1遺伝子異常がある腫瘍の患者さんには、EZH2阻害剤が有効なプレシジョンメディスンとして期待できる可能性を初めて見出すことができました(図3)。
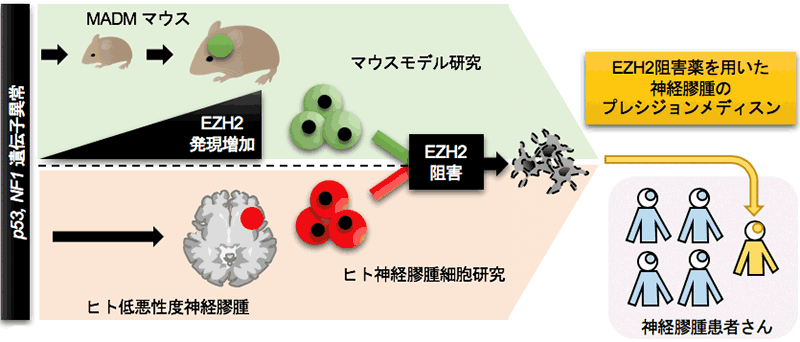
図3.EZH2阻害薬を用いた神経膠腫のプレシジョンメディスンの可能性
社会的意義・今後の展開
EZH2阻害剤は現在血液がん等で臨床治験が行われており、抗腫瘍剤としての有効性が確認されつつあります。したがって、近い将来、実際の臨床現場で使用される治療薬となる可能性があります。今後は有効な治療法がなく困っておられるIDH遺伝子変異がない低悪性度神経膠腫の中で、特にp53,NF1遺伝子異常がある腫瘍の患者さんに対してもEZH2阻害剤の使用が可能になることを目標とし、まずはEZH2阻害剤の臨床治験を進めることを検討しています。
用語解説
- ※1.神経膠腫(しんけいこうしゅ)
- 脳に原発する原発性脳腫瘍の中で最も多くみられる腫瘍であり、様々な悪性度を示す腫瘍が含まれます。悪性度はWHO分類で形態学的な特徴により規定されており、大きく低悪性度神経膠腫と最も悪性度の高い膠芽腫(グリオブラストーマ)に分類されます。膠芽腫は極めて予後不良であり、現在の標準治療による生存期間中央値は約14.6ヶ月です。一方で低悪性度神経膠腫は膠芽腫に比べると緩徐ながら確実に増大し、増大を抑える有効な治療薬はなく最終的には死亡する難治性の腫瘍です。近年低悪性度神経膠腫の中でも、後述するIDH遺伝子変異がある腫瘍は予後良好であり、IDH遺伝子変異がない腫瘍は予後不良であることが明らかになりました。
- ※2.EZH2
- EZH2はヒストンH3のヒストンテールの27番目のリジンのトリメチル化(H3K27me3)を行うヒストン修飾酵素です。EZH2によりH3K27me3修飾を受けた遺伝子はその遺伝子発現が抑制されます。EZH2は正常な分化の過程において、適切にH3K27me3修飾を行い多くの遺伝子の発現を調節する重要な役割を果たしていることがわかっています。多くのがんでEZH2が高発現していることが明らかになり有望な治療標的として注目されています。
- ※3.IDH遺伝子変異
- 低悪性度神経膠腫の約8割でIDH遺伝子変異を認め、その変異がある腫瘍は予後良好であることが明らかになりました。IDH分子は細胞のグルタミン代謝経路に関わる分子であり、IDH遺伝子の変異によりその機能の変容が起こり、腫瘍に特異的な代謝産物である2-ヒドロキシグルタル酸 (2-HG) を合成します。この2-HGがDNA高メチル化等のエピゲノム異常を誘導し、腫瘍形成に重要な役割を果たすことが明らかになっています。
- ※4.MADMマウスモデル
- p53, NF1遺伝子に対して遺伝子操作を加えたことでIDH遺伝子変異がない低悪性度神経膠腫を自然発生するマウスモデルです。遺伝子異常は胎生期に神経幹細胞に発生します。緑色に発光するgreen fluorescent protein (GFP)、赤色に発光するred fluorescent protein (RFP) の遺伝子も組み込まれており、p53とNF1遺伝子が両方の染色体で欠失した細胞は緑色に、片方の染色体で欠失した細胞は黄色もしくは無色、両方の染色体がともに欠失していない細胞は赤色に発光します。これらの4色の細胞が胎生期にそれぞれ同数個出現しますが、徐々に緑色の細胞が優位に増殖し、緑色の細胞が生後90日前後で脳腫瘍を形成します。
- ※5.エピゲノム
- エピゲノムとはDNAの塩基を変換することなく、その遺伝子の発現を調節する機構です。エピゲノム機構はDNAメチル化、ヒストン修飾(ヒストンテールのメチル化、アセチル化等)、クロマチン構造変化等が関わっていることが発見されています。臓器の発生等において重要な役割を果たしていることがわかっていますが、大腸がん等の多くのがん腫で、エピゲノム異常ががんの形成に重要な役割を果たしていることが明らかになりつつあります。
- ※6.プレシジョンメディスン
- プレシジョンメディスン(個別化精密医療)は、患者さん個人レベルで最適な治療方針を選択して行う医療のことであり、がん治療では患者さんの腫瘍内で起こっている遺伝子異常を調べ、その遺伝子異常に適した治療薬を選択して行われます。日本でもEGFR (epidermal growth factor receptor) 遺伝子変異がある肺がんの患者さんにEGFRチロシンキナーゼ阻害薬が使用できるようになっており、今後多くのがん治療への展開が期待されています。
発表雑誌
- 論文名:
- Pathogenic Epigenetic Consequences of Genetic Alterations in IDH-wild-type Diffuse Astrocytic Gliomas
- 掲載紙:
- Cancer Research
- 著者:
- Fumiharu Ohka1,2,13, Keiko Shinjo1,13, Shoichi Deguchi1,2, Yusuke Matsui3, Yusuke Okuno4, Keisuke Katsushima1, Miho Suzuki1, Akira Kato2, Noboru Ogiso5, Akane Yamamichi1,2, Kosuke Aoki2, Hiromichi Suzuki2, Shinya Sato6, Nirmala Arul Rayan7, Shyam Prabhakar7, Jonathan Göke7, Teppei Shimamura8, Reo Maruyama9, Satoru Takahashi6, Akio Suzumura10, Hiroshi Kimura11, Toshihiko Wakabayashi2, Hui Zong12, Atsushi Natsume2*, and Yutaka Kondo1*.
- 所属:
-
- Division of Cancer Biology, Nagoya University Graduate School of Medicine, Nagoya, Japan
- Department of Neurosurgery, Nagoya University Graduate School of Medicine, Nagoya, Japan
- Laboratory of Intelligence Healthcare, Nagoya University Graduate School of Medicine, Nagoya, Japan
- Center for Advanced Medicine and Clinical Research, Nagoya University Hospital, Nagoya, Japan
- Laboratory of Experimental Animal, National Center for Geriatrics and Gerontology (NCGG), Obu, Japan
- Experimental Pathology and Tumor Biology, Nagoya City University Graduate School of Medical Sciences, Nagoya, Japan.
- Computational and Systems Biology, Genome Institute of Singapore, Singapore, Singapore
- Division of Systems Biology, Nagoya University Graduate School of Medicine, Nagoya, Japan
- Project for Cancer Epigenomics, Cancer Institute of Japanese Foundation for Cancer Research, Tokyo, Japan
- Department of Neuroimmunology, Research Institute of Environmental Medicine, Nagoya University, Nagoya, Japan
- Cell Biology Center, Institute of Innovative Research, Tokyo Institute of Technology, Yokohama, Japan
- Department of Microbiology, Immunology and Cancer biology, University of Virginia School of Medicine
- These authors equally contributed to this work
お問い合わせ先
研究内容に関してのお問い合わせ先
名古屋大学大学院医学系研究科 脳神経外科学
助教 大岡 史治
准教授 夏目 敦至
名古屋大学大学院医学系研究科
腫瘍生物学
教授 近藤 豊
広報担当
名古屋大学医学部 医学系研究科総務課総務係
AMED事業に関してのお問い合わせ先
国立研究開発法人 日本医療研究開発機構(AMED)
戦略推進部 がん研究課