希少遺伝性難病であるコケイン症候群(早老症)の発症メカニズムが明らかに・老化に伴う諸症状の病態解明や治療薬開発に有益な疾患モデルマウスを開発
2020-03-06 名古屋大学,日本医療研究開発機構
名古屋大学環境医学研究所(所長:山中宏二)発生遺伝分野の荻朋男 教授、中沢由華 助教らの研究グループは、遺伝子の転写注1)中に生じたDNAの傷を効率よく修復するためには、RNA合成酵素注2)が特定の目印で標識されること (ユビキチン化修飾注3))が重要であることを明らかにしました。
ヒトの体を構成している数十兆個の細胞では、遺伝情報が格納されているDNAから随時必要な情報をRNAに転写して取り出した後、これを蛋白質に翻訳注4)することで生命活動の基礎になるさまざまな機能を実現しています。遺伝子が転写される領域(転写領域)に生じたDNAの傷はRNA合成酵素の進行を妨害するため、これらを速やかに取り除くことは生体恒常性の維持に極めて重要です。しかし、転写領域でのDNAの修復がどのようなメカニズムで開始されるのかは長年不明でした。
本研究では、精密質量分析や細胞生物学的解析注5)、新たに開発した、次世代シーケンサー注6)を用いたRNA合成酵素とDNA損傷の局在解析等を行い、DNA修復の開始には2型RNA合成酵素(RNAPII)を構成するRPB1蛋白質の1268番目のリジン残基(Lys1268)のユビキチン化修飾が必須であることを明らかにしました。この1268番目のリジンをアルギニン(Arg)に置き換えることで、RNA合成酵素のユビキチン化修飾を阻害したモデルマウス(RPB1-Lys1268Arg)を開発したところ、コケイン症候群注7)(指定難病 192)に代表されるヒトの遺伝性早老症と類似した、神経症状(運動神経の劣化)など老化に伴う諸症状が観察されることを確認しました。このモデルマウスは、転写に関する基礎研究のほか、老化に関連するさまざまなヒト疾患の病態解明や、治療薬の開発に有益なツールとなることが期待されます。
本研究成果は、令和2年3月5日付(日本時間3月6日午前1時)米国科学雑誌「Cell」のオンライン版に掲載されます(雑誌掲載は3月19日号)。
この研究は、国立研究開発法人 日本医療研究開発機構(AMED)難治性疾患実用化研究事業 オミックス解析拠点:「ゲノム不安定性疾患群を中心とした希少難治性疾患の次世代マルチオミクス診断拠点構築」の支援のもとで行われたものです。
ポイント
図1参照
- 2型RNA合成酵素(RNAPⅡ)を構成するRPB1蛋白質の1268番目のリジン残基のユビキチン化修飾は、転写領域でのDNA修復の開始反応に必須である。
- 転写障害の発生時には、ユビキチン化されたRNAPⅡとUVSSA蛋白質が協調的に働き、DNA修復蛋白質の複合体であるTFIIHをDNA損傷箇所へ集積させる。
- 新たに開発したDNA損傷の検出法(strand-specific ChIPseq法)により、DNA損傷箇所で停止したRNAPⅡとDNA修復の速度をゲノムワイドに定量することが可能になった。
- RNAPⅡのユビキチン化修飾システムは、DNA損傷を効率良く修復し、正常な転写を維持することで、コケイン症候群などに見られる神経変性注8)病態を抑制している。
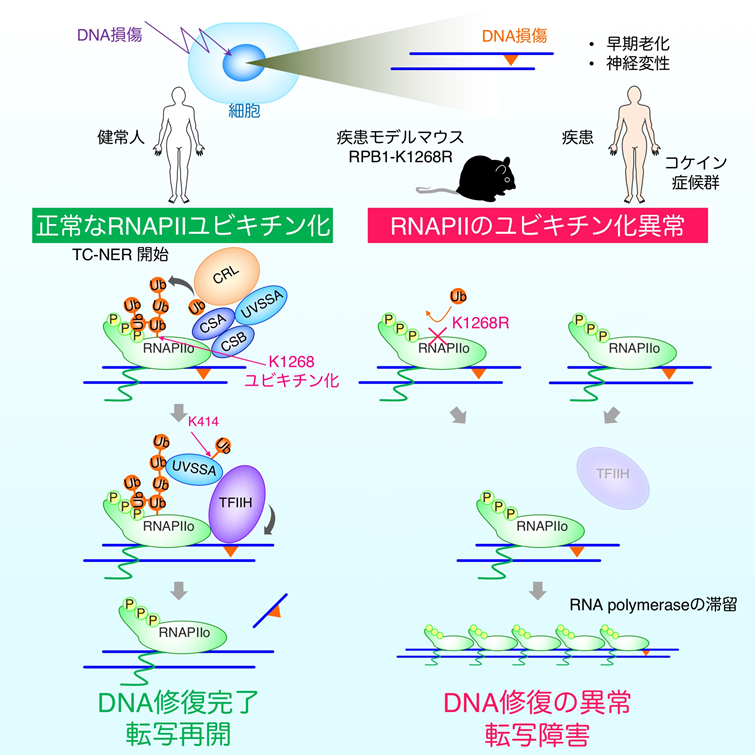
図1:GA:RNAPⅡのユビキチン化修飾は転写領域の効率的なDNA修復に必要
研究の背景
生物の遺伝情報を格納したゲノム(DNA)は、生体内の代謝産物のほか外来の放射線や化学物質など、さまざまな要因により常に損傷しています。このため、ゲノムを安定に維持・伝達するには、「DNA修復機構」による速やかな損傷の除去が必要です。ヒトでは、遺伝情報の不安定化は、発がんや老化に伴う諸症状の原因になるほか、生まれながらにDNA修復機能が正常に働かないために、奇形などの各種の発育異常や、神経症状、早期老化、その他多様な症状を示す遺伝性疾患(ゲノム不安定性疾患注9))も存在します。
DNAに生じた傷は、遺伝情報を読み出して利用する際にもトラブルを起こします。遺伝情報はDNAから必要な領域がRNAにコピーされ(転写)、蛋白質へと翻訳されます。細胞の種類や時期により、必要とされる蛋白質の種類や量が異なるため、転写は厳密な制御が必要です。遺伝子の転写は2型RNA合成酵素(RNAPⅡ)が行いますが、転写中のDNAに傷があると、RNAPⅡは遺伝情報をコピーすることができずに傷の手前で停止します。そこで、DNAの傷を速やかに除去して転写を再開するメカニズムが、転写と共役したDNA修復機構(transcription-coupled DNA repair: TCR)になります。TCRは大腸菌からヒトまで多くの生物で保存されていることから、生命機能の維持に重要なシステムであると言えます。TCRを身近なものに置き換えて説明したものが図2になります。
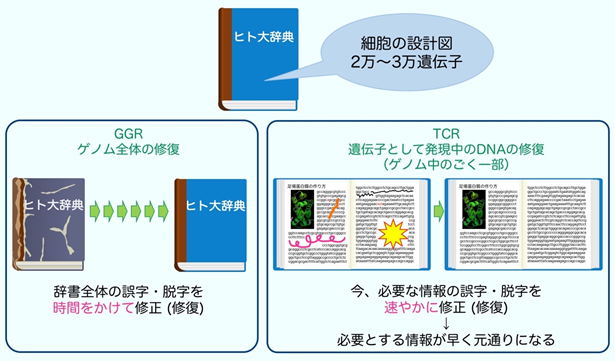
図2:転写と共役したDNA修復-TCRのイメージ
ヒトの遺伝情報を百科事典に喩えると、この中には細胞の設計図となる2~3万種類の蛋白質を作るための遺伝子に関する情報が記載されています。ここで、ゲノム全体の修復(global genome repair: GGR)とは、古くなった辞典全体を時間をかけて元どおりに修復するメカニズムです。これに対してTCRは、今必要とされている遺伝子に関する情報を速やかに修復するためのメカニズムです。TCRが上手く機能しないと、DNAに傷があり必要な情報が利用できない場合には、細胞は死んでしまいます。
コケイン症候群(Cockayne syndrome: CS)はゲノム不安定性疾患の1つであり、TCRの異常により、小頭症や低身長、進行性の各種の神経症状(難聴、視力障害、歩行障害)、腎不全などを発症する病気です。発症頻度は出生100万人に1名程度の非常にまれな劣性遺伝性疾患注10)です。疾患の原因になる異常は、ERCC8(CSA-日本人の創始者変異注11)が知られている)、ERCC6 (CSB)遺伝子に多く見つかり、これ以外にもERCC1、ERCC3(XPB)、ERCC2(XPD)、ERCC4(XPF)、ERCC5(XPG)遺伝子の異常により、コケイン症候群とあわせて色素性乾皮症注12) (XP)やファンコニ貧血注13)(FA)など、他のゲノム不安定性疾患を併発する症例が報告されています(図3)。
研究内容
TCRにより転写領域のDNAの傷がどのように直されるのかに関しては、30年程前に図3に記したような作動モデルが提唱されました。しかしこれまで、TCRがどのように開始されるのかは分かっていませんでした。
私たちは、DNA損傷後にRNAPⅡが別の蛋白質で目印が付けられていることに着目し、この目印(ユビキチン化修飾)によってTCRに必要なさまざまな蛋白質のDNA損傷箇所への集積が開始されるのではと考えました。そこでまず、DNA損傷の処理を行った細胞からRNAPⅡを精製し、目印となるユビキチンがRNAPⅡの何処に結合しているかを精密質量分析法で決定しました。その結果、RNAPⅡを構成している複数の蛋白質のうち、最大のサブユニットであるRPB1の1268番目のリジン(Lys: K)残基(RPB1-K1268)がユビキチン化されることがわかりました。
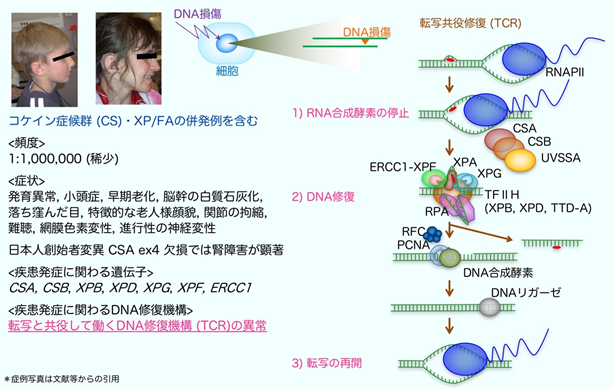
図3:コケイン症候群の病態概要と正常なTCRの分子反応の模式図
ゲノム編集法により、RPB1の1268番目のリジンをアルギニン(Arg: R)に置換させた細胞を作成し(RPB1-K1268R)、DNA損傷の処理後にRNAPⅡのユビキチン化修飾の有無を確認したところ、予想通りRPB1-K1268Rの細胞ではユビキチン化したRNAPⅡがなくなりました。また、DNA損傷の処理を行った野生型の細胞とRPB1-K1268R細胞からRNAPⅡを精製し、これに結合するDNA修復蛋白質を確認したところ、RNAPⅡのユビキチン化修飾に依存して、DNA修復蛋白質の複合体であるTFIIHが集積することが分かりました。また、RNAPⅡへのTFIIHの集積には、私たちが以前に別の遺伝性疾患の原因因子として同定したUVSSA蛋白質も関与しています(図4)。
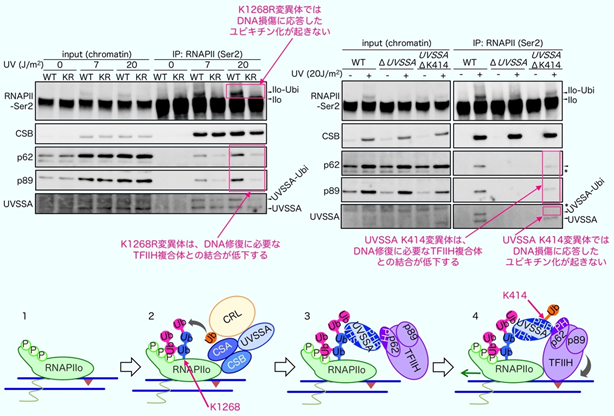
図4:RPB1-K1268のユビキチン化に依存したTFIIHの集積上-蛋白質電気泳動図
下-TCR開始反応模式図; 青線がDNAを、紫の三角がDNA損傷を表しています
DNA損傷が生じた際に、RNAPⅡのユビキチン化修飾がさまざまな遺伝子の転写の回復にどのように寄与しているかを調査するため、今回、DNA損傷とRNAPⅡの局在を定量するための新しい技術の開発を行いました。細胞からRNAPⅡを精製する際に、RNAPⅡに結合したDNAの断片を回収し、これを次世代ゲノム解析注14)に用いられる手法で網羅的に塩基配列の解析を行います(ChIPseq法)。DNA損傷の処理後にRNAPⅡを回収すると、RNAPⅡの多くはDNAの傷の手前で停止するため、回収されたDNA断片の片方の鎖には傷が残っています。この傷は塩基配列の解析の妨げになり、DNA断片を遺伝子配列に位置付けた際に偏りとなって現れます(strand-specificity)。この偏りは、RNAPⅡが転写をしている鎖とその反対側の鎖の割合を示しており、DNAの傷がない時には偏りが無く、DNAの傷が多く残っているとより大きな偏りとして現れます(strand-specific ChIPseq法:図5)。本法により、全遺伝子領域でのDNA損傷とRNAPⅡの局在の定量が可能です。RNAPⅡのユビキチン化修飾ができない細胞では、活発に転写されている多くの遺伝子でDNA修復の速度が遅くなっていることが明らかになりました。
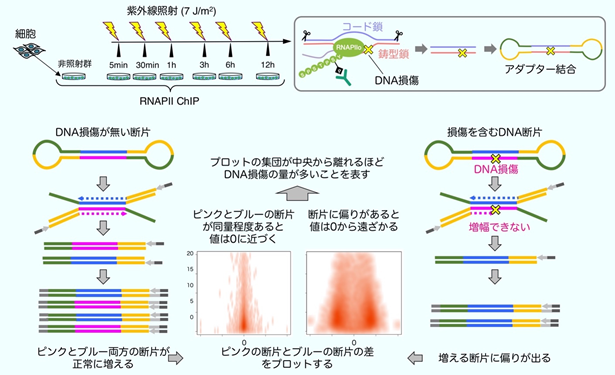
図5:strand-specific ChIPseq法によるゲノムワイドなDNA損傷の定量法
RNAPⅡのユビキチン化修飾ができない細胞では、上に記したようにTCR反応が開始できないため、DNAの傷が修復できない状態が長時間持続します。そこで、今回明らかにされたRPB1の1268番目のリジンのユビキチン化の異常が、コケイン症候群の病態と密接に関わっていることを証明するために、RPB1の1268番目のリジンをアルギニンに改変した遺伝子改変マウス(Polr2a-K1268R)を作成しました(図6)。Polr2a-K1268Rホモ接合マウスは、内在性のDNA損傷が多く発生する遺伝的背景(本研究では色素性乾皮症モデルとなるXpa-/-マウスを使用)では、TCRの異常のため長時間の転写障害が生じていると考えられます。このマウス(Polr2a-K1268Rホモ接合 / Xpa-/-二重変異マウス)は、他のマウスと比べて生後より体のサイズが非常に小さく、寿命が極端に短い早老症の病態を示しました。また、ヒトのコケイン症候群で見られるような、白内障や骨格の異常も観察され、特に、運動ニューロンの劣化が顕著に見られました。これらのことから、RNAPⅡのユビキチン化修飾、特にRPB1の1268番目のリジン残基の修飾は、TCR反応の開始に必須であり、この反応が障害されることでコケイン症候群が発症していることが示されました。
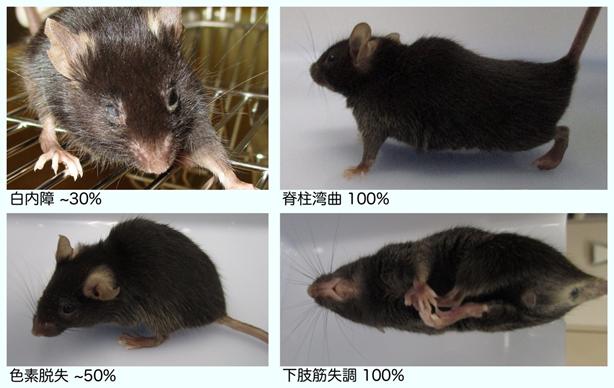
図6:Polr2a-K1268R遺伝子改変マウス(上写真全て)はコケイン症候群様の病態を示す
成果の意義―まとめ
本研究から、早期老化や進行性の神経症状を発症するコケイン症候群の分子病態を説明する重要な知見が得られました。コケイン症候群は、転写活性の高い遺伝子領域に生じたDNA損傷を選択的に修復する機構(転写共役修復:TCR)の異常により発症します。これにより、長期的な転写障害やDNA損傷の蓄積が細胞死を誘発し、全身性の重篤な病態を引き起こすと理解されてきました。TCRの作用メカニズムは、(1)DNA損傷箇所での2型RNA合成酵素(RNAPⅡ)の停止、(2)DNA修復、(3)転写の再開の順に進行しますが、これまで停止したRNAPⅡがどのような機序でDNA修復を開始するのか不明でした。我々は、コケイン症候群に関連する因子であるCSA/CSB複合体に依存してユビキチン化修飾を受けるRNAPⅡのリジン残基(K1268)を特定し、DNA損傷によるこのユビキチン化修飾がTCRの開始に必須であることを見出しました。本ユビキチン化修飾に異常を示すマウスは、コケイン症候群様の神経症状を示し、特に、運動ニューロン注15)の劣化が顕著であることなどを確認しています。このモデルマウスは、転写に関する基礎研究のほか、老化に関連するさまざまなヒト疾患の病態解明や、治療薬の開発に有益なツールとなることが期待されます。
以上の研究は、ライデン大学メディカルセンター(LUMC)のLuijsterburg 博士のほか、環境医学研究所の山中宏二 教授、東京大学医科学研究所の真下知士 教授らの研究グループを中心とした共同研究により実施されました。第一著者の中沢由華 助教(環研)のほか、原雄一郎 特任講師(環研)、岡泰由 講師(環研)、小峯起 助教(環研)、Diana van den Heuvel 博士(LUMC)、郭朝万 博士研究員(環研)、大学保一 博士(東北大学)らが実験上の主要な貢献をしています。
用語説明
- 注1)転写
- DNA(デオキシリボ核酸)から遺伝情報を読み取り、蛋白質を作る遺伝子のコピーとなるメッセンジャーRNA(mRNA)を合成すること。細胞の種類や状態によって、必要とされる蛋白質が異なるため、遺伝子の転写は厳密な制御が必要とされる。
- 注2)RNA合成酵素(RNAポリメラーゼ/RNAP)
- RNAの転写を行う蛋白質の複合体であり、mRNAの合成は2型RNA合成酵素(RNAPⅡ)により行われる。
- 注3)ユビキチン化修飾
- 76個のアミノ酸からなるユビキチンと呼ばれる小さな蛋白質が、別の蛋白質中のリジン残基に結合することで、分解や機能活性化などのための目印となる。
- 注4)翻訳
- メッセンジャーRNA(mRNA)をもとに蛋白質を合成すること。
- 注5)細胞生物学的解析
- 細胞を用いて行う解析。本研究ではヒト細胞を用いて、DNA損傷を意図的に誘発させてDNA修復の活性を測定することや、細胞内の分子の働きを調査することを指す。ゲノム編集を行い、特定の遺伝子の機能に異常を持たせた細胞を使用することなどを含む。
- 注6)次世代シーケンサー
- DNAの塩基配列を調査する装置であり、同時に大量の塩基配列を調べることが可能。ヒト1人の全ゲノムDNAを、およそ1日で解読することができる。
- 注7)コケイン症候群(Cockayne syndrome: CS; 指定難病 192)
- 希少な難治性遺伝性疾患で、発育発達異常や早期老化などの病態を示す。主にCSA/CSB遺伝子の異常により発症し、有病率は数十万から100万人に1名程度である。日本人ではCSA遺伝子exon4の欠失により発症する症例が多い。
- 注8)神経変性
- 脳や脊髄などの神経細胞の一部が障害を受けること。
- 注9)ゲノム不安定性疾患
- 遺伝情報を安定に維持・伝達するために必要な「DNA修復・損傷応答機構」の異常により発症する疾患の総称。ゲノムDNAに生じた損傷を修復することができないために、好発がん性や先天性の発育異常、早期老化、進行性の神経変性など、様々の病態を示す。
- 注10)劣性遺伝性疾患(常染色体劣性遺伝性疾患)
- 遺伝形式の一つで、父母双方から疾患原因となる遺伝子の異常(変異)を受け継いだ時に発症する疾患のこと。患者の両親は通常は健常で、疾患原因遺伝子変異の保因者である。
- 注11)創始者変異
- 集団中で一人の祖先から、ある特定の遺伝子の異常が拡がったもの。
- 注12)色素性乾皮症(xeroderma pigmentosum: XP; 指定難病 159)
- 難治性遺伝性疾患で、日光過敏や皮膚がんの好発、進行性の神経症状などの病態を示す。日本国内の有病率は比較的高く、25,000人に1名程度である。XPA-XPG/XPV遺伝子の異常により発症する。
- 注13)ファンコニ貧血(Fanconi anemia: FA; 指定難病 285)
- 希少な難治性遺伝性疾患で、造血不全や各種奇形などの病態を示す。有病率は数十万人に1名程度。
- 注14)次世代ゲノム解析
- 多数の塩基配列を並列で同時に読むことで、大量のゲノムDNA情報を短時間で調査する技術。
- 注15)運動ニューロン
- 神経細胞の一種で、骨格筋をコントロールし運動を司る。
我々の研究グループでは、遺伝情報が不安定になることで発症するさまざまな疾患(ゲノム不安定性疾患)の症例収集と遺伝子検査・病態解析研究などを通じて、患者QOL(Quality of Life)の向上と、将来的な疾患緩和薬/治療薬開発に貢献することを目指しています。平成26年度より、AMED難治性疾患実用化研究事業として「ゲノム不安定性疾患群を中心とした希少難治性疾患の次世代マルチオミクス解析拠点」を組織し、国内外の臨床・基礎の研究室とネットワークを構築し、網羅的な症例収集と遺伝子検査を行っています。
論文情報
- 雑誌名
- Cell
- 論文タイトル
- Ubiquitination of DNA damage-stalled RNAPII promotes transcription-coupled repair
- 著者
- Nakazawa Y, Hara Y, Oka Y, Komine O, Heuvel D, Guo C, Daigaku Y, Isono M, He Y, Shimada M, Katoh K, Jia N, Hashimoto S, Kotani Y, Miyoshi Y, Tanaka M, Sobue A, Mitsutake N, Suganami T, Masuda A, Ohno K, Nakada S, Mashimo T, Yamanaka K, Luijsterburg M, and Ogi T(責任著者)
- DOI
- https://doi.org/10.1016/j.cell.2020.02.010
お問い合わせ
研究者連絡先
名古屋大学 環境医学研究所 発生遺伝分野
名古屋大学 大学院医学系研究科 人類遺伝・分子遺伝学教室
教授 荻 朋男(おぎ ともお)
報道連絡先
名古屋大学医学部・医学系研究科
総務課総務係
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 難病研究課