2020-03-13 京都大学iPS細胞研究所
ポイント
- デュシェンヌ型筋ジストロフィー(DMD)注1など遺伝子変異が原因である疾患の新規治療法を目指した遺伝子修復においては、ゲノム編集ツールの細胞内への送達技術が鍵となる。
- CRISPR-Cas9注2ゲノム編集に必要なCas9タンパク質とガイドRNAを効率よくナノ粒子に封入して送達する技術であるNanoMEDICシステムを開発した。
- 本システムは、Cas9/ガイドRNAが一過性に発現してゲノム編集を誘導し、オフターゲット変異注3が起きるリスクが軽減することが分かった。
1. 要旨
難病の半数以上は遺伝子変異が原因で起きることが知られています。それら疾患の新しい治療法開発に向け、CRISPR-Cas9などのゲノム編集技術を用いた遺伝子修復が注目されています。ゲノム編集技術においては、そのツールを細胞内に運ぶためのベクター注4が必要となりますが、現在遺伝子治療でよく用いられているウイルスベクターは、細胞内に導入後も長期的に発現し、狙った箇所以外のゲノムを変えてしまうオフターゲット変異などを起こしてしまう可能性があります。ゲノム編集技術を医療に応用するためには、安全性高くCRISPR-Cas9とガイドRNAを細胞に送りこむシステムの開発が必要です。
ピーター・ジー博士(元CiRA臨床応用研究部門)、堀田秋津講師(CiRA同部門)らは、CiRAと武田薬品工業株式会社(以下、「武田薬品」)との大型共同研究プログラムであるT-CiRAプロジェクト別注の一環として、新たな送達技術であるNanoMEDICを開発しました。このシステムは細胞へ導入されたCRISPR-Cas9/ガイドRNAが一時的にだけ作用し、また、iPS細胞を使った実験から、オフターゲット変異のリスクを抑え、かつ高効率にゲノム編集を行えることが分かりました。さらに、マウスの生体内においてもゲノム編集の効果が長期的に持続することも確認できました。今回の成果は、今後の遺伝子治療に向けた基盤技術として、医療応用に貢献することが期待されます。
この研究成果は2020年3月13日午後7時(日本時間)に英国科学誌「Nature Communications」でオンライン公開されました。
2. 研究の背景
まだ根本的な治療法のない難病の一つに、デュシェンヌ型筋ジストロフィー(DMD)があります。DMDの患者さんは国内に約3,500人、全世界では約250,000人いると推定されていますが、主に男児が発症し、その原因は性染色体であるX染色体上のジストロフィン遺伝子に変異があることが知られています。ジストロフィン遺伝子のエクソン注5が欠損したり重複したりすることで、遺伝子の読み枠注6が本来のものからずれてしまい、その結果ジストロフィンタンパク質が正常に作られなくなります。
そこで、DMD患者さんの遺伝子変異をゲノム編集技術を用いて修復することで、ジストロフィンタンパクが作られるようにし、症状を改善しようという、遺伝子治療に向けた研究が進められています。堀田講師らの研究グループは2014年に、患者さん由来iPS細胞のジストロフィン遺伝子をゲノム編集によりエクソンスキッピング注7を起こして修復し、分化させた筋細胞で正常型のジストロフィンタンパクが作られるようになったと報告しています(参考: CiRA HP 2014年11月27日「iPS細胞を使った遺伝子修復に成功 〜デュシェンヌ型筋ジストロフィーの変異遺伝子を修復〜」)。
CRISPR-Cas9システムを細胞に導入する際のベクターとして、比較的高効率に導入・送達できるアデノ随伴ウイルス(AAV)注8やレンチウイルス注9を利用したベクターがよく用いられます。しかし、 AAVやレンチウイルスは導入してから数年以上経っても発現が続くことがあり、それによるオフターゲット変異が懸念されています。また、AAVのもつDNA断片が、宿主のゲノムに挿入されてしまう現象も報告されています。
将来、患者さんへの遺伝子治療を実現するためには、CRISPR-Cas9を安全性高く、標的の細胞に届けることが必要です。そのためにも、オフターゲット変異や宿主DNAへの挿入といったリスクを低減させる、一過性の送達技術の開発が求められています。
3. 研究結果
1) 一時的にのみ発現する送達技術であるNanoMEDICを開発した
今回、研究グループは細胞内に取り込まれ、一過性に発現する送達技術を開発する上で、細胞膜から放出されるナノサイズ(10億分の1メートル)のカプセルであるウイルス様粒子(VLP)に注目しました。遺伝子治療分野では古くから利用されてきたレンチウイルスベクター注9の遺伝子群を最大限除去することで作成されるVLPは、形状はウイルスに似ていますが、ウイルスゲノムを包含せず、発現は一過的です。このVLP内部に、DNA切断酵素であるCas9タンパク質と標的ゲノム配列を認識するガイドRNAを搭載することで、ゲノム編集を行うことを目指しました。
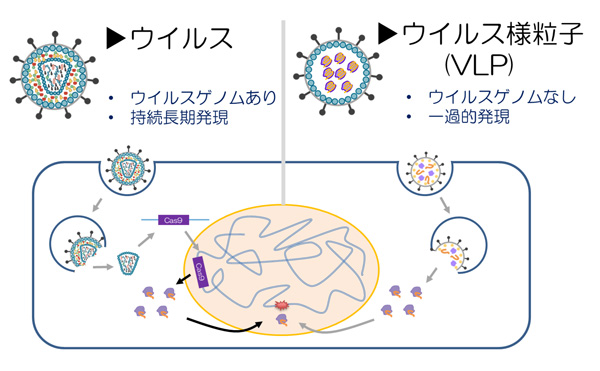
図1 ウイルスとウイルス様粒子(VLP)の違い
具体的には、VLPが細胞膜上で形成される際にCas9が取り込まれるよう、小分子に反応してドッキングするタンパク質注10の片割れ(FRBタンパク質)をCas9に連結し、もう一方の片割れ(FKBP12タンパク質)をVLPの裏打ちタンパク質(Gag)に連結しました。これら遺伝子を搭載したプラスミドDNA注11をHEK293T細胞注12に導入して、さらに小分子(AP21697)を加えると、Cas9が粒子内部に呼び寄せられます。さらに、ガイドRNAもGagと結合するように工夫して、粒子内部に呼び寄せました。その後、粒子の細胞膜が閉じられることにより、Cas9とガイドRNAが封入されたVLPができ上がります。グループはこのVLPをNanoMEDICと名付けました。
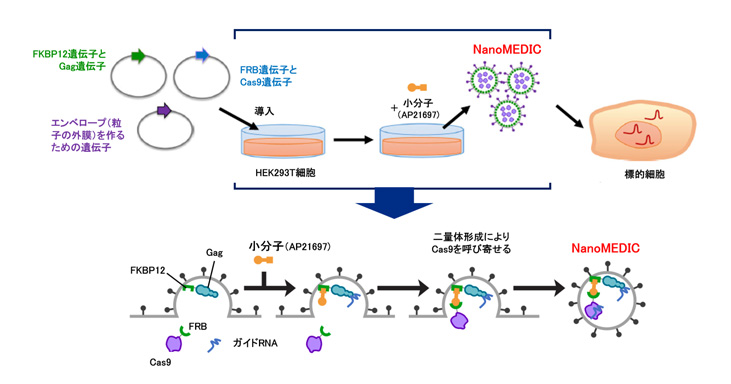
図2 NonoMEDICの作製方法とCas9タンパク質を内封するしくみ
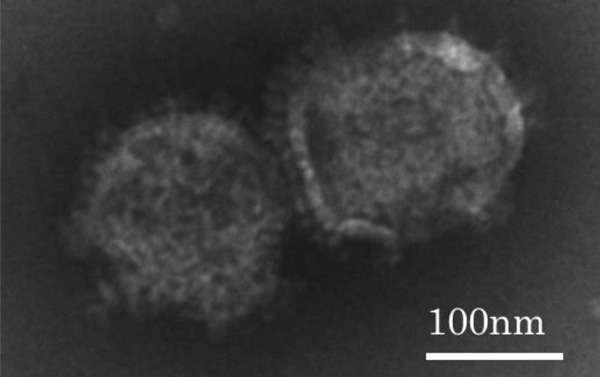
図3 NanoMEDICを透過型電子顕微鏡で観察した様子。
直径は130-140 nmほど
2) 患者さん由来iPS細胞を使って、NanoMEDICを用いたゲノム編集の効果を確認した
次に、研究グループはNanoMEDICによりゲノム編集を有効に行うことができるのかを、DMD患者さん由来iPS細胞を用いて検証しました。
まず、ジストロフィン遺伝子の44番目のエクソン(エクソン44)がないためにジストロフィンタンパクが作れない患者さんからiPS細胞を作製し、さらに骨格筋細胞へ分化させました。エクソン45の前部分を切断するとエクソン45が切除され、ジストロフィンタンパクが生成されるようになることが知られていますが、今回はその部分と後ろの部分をそれぞれ認識するガイドRNAを含んだNanoMEDICを骨格筋細胞に導入し、エクソン45を切除することでジストロフィンタンパクが作られるようにしました。すると、エクソン45の前部分のみを切断した場合は36%、前後を切断した場合は92%の確率でエクソン45が切除され、それに対応して前後を切断した場合において最もジストロフィンタンパクの発現が回復していることが分かりました。
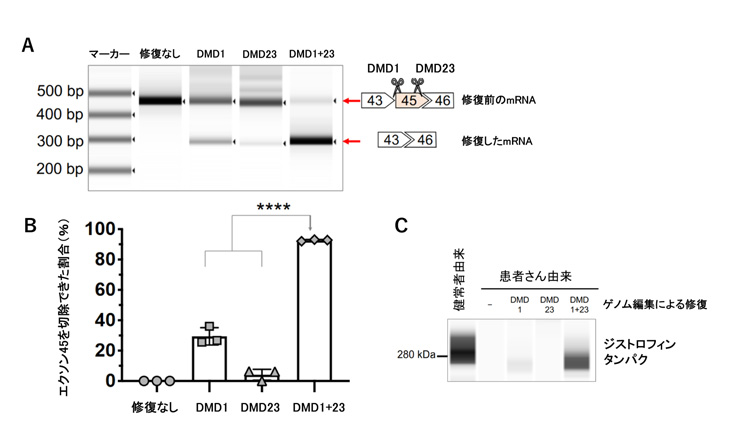
図4 患者さん由来iPS細胞から作製した骨格筋細胞におけるエクソンスキッピング
A: CRISPR-Cas9によりエクソン45をスキップ(削除)する前と後のジストロフィンmRNA を、その大きさにより分けて調べた。図の縦軸はmRNAの長さ(bp: 塩基対)を示しており、エクソンスキッピングが起きた後のmRNAはその分長さが短くなるため、下部にバンドが見える。
B: エクソン45を切除できた割合を示す。エクソン45の前後の部分双方を切断することで、非常に高効率にエクソンスキッピングを起こすことに成功した。
C: エクソン45を切除したことによりジストロフィンタンパクが作られるようになった。mRNAでのエクソンスキッピングの効率とジストロフィンタンパクの量が相関している。
また、懸念されているオフターゲット変異について、NanoMEDICを用いてゲノム編集を行った際にどうなるかを検証しました。HEK293T細胞に、6番染色体上のVEGFA遺伝子の配列の一部を認識するガイドRNAをもつNanoMEDICを導入しました。なお、この配列は非常によく似た配列が5番染色体上にあり、オフターゲット変異が起こりやすい配列です。実験の結果、DNAプラスミドをベクターとして用いてゲノム編集を起こした場合は、15%以上の確率で 5番染色体上でのオフターゲット変異が起こしましたが、NanoMEDICを用いた場合はそれがほとんど起こりませんでした。このことから、NanoMEDICはオフターゲット変異を起こしにくい技術であることが分かりました。
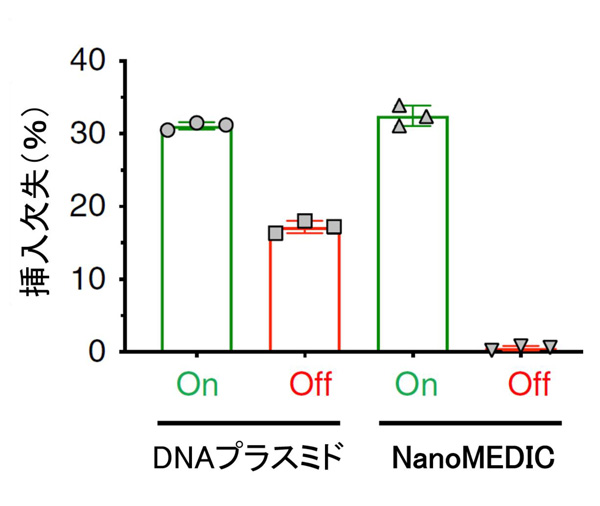
図5 NanoMEDICはCRISPR-Cas9によるオフターゲット変異のリスクを低減する
HEK293T細胞の中でVEGFA遺伝子を狙って、CRIPR-Cas9によるゲノム編集を行った。CRISPR-Cas9を導入するためのベクターとして、プラスミドDNAベクター(左)、NanoMEDIC(右)をそれぞれ用い、狙った箇所(On)と非標的のオフターゲット(Off)での変異発生率(縦軸)を調べたところ、NanoMEDICではオフターゲット変異のリスクがかなり低減された。
3) マウス生体内でもNanoMEDICを用いてエクソンスキッピングを誘導できた
さらに研究グループは、生体内においてもヒトのジストロフィン遺伝子を標的としたエクソンスキッピングを行えるかを調べることにしました。
まず、NanoMEDICに緑色発光タンパク質であるルシフェラーゼタンパクを搭載し、マウスに筋肉内注射しました。これにより、NanoMEDICが送達した場所において発現している間は発光するので、NanoMEDICが届けられた場所や、発現している期間を調べることができます。実際には、注射をされた筋肉以外の臓器にNanoMEDICが到達するようなことはなく、さらに、注射をしてから3日後には蛍光が消失しており、本技術が一過性に発現するものであることが確認されました。
次に、NanoMEDICにより届けられたCas9とガイドRNAにより、生体内でも狙った組織と標的ゲノム配列でゲノム編集が行われるかを調べました。ルシフェラーゼを作る遺伝子を二つのエクソンに分割し、その間にヒトジストロフィン遺伝子のエクソン45を挟みこんだ配列を組み込んだ遺伝子組換えマウスを作製しました。このマウスに、患者さん由来iPS細胞を用いた実験で使用した、エクソン45の前部分と後ろ部分を認識するガイドRNAをそれぞれもつNanoMEDIC二種類を筋肉内注射しました。通常ではルシフェリンタンパク質が分断されており発光は起こりませんが、うまくエクソン45が切除されれば、分断されていたルシフェラーゼ遺伝子が接合され、ルシフェラーゼタンパク質が作られるため発光します。実験の結果、NanoMEDICを投与して誘導されたエクソンスキッピング活性が160日後まで続いており、一回のNanoMEDICの投与でエクソンスキッピングが安定的に誘導されていることが分かりました。
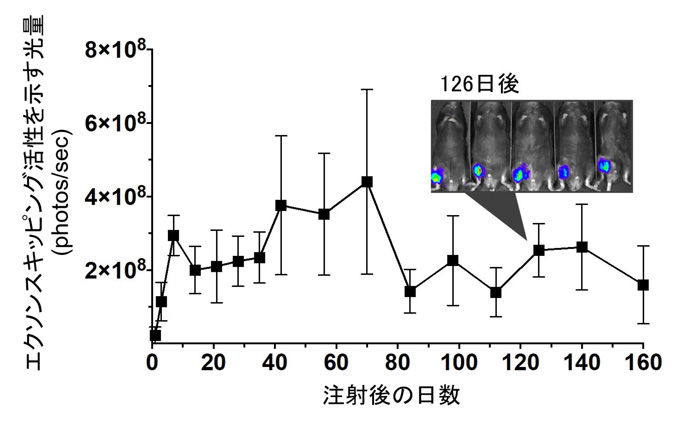
図6 NanoMEDIC投与後の、筋細胞におけるエクソンスキッピング活性
エクソンスキッピングが誘導されると発光するマウスにNanoMEDICを一回投与すると、160日後までエクソンスキッピングが持続していた。写真は、NanoMEDICを投与されたマウス(5匹)。注射をした後ろ脚部分の筋肉で発光が観察され、エクソンスキッピングが起きている様子が観察される。
最後に、DMDモデル(mdx)マウスにおいて、同様にNanoMEDICを用いたゲノム編集にてエクソンスキッピングを誘導できるかを検証しました。mdxマウスのジストロフィン遺伝子はエクソン23の中に一塩基変異があるためにジストロフィンタンパク質の発現が途中で止まってしまいますが、エクソン23をスキッピングすることでタンパク質発現を回復できることが分かっています。エクソン23の前の部位と後の部位を認識するガイドRNAを含むNanoMEDICの二種類をマウスの筋肉内に注射をしたところ、エクソン23が1.6%の割合でエクソンスキッピングを誘導できました。この結果より、NanoMEDICが生体内の骨格筋細胞にも送達され、狙ったゲノムDNAの箇所にエクソンスキッピングを起こすことが確認できました。
4. まとめ
本研究では、ゲノム編集技術を用いた遺伝子治療を開発する上で鍵となる、一過性に発現しオフターゲット変異リスクの低い送達技術であるNanoMEDICを開発しました。また、本技術は安全性が高いことに加え、生体内でも有効にゲノム編集を行えることを確認できました。NanoMEDICは比較的大きな分子を包含することができるため、今後は様々なより大きなゲノム編集ツールなどを細胞に送りことができ、ゲノム編集や遺伝子治療分野で汎用性のある技術となることが期待されます。さらに、研究グループは本技術を患者さんに応用することを見据え、臨床レベルで求められる量を製造する技術も開発しています。一方で、NanoMEDICはその形成にタンパク質が使用されていますが、そのタンパク質が宿主からの免疫反応を誘引する可能性があるため、今後はタンパク質を使用しない送達技術についての研究も期待されます。
5. 論文名と著者
- 論文名
Extracellular nanovesicles for packaging of CRISPR-Cas9 protein and sgRNA to induce therapeutic exon skipping - ジャーナル名
Nature Communications - 著者
Peter Gee1,2,3, Mandy S.Y. Lung1, Yuya Okuzaki1, Noriko Sasakawa1, Takahiro Iguchi1, Yukimasa Makita3,4, Hiroyuki Hozumi3,4, Yasutomo Miura1, Lucy F. Yang1, Mio Iwasaki1, Xiou H. Wang1, Matthew A. Waller1, Nanako Shirai1, Yasuko O. Abe1, Yoko Fujita5, Kei Watanabe1, Akihiro Kagita1, Kumiko A. Iwabuchi1,3, Masahiko Yasuda6, Huaigeng Xu1, Takeshi Noda5, Jun Komano7,8, Hidetoshi Sakurai1, Naoto Inukai3,4, and Akitsu Hotta1,2,3*
*:責任著者 - 著者の所属機関
- 京都大学 iPS細胞研究所(CiRA)
- 京都大学 物質-細胞統合システム拠点(iCeMS)
- タケダ-CiRA共同研究プログラム (T-CiRA)
- 武田薬品工業株式会社 T-CiRAディスカバリー
- 京都大学 ウイルス・再生医科学研究所
- 実験動物中央研究所
- 国立病院機構 名古屋医療センター
- 大阪薬科大学
6. 本研究への支援
本研究は、下記機関より資金的支援を受けて実施されました。
- AMED 難治性疾患実用化研究事業
- AMED 再生医療実現拠点ネットワークプログラム iPS細胞研究中核拠点
- AMED 再生医療実現拠点ネットワークプログラム 疾患特異的iPS細胞の利活用促進・難病研究加速プログラム
- 国立精神・神経医療研究センター 精神・神経疾患研究開発費
- 日本学術振興会(JSPS)科研費
- iPS細胞研究基金
7. 用語説明
注1)デュシェンヌ型筋ジストロフィー(Duchenne muscular dystrophy: DMD)
筋ジストロフィーとは骨格筋の壊死・再生を主病変とする遺伝性筋疾患の総称であり、デュシェンヌ型筋ジストロフィーは、X染色体上にあるジストロフィン遺伝子(220万塩基の巨大遺伝子で、79ものエクソンをもつ)に変異があることにより、ジストロフィンと呼ばれるタンパク質が全くもしくはほとんどないために起こる。ジストロフィンは骨格筋細胞で細胞骨格と細胞膜を連結する役割を持つタンパク質で、ジストロフィンタンパク質が無いと筋細胞が脆弱になり、筋損傷、炎症、線維化が起こり、筋力の低下による運動障害、呼吸筋障害、心筋障害などが引き起こされる。ほとんどの患者さんは20歳前後で死亡する。
注2)CRISPR-Cas9
ゲノム編集技術(ゲノムの特定標的部位にDNA損傷を誘導することでDNA配列を編集する技術)の一つ。CRISPR(Clustered Regularly Interspaced Short Palindromic Repeat)-Cas9というDNA切断酵素と、切断させたい場所へとCas9を誘導するガイドRNAを使うことで、任意の場所のDNAを切断することができる。切断されたDNAが修復する際にゲノムDNAの一部が欠失するため、遺伝子の機能(タンパク質発現)をノックアウトすることができる。
注3)オフターゲット変異
ゲノム編集において、標的ゲノム箇所以外への部位へ意図せずに起きる変異。
注4)ベクター
目的の細胞に遺伝子などを導入するために使われる運び屋。
注5)エクソン
遺伝子の中で最終的なmRNAになる際に残っている部分のことをエクソンと言い、それ以外の部分をイントロンという。遺伝子の中には多くのエクソンとイントロンがあり、遺伝子の情報を写しとったRNAの段階で、エクソン同士をつなぎ合わせるスプライシングという現象がおこる。タンパク質はエクソン部分のみから形成される。
注6)遺伝子の読み枠
遺伝子(DNAの鎖)からタンパク質(アミノ酸の鎖)をつくる際に、3つのDNA塩基で一つのアミノ酸を指定している。そのため、遺伝子の途中で一つだけDNA塩基がなくなると、そこから先はアミノ酸を指定するDNAの組み合わせが全て変わってしまい、元のタンパク質とは全く異なるタンパク質となってしまう。
注7)エクソンスキッピング
DMDでは、ジストロフィン遺伝子の読み枠がずれるような突然変異が生じることで、ジストロフィンタンパク質の合成が途中で止まり、ジストロフィンタンパク質の欠損が生じる。ジストロフィンタンパク質には、79個のエクソン(タンパク質をコードする配列)があり、このうち問題のあるエクソンを読み飛ばすことで、少しだけ短いが最後まで翻訳されたジストロフィンタンパク質を得ることができる。このように標的のエクソンを意図的に読み飛ばすことでタンパク質発現を回復させる治療手法をエクソンスキッピング治療という。一般的にはmRNAに作用するアンチセンス核酸を用いた製剤が臨床開発されているが、アンチセンス核酸が消失するとスキッピング効果も消失してしまう。
注8)アデノ随伴ウイルス(Adeno-associated virus: AAV)
一本鎖のDNA分子をゲノムに持つウイルス。非病原性であり、基本的に染色体へのゲノム挿入を起こさず核内にとどまるため、安全性の高い遺伝子治療用のベクターとして広く用いられている。
注9) レンチウイルスベクター
一本鎖RNAゲノムを二本鎖DNAに逆転写して、標的細胞の染色体に挿入可能なHIV-1をベースに作られたウイルスベクター。病原性を発揮するアクセサリー遺伝子は削除されており、ウイルスの構成タンパク質であるGagおよび各種酵素を含むPolは、ベクター生産細胞で生産時にのみ供給されるため、一度だけ感染はするが増殖はしない。世界中で300件を超える臨床試験で使用されており、最近では白血病遺伝子治療薬キムリア(CAR-T細胞療法)でも、T細胞にCAR遺伝子を挿入するのにも用いられている。
注10) 小分子に反応してドッキングするタンパク質
普段は別々のタンパク質としてバラバラに存在するが、特定の小分子がやってくると、これを介して二つのタンパク質が結合できるようになる。ヒト由来のFKBP12タンパク質とFRBタンパク質は、タクロリムス (= FK506)を認識して結合することが知られており、今回の研究ではFRBタンパク質のタクロリムス結合部位を改変することで、タクロリムスの代わりにAP21967とだけ反応するシステムを応用し、ゲノム編集用Cas9タンパク質とウイルス粒子構成Gagタンパク質とを引き寄せた。
注11) プラスミドDNAベクター
プラスミドDNAとは、細菌等の細胞質内に存在し、ゲノムDNAと独立して自律複製を行う環状のDNA分子の総称。プラスミドDNAは小さく配列の改変が簡単なことから、大腸菌における遺伝子組換えの道具として一般的に用いられる。目的の配列や機能をもつ遺伝子を組み込んだプラスミドDNAベクターを、リポフェクション法や電気穿孔法などの方法で標的の哺乳類細胞に取り込ませると、数日から10日間ほどの間、外来遺伝子を働かせることが可能となる。しかし、一般的に生体組織への遺伝子導入は困難である。
注12) HEK293T細胞
ウイルスベクター産生によく用いられているヒト腎臓由来細胞株の一種。プラスミドDNAベクターの導入が高効率で可能。
別注) T-CiRA共同研究プログラム
CiRAと武田薬品の10年間の共同研究プログラムで、2015年に設立、2016年より研究活動を本格始動しました。武田薬品が200億円の提携費用を提供し、CiRAの山中伸弥所長の指揮のもと、CiRAおよび他研究機関の研究者のリードによる複数のプロジェクトを実施しています。具体的にはがん免疫療法、心不全、糖尿病、神経疾患、および難治性筋疾患などの疾患領域におけるiPS細胞技術の臨床応用に向けた最先端の研究を行っています。