遺伝子ハブMeis1による小脳神経発達の新たなメカニズム
2018-03-23 国立研究開発法人 国立精神・神経医療研究センター(NCNP)
国立研究開発法人 国立精神・神経医療研究センター(NCNP、東京都小平市 理事長:水澤英洋)神経研究所(所長:武田伸一)神経研究所病態生化学研究部、大輪智雄研究員、星野幹雄部長らのグループは、いくつかの癌発症に関わる遺伝子Meis1が、小脳においては神経前駆細胞から神経細胞への分化を促し、小脳発達に重要な役割を果たしていることを明らかにしました。
小脳は運動制御の中枢であり、そこに含まれる小脳顆粒細胞は、脳発達期に顆粒細胞前駆細胞と呼ばれる神経前駆細胞から続々と生み出され、1,000億個もの膨大な数に達することが知られています。正常な小脳機能の獲得には、脳発達の過程で適切なタイミングで適切な数の小脳顆粒細胞が前駆細胞から生み出されることが必須です。この制御がうまくいかないと髄芽腫(medulloblastoma)と呼ばれる癌が生じることが知られています。これまでの研究から、小脳顆粒細胞系の適正な増殖と分化には「Atoh1」、「Pax6」、「BMP」などの遺伝子(タンパク質)が重要であることが知られています。しかし、これらの遺伝子がどのように協調して機能するのかという仕組みについては明らかになっていませんでした。
星野部長らは、いくつかの癌を引き起こすことが知られているMeis1遺伝子が発達途上の小脳顆粒細胞とその前駆細胞で発現することを見出しました。Meis1遺伝子を破壊したノックアウトマウスでは、小脳が小さくなり、その内部構造が乱れてしまうことが判明しました。これらの結果はMeis1が小脳発達に必須であることを示しています。さらに同部長らは、(1)Meis1がPax6遺伝子の発現を誘導すること、(2)誘導されたPax6がBMPシグナルを促進すること、(3)そしてBMPシグナルがAtoh1の分解を引き起こし、(4)その結果として前駆細胞から顆粒細胞への分化を促進すること、を明らかにしました。
今回の知見により、これまで個別に明らかにされてきた小脳顆粒細胞の発生の分子機構を、Meis1というハブによって統合的に理解することが可能となりました。これは小脳にとどまらず、様々な脳部位での神経前駆細胞から神経細胞が生み出されるしくみの理解につながると考えられます。また、Meis1は一部の髄芽腫において異常に強く発現しています。Meis1は髄芽腫の発症に関与している可能性も考えられるために、今回の研究成果は広く今後の小脳腫瘍研究の発展に寄与すると考えられます。
この成果は、科学雑誌「Journal of Neuroscience(ジャーナル・オブ・ニューロサイエンス)」に平成30年1月31日に発表されました。
■研究の背景
我々の脳は膨大な数の神経細胞から構成されています。その千数百億個にもおよぶ神経細胞は、脳発達期において神経前駆細胞から適切なタイミングで適切な数だけ生み出されます。この適切さが損なわれますと脳腫瘍(脳の癌)が発生するとも考えられています。つまり、「神経前駆細胞から神経細胞への分化」の適切な制御は、正常な脳形成のために重要であるだけでなく、脳腫瘍の発生を防ぐ機構としても重要です。
小脳顆粒細胞の数は、脳全体の半数以上、すなわち約1,000億個にもおよびます。脳発達期には、神経前駆細胞である顆粒細胞前駆細胞が最初に出現し、それが爆発的に細胞分裂を繰り返すことで数を増やします。発達が進むと、前駆細胞は徐々に細胞分裂を停止し、小脳顆粒細胞へと分化します。この一連のプロセスにより、小脳顆粒細胞が生み出され、機能します。
前駆細胞の増殖と顆粒細胞への分化のタイミングは極めて精巧に調節されています。その精巧さが破綻すると前駆細胞が癌化し髄芽腫が生じると考えられています。そのため、この制御機構は多くの研究室で精力的に調べられてきました。たとえば、転写因子(遺伝子)Atoh1が前駆細胞の増殖性の維持に関与すること、転写因子(遺伝子)Pax6が前駆細胞の増殖や顆粒細胞の移動と成熟に関係すること、BMPシグナルが前駆細胞から顆粒細胞への分化に働くこと、などが報告されています。しかしそうした個別の研究があるものの、それぞれの遺伝子・分子群がどのように相互に連関して小脳顆粒細胞の発達を制御しているかについては、包括的に理解されていませんでした。また、顆粒細胞前駆細胞からは小児で最も多い脳腫瘍である髄芽腫が生じるとされていますが、その発症機構は未解明な部分が多く残されています。
他方、Meis1 (Myeloid Ectopic viral Integration Site 1 homolog)遺伝子は、転写因子と呼ばれるタンパク質をコードしており、血液細胞を作る幹細胞(造血幹細胞と呼ばれます)や嗅上皮細胞(匂いを感知する部位の幹細胞)の維持に働くことが知られていました。しかし、これまでに脳神経系での役割は明らかになっていませんでした。また、Meis1遺伝子が白血病や神経芽細胞腫などの悪性腫瘍の発症に関わることが知られていました。
■研究の内容
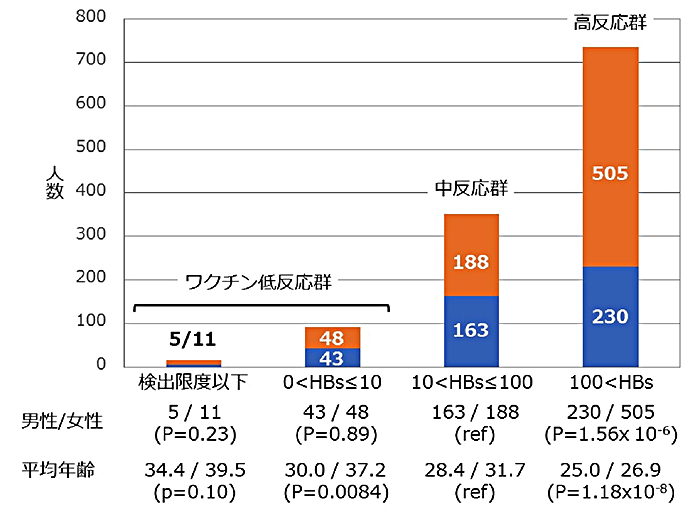
星野部長らは、癌発症に関わることが知られているMeis1遺伝子が小脳の発達途上で顆粒細胞とその前駆細胞で発現することを見出しました。この遺伝子を小脳で破壊したマウスを作製したところ、小脳が極端に縮小するだけでなく、その内部構造も破綻することが観察されました(図1)。このことは、Meis1が小脳発達においてたいへん重要な役割を果たしていることを示しています。

図1(左)正常なマウス小脳、(右)Meis1を破壊したマウスの小脳
ローマ数字(I-X)は小葉(小脳のひだ)番号
また、同部長らは発生途上の小脳ではMeis1蛋白質がPax6遺伝子ゲノムの発現調節領域に結合し、Pax6遺伝子の発現を誘導することを明らかにしました(図2)。Meis1により誘導されたPax6が、顆粒細胞の形を適切に調節し、小脳ネットワーク形成に関与することも示されました。
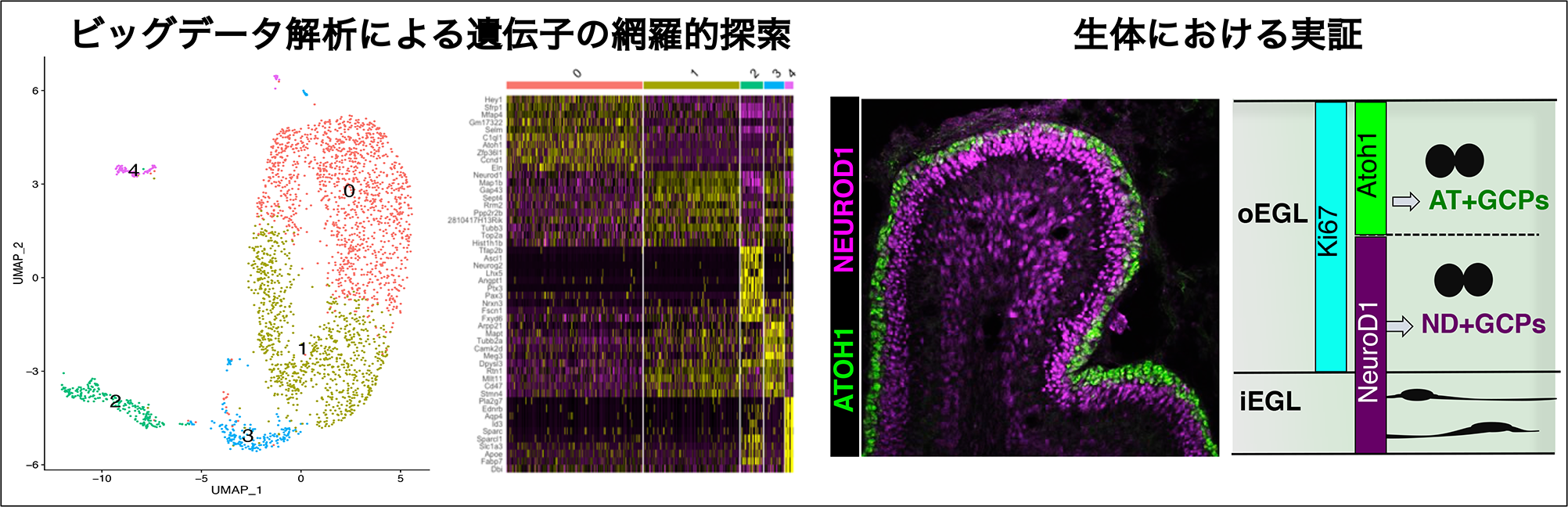
図2 Meis1タンパク質はPax6遺伝子の発現調節領域に結合し、
Pax6の遺伝子発現を誘導する
さらに、Meis1により誘導されたPax6タンパク質はSmad1とSmad5遺伝子を誘導し、その結果としてBMPシグナルが活性化され、活性化されたBMPシグナルはAtoh1タンパク質の分解に寄与することがわかりました(図3)。Atoh1は顆粒細胞の増殖能の維持に作用することが知られていますので、今回星野らにより見い出された「Meis1-Smad1/5-BMP-Atoh1分解」経路は、前駆細胞から顆粒細胞への分化に極めて重要であると考えられます。
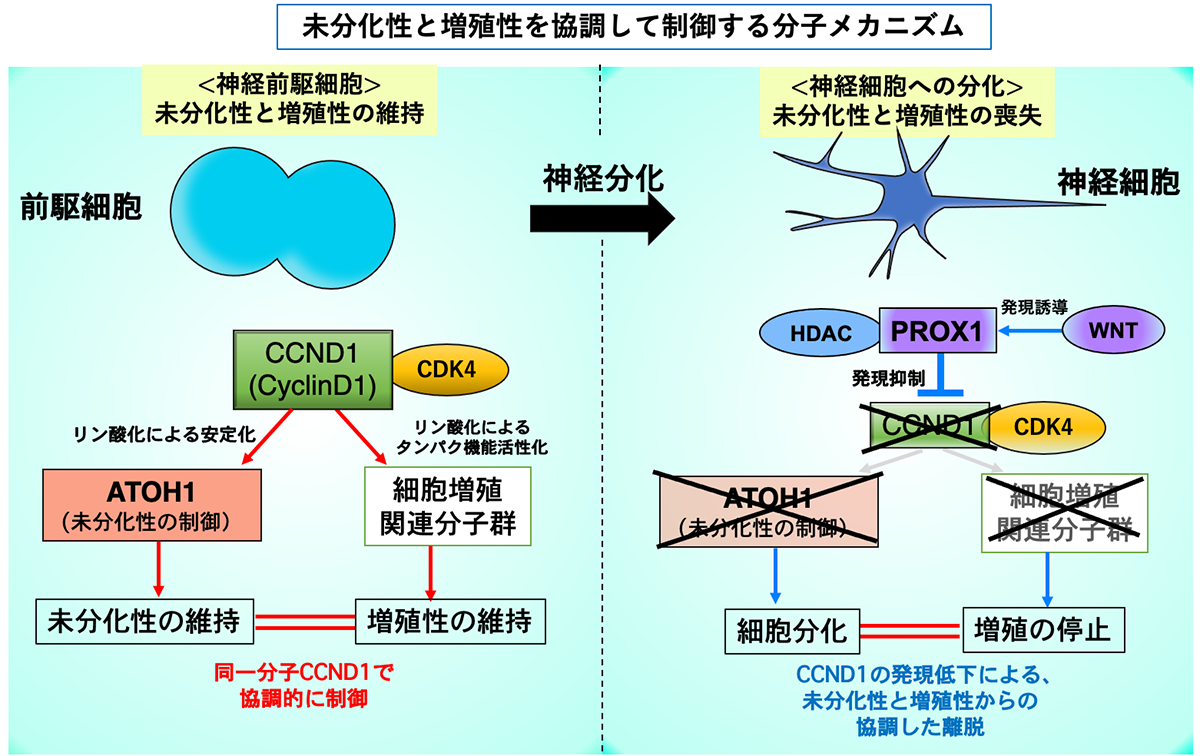
図3 顆粒細胞の分化と成熟を支配する遺伝子経路
■研究の意義・今後の展望
これまでにも、神経前駆細胞から神経細胞への分化を司るメカニズムの研究は行われてきており、小脳顆粒細胞系でもそれに関わるAtoh1、Pax6、BMPなど個別の遺伝子は同定されていました。本研究は、Meis1という「ハブ遺伝子」の機能を解析することで、これまで個別に報告されてきた研究成果を統合するだけでなく、小脳機能の成り立ちを理解することが可能となりました。本研究は、神経前駆細胞から神経細胞にいたる分化メカニズムの研究に大きく貢献すると考えられます。また、本研究の成果は、将来的には小脳変性疾患、小脳梗塞に対する小脳顆粒細胞補充療法などの治療法に道を開く可能性があります。また、癌関連遺伝子Meis1は小児で最も多い脳腫瘍である髄芽腫において過剰に発現しているため、この遺伝子が髄芽腫の発症に関与している可能性も強く示唆されました。本研究は、今後の小脳の脳腫瘍の研究の発展にも寄与すると考えられます。
なお、癌(腫瘍)は細胞の異常増殖であり、一方、神経細胞は細胞分裂を行わないことが特徴です。Meis1が両者に関わっている可能性を示す今回の結果は、細胞の『個性』を研究する上でも重要な示唆を含みます。
■用語解説
・転写因子
遺伝子DNAに結合し、特定の遺伝子の活動を制御するタンパク質。一つの転写因子が複数の遺伝子の働きを活性化したり不活性化したりする。一つの転写因子によって、その細胞の性質などが決められてしまうこともある。
・Atoh1
転写因子の一種。Math1とも呼ばれる。小脳の顆粒細胞前駆細胞で細胞増殖の促進に働いている。また本研究では触れていないが、顆粒細胞に興奮性神経細胞としての性質をもたらす働きがあることも知られている。
・Pax6
転写因子の一種。顆粒細胞前駆細胞の増殖、顆粒細胞の移動と分化に関係することが知られている。そのほか、神経発生において様々な脳領域で多様な働きを持つ。
・Meis1
転写因子の一種。一部の白血病や神経芽細胞腫などの悪性腫瘍の発症に関与することが知られている。脳における機能はわかっていなかった。小脳腫瘍である髄芽種で異常に強く発現することが知られている。
・髄芽種(medulloblastoma)
小児の脳腫瘍で最も多い癌。その多くは顆粒細胞前駆細胞から生まれると考えられている。
■論文情報
Meis1 Coordinates Cerebellar Granule Cell Development by Regulating Pax6 Transcription, BMP Signaling and Atoh1 Degradation.
Owa T, Taya S, Miyashita S, Yamashita M, Adachi T, Yamada K, Yokoyama M, Aida S, Nishioka T, Inoue YU, Goitsuka R, Nakamura T, Inoue T, Kaibuchi K, HoshinoM:
Journal of Neuroscience 38(5) 1277-1294, 2018
DOI:10.1523/JNEUROSCI.1545-17.2017
URL:http://www.jneurosci.org/content/38/5/1277.long
■助成金
本研究は、以下の事業・研究領域・研究課題によって得られました。
・文部科学省 科学研究費補助金 新学術領域研究「個性創発脳」(16H06528)
・文部科学省 科学研究費補助金 基盤研究(B)(15H04268)
・国立研究開発法人 日本医療研究開発機構 脳科学戦略推進プログラム(16dm0107085h0001)
■お問い合わせ先
【研究に関するお問い合わせ先】
星野 幹雄 (ほしの みきお)
国立研究開発法人 国立精神・神経医療研究センター 神経研究所
病態生化学研究部長
【報道に関するお問い合わせ先】
国立研究開発法人
国立精神・神経医療研究センター
総務課 広報係