2020-04-02 理化学研究所,日本医療研究開発機構
理化学研究所(理研)生命医科学研究センター粘膜システム研究チームの佐藤尚子専任研究員、大野博司チームリーダーらの国際共同研究グループ※は、マウスの胃に、細菌感染に対して防御的に作用する免疫応答が存在することを発見しました。
本研究成果は、ピロリ菌(ヘリコバクター・ピロリ[1])感染時の胃における新たな免疫応答と防御機構を明らかにしたもので、今後、免疫応答を人為的に誘導することで感染予防につながると期待できます。
これまで、胃は主に食物を消化・殺菌する臓器とされ、免疫応答の要である腸管と比較して、免疫誘導への関与は低いと考えられてきました。
今回、国際共同研究グループは、これまで共生細菌の影響を受けないと考えられてきた2型自然リンパ球(ILC2)[2]が、胃では細菌依存的であり、免疫グロブリンA(IgA)[3]の産生を誘導して防御的に作用することを明らかにしました。また、ピロリ菌感染マウスの解析により、ILC2がIgA誘導の要になっていることも明らかになり、免疫誘導である臓器として胃の重要性を初めて示しました。
本研究は、科学雑誌『Immunity』(4月14日号)の掲載に先立ち、オンライン版(4月1日付:日本時間4月2日)に掲載されます。
- ※国際共同研究グループ
- 理化学研究所 生命医科学研究センター 粘膜システム研究チーム
- チームリーダー 大野 博司(おおの ひろし)
(横浜市立大学大学院免疫生物学研究室、神奈川県立産業技術研究所) - 専任研究員 佐藤 尚子 (さとう なおこ)
- 研究員 加藤 完 (かとう たもつ)
- テクニカルスタッフⅡ 影山 友子(かげやま ともこ)
- テクニカルスタッフⅠ 新 奈緒子(あたらし なおこ)
- 大阪大学大学院 医学系研究科・医学部 感染症・免疫学講座
- 教授 茂呂 和世(もろ かずよ)
(理化学研究所 生命医科学研究センター 自然免疫システム研究チーム
チームリーダー) - 准教授 本村 泰隆(もとむら やすたか)
- 大阪大学 微生物病研究所 感染微生物分野
- 准教授 三室 仁美(みむろ ひとみ)
- 特任研究員 木下 僚(きのした りょう)
- 特任研究員(当時) 黒田 英介(くろだ えいすけ)
- 仏国 パスツール研究所 免疫学部門 自然免疫ユニット
(Innate Immunity Unit, Department of Immunology, Institut Pasteur) - ラボヘッド ジェームス・ディサント(James P. Di Santo)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費助成事業研究活動スタート支援「胃におけるILCsの局在とその役割解明に関する研究(研究代表者:佐藤尚子)、同科学研究費補助金基盤研究(B)「抗原取り込みに特化した特殊腸管上皮M細胞の分化と機能(研究代表者:大野博司)」、同基盤研究(B)「ナチュラルヘルパー細胞の分化機構解明(研究代表者:茂呂和世)、同挑戦的研究(萌芽)「 細菌外膜小胞への選択的物質導入機構の解明(研究代表者:三室仁美)」、日本医療研究開発機構 革新的先端研究開発支援事業(AMED-CREST)「疾患における代謝産物の解析および代謝制御に基づく革新的医療基盤技術の創出」研究開発領域(研究開発総括:清水 孝雄)研究開発課題名「オミクス解析に基づくアレルギー発症機構の理解と制御基盤の構築」(研究開発代表者:大野博司)、武田科学振興財団(佐藤尚子)、持田記念医学薬学振興財団(佐藤尚子)および内藤記念科学振興財団(三室仁美)による支援を受けて行われました。
背景
これまで、胃は主に食物を消化・殺菌する臓器であり、小腸や大腸と比べて免疫学的な寄与は低いと考えられてきました。また、胃は殺菌のために強酸性に保たれていることから、共生細菌はほとんど存在しないと考えられていましたが、近年、数は腸管と比べて少ないものの、ヒト、マウスともに共生細菌が存在することが明らかになっています注1-2)。
ヒトではピロリ菌(ヘリコバクター・ピロリ)に感染すると、潰瘍やがんが誘導されることが知られており、実際に、胃の不調を感じた際にはピロリ菌感染を疑い除菌を行います。しかし、ピロリ菌保有者であっても症状がない時期もあり、どのような免疫応答が感染防御に関与しているかはあまり分かっていません。特に、近年その多様な機能で注目されている自然リンパ球(ILCs)については、胃における役割に関してこれまで報告されていませんでした。
注1)Tlaskalova-Hogenova H. et al. Cell mol Immunol. 2011 (PMID:21278760)
注2)Dicksved J. et al. J Med Microbiol. 2009 (PMID:19273648)
研究手法と成果
国際共同研究グループはまず、マウスの胃に存在する自然リンパ球をフローサイトメトリー[4]を用いて解析しました。その結果、炎症に関与する1型自然リンパ球(ILC1)は小腸に比べて少なく、感染防御に関与する3型自然リンパ球(ILC3)はほとんど存在しない一方、ほとんどが2型自然リンパ球(ILC2)で占められていることが分かりました。
また、ILC2は腸や肺では細菌叢の影響を受けないと考えられていましたが、無菌マウスの胃では、SPFマウス[5](特定の病原性微生物などが存在せず、一般的な共生細菌による細菌叢を持つ)の胃と比較してILC2数が減少していることが判明しました。この結果と細菌叢解析[6]により、マウスの胃では、共生細菌であるS24-7科[7]の菌数がILC2数の増加と相関することが分かりました。これらのことは、胃に存在するILC2は他の臓器とは異なり、共生細菌の影響を受けることを示しています。さらに、マウスの胃では、共生細菌により分泌型の免疫グロブリンA(IgA)産生が誘導され、防御的に機能していることを示唆する結果も得られました(表1)。

表1:小腸と胃のILC2の比較
次に、強い病原性を示すピロリ菌とILC2との関係性を調べるために、無菌マウスにピロリ菌を感染させ、胃における免疫応答を解析したところ、B細胞[8]の増加が見られました。このB細胞は、ピロリ菌に特異的なIgAを多く産生し、ILC2から産生されるインターロイキン-5(IL-5)[9]により分化誘導されることも明らかになり、ILC2が胃の防御の要であることが示されました(図1)。
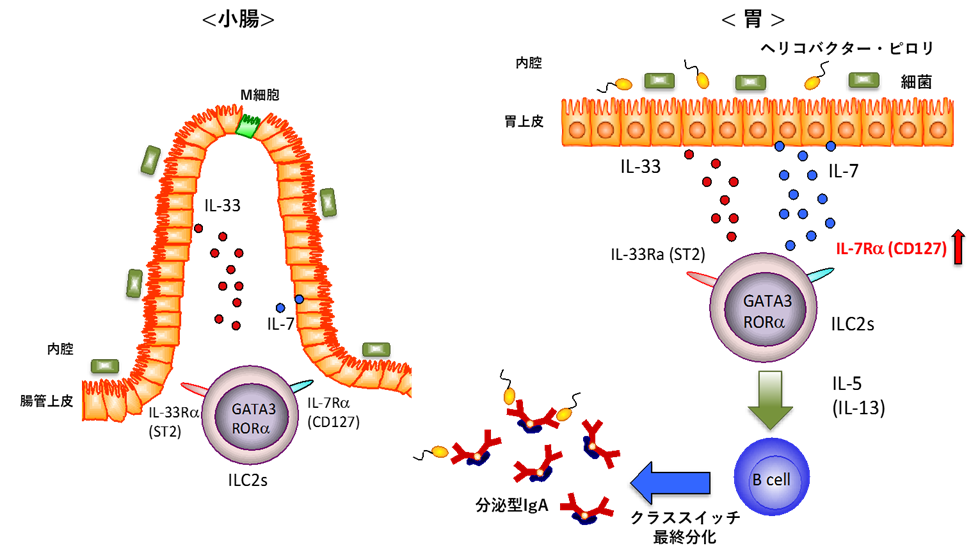 図1:ILC2を介してIgAを誘導するメカニズム小腸では、寄生虫感染などによりIL-33が産生されるが、共生細菌の影響は受けないとされている。胃では、共生細菌やピロリ感染によりIL-7とIL-33が多く産生されることでILC2が活性化し、IL-5の産生が誘導される。その結果、B細胞が分化誘導され、分泌型のIgAを産生する。
図1:ILC2を介してIgAを誘導するメカニズム小腸では、寄生虫感染などによりIL-33が産生されるが、共生細菌の影響は受けないとされている。胃では、共生細菌やピロリ感染によりIL-7とIL-33が多く産生されることでILC2が活性化し、IL-5の産生が誘導される。その結果、B細胞が分化誘導され、分泌型のIgAを産生する。
今後の期待
本研究により、胃に存在するILC2は、ピロリ感染時だけでなく共生細菌の一種であるS24-7科の菌によっても誘導されることが明らかになりました。本成果は、胃の免疫学的な重要性を示したものであり、胃が持つ重要な防御機能についても指摘しています。今後は、ILC2を誘導する特定の菌を同定することで、ピロリ菌感染の排除に働くような防御機構を誘導できると考えられます。
将来的には、ILC2を誘導するS24-7科の菌を含ませたヨーグルトなどの食品を日常的に摂取することにより、あらかじめ胃の免疫応答を惹起し、感染に対する防御機能を高めることができる可能性があります。
論文情報
- タイトル
- Bacteria-induced group 2 innate lymphoid cells in the stomach provide immune protection through induction of IgA
- 著者名
- Naoko Satoh-Takayama, Tamotsu Kato, Yasutaka Motomura, Tomoko Kageyama, Naoko Taguchi-Atarashi, Ryo Kinoshita-Daitoku, Eisuke Kuroda, James P. Di Santo, Hitomi Mimuro, Kazuyo Moro and Hiroshi Ohno
- 雑誌
- Immunity
- DOI
- 10.1016/j.immuni.2020.03.002
補足説明
- [1]ヘリコバクター・ピロリ
- 胃に生息するらせん状のグラム陰性微好気生菌。ウレアーゼを産生し胃酸を中和することで胃に定着している。また、ピロリ菌感染は慢性胃炎、胃炎、十二指腸潰瘍のみならず、胃ガンやMALTリンパ腫の原因になることが知られている。
- [2]自然リンパ球(ILCs)
- 自然リンパ球はリンパ球系に属する免疫細胞であり、ヘルパーT細胞と機能的に類似している。1型(ILC1)から3型(ILC3)までの大きく分けて3種のサブセットが存在し、それぞれ役割が異なる。2型自然リンパ球(ILC2)はIL-5やIL-13などのような2型のサイトカインを産生し、近年はアレルギーの発症に関与するほか、寄生虫感染からの防御にも重要な役割を果たしていることが知られている。また、肥満との関連性や組織の線維化との関与も報告されており、その役割は多岐にわたる。ILCはInnate lymphoid cellの略。
- [3]免疫グロブリンA (IgA)
- 抗体と呼ばれる免液グロブリンの一種。IgM、IgD、IgG、IgE、IgAの五つのサブクラスに分類される。腸管を含む粘膜の表面上にはIgAが分泌され、体内で最も多量に産生される抗体である。
- [4]フローサイトメトリー
- 蛍光標識された抗体で細胞を染色し、レーザー光を当てることにより1細胞ごとに蛍光の強さを電気信号に置き換えて定量化する機械。細胞一つずつに発現する抗原を解析することで、細胞種の特定ができる。
- [5]SPFマウス
- 特定の病原性微生物や寄生虫が存在しないマウス。SPFはSpecific Pathogen Freeの略。
- [6]細菌叢解析
- 細菌が特異的に持つ16S rRNAの遺伝子を次世代シークエンサーで配列を読み解析することにより、菌叢を構成する菌種・分布などについて評価する解析法。
- [7]S24-7科
- バクテロイデス目に属し哺乳類の腸内細菌叢として豊富に存在しているが、難培養性として知られている。近年は細菌叢解析により、さまざまなヒト疾患で特異的に増減していることが報告され、疾患との関与も示唆されている。
- [8]B細胞
- 骨髄で分化・成熟するリンパ球であり、抗体産生を担う。
- [9]インターロイキン-5(IL-5)
- サイトカインの一種であり、好酸球の分化やIgAの産生を促進する因子として知られている。
発表者・機関窓口
発表者
理化学研究所 生命医科学研究センター 粘膜システム研究チーム
チームリーダー 大野 博司(おおの ひろし)
専任研究員 佐藤 尚子(さとう なおこ)
機関窓口
理化学研究所 広報室 報道担当
AMED事業に関すること
日本医療研究開発機構(AMED)
シーズ開発・研究基盤事業部 革新的先端研究開発課