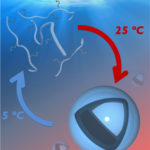
肝類洞における遺伝子治療薬クリアランスの制御
2020-06-29 量子科学技術研究開発機構
- 遺伝子治療薬の機能、安全性を向上させる新たな技術を開発。
- 肝類洞壁の一過的かつ選択的で安全なコーティングを実現。その結果、遺伝子治療薬のクリアランスを制御することに成功。
- 心筋、骨格筋、がん細胞への遺伝子導入効率が上がることを実証。
- Science Advances (Impact Factor=12.804)に論文掲載
公益財団法人川崎市産業振興財団 ナノ医療イノベーションセンター(センター長:片岡一則、所在地:川崎市川崎区、略称:iCONM)は、国立研究開発法人量子科学技術研究開発機構(理事長:平野俊夫、所在地:千葉県千葉市、略称:QST)の長田健介博士および東京大学大学院工学系研究科バイオエンジニアリング専攻の内田智士博士との共同研究により、世界で初めて、肝類洞壁(注1)の表面を選択的かつ一過性に覆う物質を開発し、遺伝子治療薬のクリアランス(注2)を制御することに成功しました。本研究内容は、アメリカ科学振興協会 (AAAS) が発行する Science Advances誌(注3)に米国東海岸時6月26日午後2時(日本時間:27日午前4時)に掲載される予定です(注4)。
近年、欧米及び日本において、遺伝子治療が次々と認可され、がん、慢性疾患、遺伝病への応用が期待されています。一方で、生体に投与した遺伝子治療薬は、速やかに肝臓にて代謝され消失してしまうため、十分量が標的臓器へ到達しないことが課題となっております。この肝臓からの消失は、肝内毛細血管である肝類洞の血管壁への遺伝子治療薬の吸着が原因となるため、肝類洞壁を生体適合性高分子であるポリエチレングリコール(PEG)でコーティングすることを着想しました。ここで、長時間コーティングすると肝臓の生理的機能が損なわれる懸念があり、コーティングは一過的である必要があります。また、全身の血管がコーティングされると副作用の原因となるだけでなく、標的臓器への遺伝子治療薬の送達が障害されてしまうため、コーティングは肝類洞に選択性を持つ必要があります。我々は、今回、肝類洞壁に吸着する正に帯電したオリゴリシン(注5)に、2本のPEG鎖を結合したコーティング剤を開発することで、一過的かつ選択的な肝類洞壁のコーティングに世界で初めて成功しました。興味深いことに、この2本PEG鎖からなるコーティング剤は、類洞内皮に結合した後、6時間以内に胆汁へと排泄された一方で、1本のPEG鎖をオリゴリシンに結合したコーティング剤は、類洞壁に長時間留まってしまいました。このように、一過的なコーティングを実現するためには、精密分子設計が必要でした。
続いて、このコーティング剤を、遺伝子治療薬の送達に用いました。アデノ随伴ウイルス(AAV)は、ウイルス性遺伝子治療薬として汎用されておりますが、その8型(AAV8)は、心筋、骨格筋を標的としています。予め肝類洞壁をコーティングしたのちにAAV8を投与すると、AAV8の肝臓への移行が抑制され、結果的に、心筋、骨格筋への遺伝子導入効率が、2〜4倍向上しました。今後、筋ジストロフィー治療等への応用が期待されます。また、ウイルスを用いない遺伝子治療も安全性や経済的コストの観点から期待されており、我々は10年以上にわたりプラスミドDNA搭載スマートナノマシンâ(注6)を用いた悪性腫瘍の遺伝子治療に取り組んでまいりました(注7)。そこで、このシステムにコーティング剤を用いたところ、ナノマシンの肝類洞壁への吸着が抑制され、結果的に大腸がんへのDNA導入効率が10倍程度向上しました。以上のように、今回開発したコーティング剤を用いることで、安全性を担保しながら、遺伝子治療薬の活性を飛躍的に高めることに成功しました。
以上の知見を、考察としてまとめると以下の様になります。
- 2本のPEG鎖からなるコーティング剤は、肝類洞壁を数時間コーティングし、その後、胆汁排泄された。
- 1本のPEG鎖からなるものは、胆汁排泄されず、9時間以上にわたって肝類洞壁をコーティングしたため、安全面での懸念がある。
- 2本鎖PEGコーティング剤は、肝類洞壁に選択性を持ち、結合組織の血管はコーティングしなかった。
- コーティング剤は、アデノ随伴ウイルスベクターを用いた心筋、骨格筋への遺伝子導入効率を2〜4倍、DNA搭載スマートナノマシンを用いた大腸がんへの遺伝子導入効率を10倍向上させた。
- 結果的に、遺伝子治療薬の効果が高まるだけでなく、投与量を減らすことが可能となり、医療費の削減および有害事象の低減に結びつくことが期待できる。
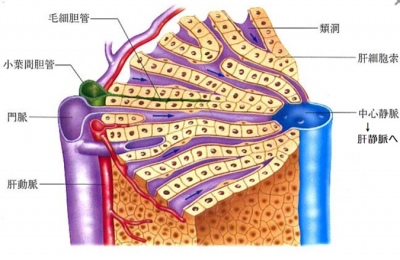
(注1)肝類洞壁 (Liver Sinusoidal Wall):
肝臓は肝小葉とよばれる直径 1mmほどの構成単位が集合した臓器である。肝小葉の外側には2種類の動脈(門脈と肝動脈)の終末部が開口し、両者の血液は合流して「類洞」と呼ばれる網目状の毛細血管を通り、肝小葉中心にある中心静脈に流れる。類洞を取り囲むように肝細胞が配列し血液との間で様々な物質交換が行われる。肝排泄性の有害物質(薬物も含む)や老廃物は肝細胞から胆管に廃棄され胆液として消化管内に排出される。類洞と肝細胞の間には類洞内皮細胞があり、類洞壁を形成する。類洞壁は、遺伝子治療薬等のナノ医薬品のクリアランスに中心的な役割を果たしており、その機構を抑制し、ナノ医薬品の効果を高めるための技術が求められている。
(注2)
クリアランス:特定の化合物が臓器や組織から消失すること。
(注3)
Science Advances誌:世界で最も歴史があり、262の科学関連学術団体を通じ、最新かつ価値の高い科学情報の普及に努める非営利学術団体「アメリカ科学振興協会 (AAAS)」の発行誌。学術誌の影響力を示すインパクトファクター (2018-2019) は12.804 を誇り、世界で最も権威のある科学誌のひとつ。
(注4)
A. Dirisala, S. Uchida, K. Toh, J. Li, S. Osawa, T. A. Tockary, X. Liu, S. Abbasi, K. Hayashi, Y. Mochida, S. Fukushima, H. Kinoh, K. Osada, Kazunori Kataoka, ”Transient stealth coating of liver sinusoidal wall by anchoring two-armed PEG for retargeting nanomedicines” Science Advances
(注5)
オリゴリシン:必須アミノ酸のひとつリシンが連なったオリゴペプチド。塩基性アミノ酸のポリマーであるため、正電荷に帯電する。
(注6)
スマートナノマシンâ:様々な機能性分子を持つ両親媒性ポリマーを水中で会合させることにより形成される数十nmの大きさを持つ球状または棒状の分子集合体(ナノミセル)。1nmは、10億分の1メートル。人の身長を地球の直径に例えると、細胞一つの大きさは東京ドーム、スマートナノマシンâの大きさはサッカーボールのサイズとなる。
H. Cabral, K. Miyata, K. Osada, K. Kataoka, “Block copolymer micelles in nanomedicine applications” Chem. Rev.118 (14) 6844-6892 (2018) (DOI: 10.1021/acs.chemrev.8b00199)
(注7)
二重鎖DNAを用いたがん治療:Oba, M.; Vachutinsky, Y.; Miyata, K.; Kano, M. R.; Ikeda, S.; Nishiyama, N.; Itaka, K.; Miyazono, K.; Koyama, H.; Kataoka, K., Antiangiogenic gene therapy of solid tumor by systemic injection of polyplex micelles loading plasmid DNA encoding soluble flt-1. Mol. Pharm. 2010, 7 (2), 501-9.
一重鎖DNAを用いたがん治療:Tockary, T. A.; Foo, W.; Dirisala, A.; Chen, Q.; Uchida, S.; Osawa, S.; Mochida, Y.; Liu, X.; Kinoh, H.; Cabral, H.; Osada, K.; Kataoka, K., Single-Stranded DNA-Packaged Polyplex Micelle as Adeno-Associated-Virus-Inspired Compact Vector to Systemically Target Stroma-Rich Pancreatic Cancer. ACS Nano 2019, 13 (11), 12732-12742.
mRNAを用いたがん治療:Uchida, S.; Kinoh, H.; Ishii, T.; Matsui, A.; Tockary, T. A.; Takeda, K. M.; Uchida, H.; Osada, K.; Itaka, K.; Kataoka, K., Systemic delivery of messenger RNA for the treatment of pancreatic cancer using polyplex nanomicelles with a cholesterol moiety. Biomaterials 2016, 82, 221-228.