がん免疫細胞療法、再生医療、創薬、バイオ燃料開発、スマートセル産業を加速
2020-07-10 東京大学
合田 圭介(化学専攻 教授/カリフォルニア大学ロサンゼルス校工学部バイオエンジニアリング学科 非常勤教授/武漢大学工業科学研究院 非常勤教授)
新田 尚(化学専攻 客員研究員(研究当時)/株式会社CYBO代表取締役)
発表のポイント
- 生物学や医学の研究において、細胞集団内の細胞1つ1つを画像で解析して所望の細胞を分取する技術が活用され始めていますが、細胞に害をもたらしたり本来の機能に干渉しうる蛍光標識による情報に大きく依存しています。
- 本研究では、蛍光標識を用いずに、生きた細胞1つ1つの細胞内分子の分子振動画像を、1秒間に最大100細胞の速度で取得・解析・識別し、その結果に応じて所望の細胞を分取する基盤技術「ラマン画像活性細胞選抜法(Raman image-activated cell sorting, RIACS)」を世界で初めて実証しました。
- 多種多様な細胞に適用可能な本技術は、生物学や医学などの基礎科学における新たな発見、がん免疫細胞療法や再生医療における細胞品質評価、創薬における細胞に対する薬効評価、バイオ燃料開発やスマートセル産業における物質生産効率の高い微生物のスクリーニングなど、さまざまな応用展開が期待されます。
発表概要
東京大学大学院理学系研究科・合田圭介教授が率いる研究グループは、細胞内生体分子を光学的に高速検出する誘導ラマン散乱(stimulated Raman scattering, SRS)顕微法(注1)で撮像し、画像解析で細胞を高速識別して、その解析結果に応じて所望の細胞を分取する、世界初の「ラマン画像活性細胞選抜法(Raman image-activated cell sorting, RIACS)」を開発しました。本技術により、蛍光標識を用いないありのままの姿の生きた細胞1つ1つを、1秒間に最大100細胞の速度で解析して識別、分取することに成功しました。さらに、動物細胞や微生物を、その細胞内部の生体分子の分布を指標として、分取する原理実証を行い、本技術の有用性や汎用性を確認しました。本研究成果により、蛍光標識では分取が困難であった細胞に対して、1つ1つの細胞に含まれる生体分子の無標識画像を用いた分取により、細胞の選抜が可能となります。このことから、生物学や医学などの基礎科学における新たな発見、がん免疫細胞療法や再生医療における細胞品質評価、創薬における細胞に対する薬効評価、バイオ燃料開発やスマートセル(注2)産業における物質生産効率の高い微生物のスクリーニングなど、さまざまな応用展開が期待されます(図1)。
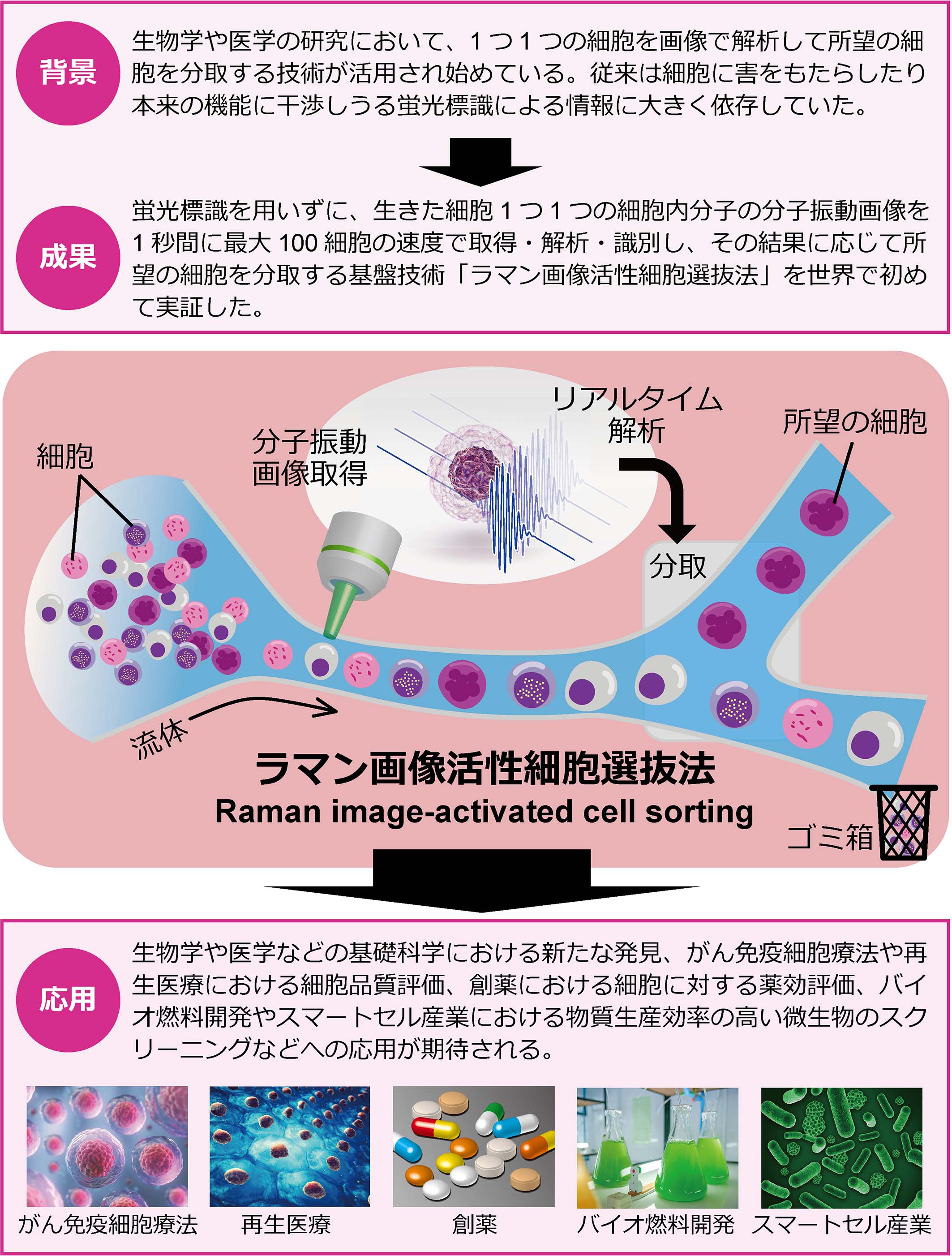
図1:本研究成果により、これまでの蛍光標識による分取が困難であった細胞に対して、1つ1つの細胞に含まれる生体分子の無標識画像を用いた分取により、細胞の選抜が可能となります。本技術を用いて、生物学や医学などの基礎科学における新たな発見、がん免疫細胞療法や再生医療における細胞品質評価、創薬における薬効評価、バイオ燃料開発やスマートセル産業における物質生産効率の高い微生物のスクリーニングなど、さまざまな応用展開が期待されます。
本研究は、内閣府総合科学技術・イノベーション会議が主導する革新的研究開発推進プログラム(ImPACT)、神奈川県立産業技術総合研究所、日本学術振興会(JSPS)の研究拠点形成事業、同科学研究費助成事業、ホワイトロック財団、精密測定技術振興財団の支援を受けて実施されました。
本研究成果は、2020年7月10日(午後6時)にNature Communicationsのオンライン版で公開されました。
発表内容
研究の背景と経緯
多種多様な細胞の組成や構造、形態などと生理機能の関係を調べることは、生物学における主題の1つです。こうした細胞ごとの振る舞いの違いは、均一であるはずの細胞群からも観察されることから生命現象の理解を困難にしており、医療やバイオ産業の発展の妨げになっています。しかしながら従来の技術では、個々の細胞から得られる情報量と、解析可能な細胞数がトレードオフの関係となっており、多様な細胞を網羅的に研究するうえでの限界となっていました。ImPACTプログラム「セレンディピティの計画的創出」では合田プログラムマネージャー(研究当時)が中心となり、この限界を突破するべく研究開発を進めました。
本研究グループでは、これまでに世界初のインテリジェント画像活性細胞選抜法(注3)の実証に成功しており、細胞の内部分子構造や形態などのさまざまな空間情報に基づいた高速細胞分取を実現していました。これにより、生物学や医学の研究で1つ1つの細胞を解析して所望の細胞を分取する画像活性セルソーティングが活用され始めています。しかしながらこれまで実証されていた撮像法では、蛍光標識による情報に大きく依存していました。この方法では、蛍光標識自体が細胞に害をもたらし、本来の機能を阻害することがあります。また、蛍光標識は細胞膜を透過することが難しいため、細胞内の分子を標識することが簡単ではありません。細胞内を標識できる蛍光タンパク質を用いるには、遺伝子導入が必要であるため、利用できる蛍光タンパク質の種類が特定のものに限られる、などの制限がありました。
研究の内容
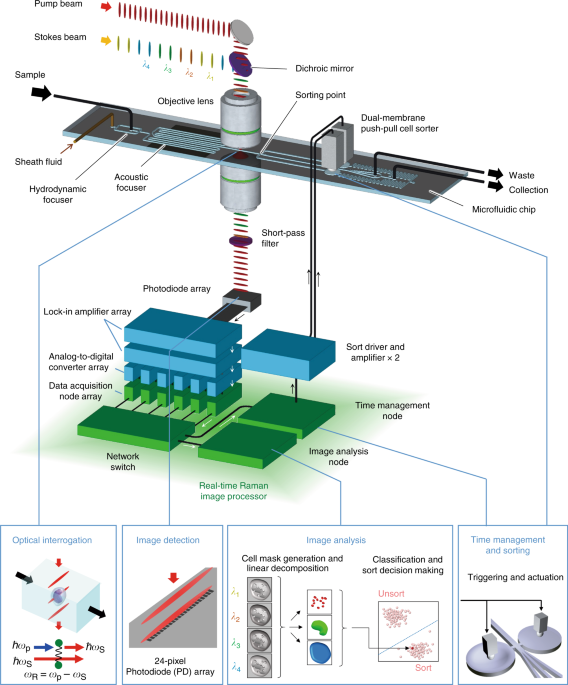
本研究では、光学や電気工学、情報科学、機械工学、生物学、医学など多分野にまたがる研究者を結集して、細胞内生体分子の分子振動数を光学的に高感度検出する誘導ラマン散乱(stimulated Raman scattering, SRS)顕微法で撮像し、画像解析で細胞を高速識別して、その解析結果に応じて所望の細胞を分取する、世界初のラマン画像活性細胞選抜法(Raman image-activated cell sorting, RIACS)の基盤技術を開発しました(図2)。
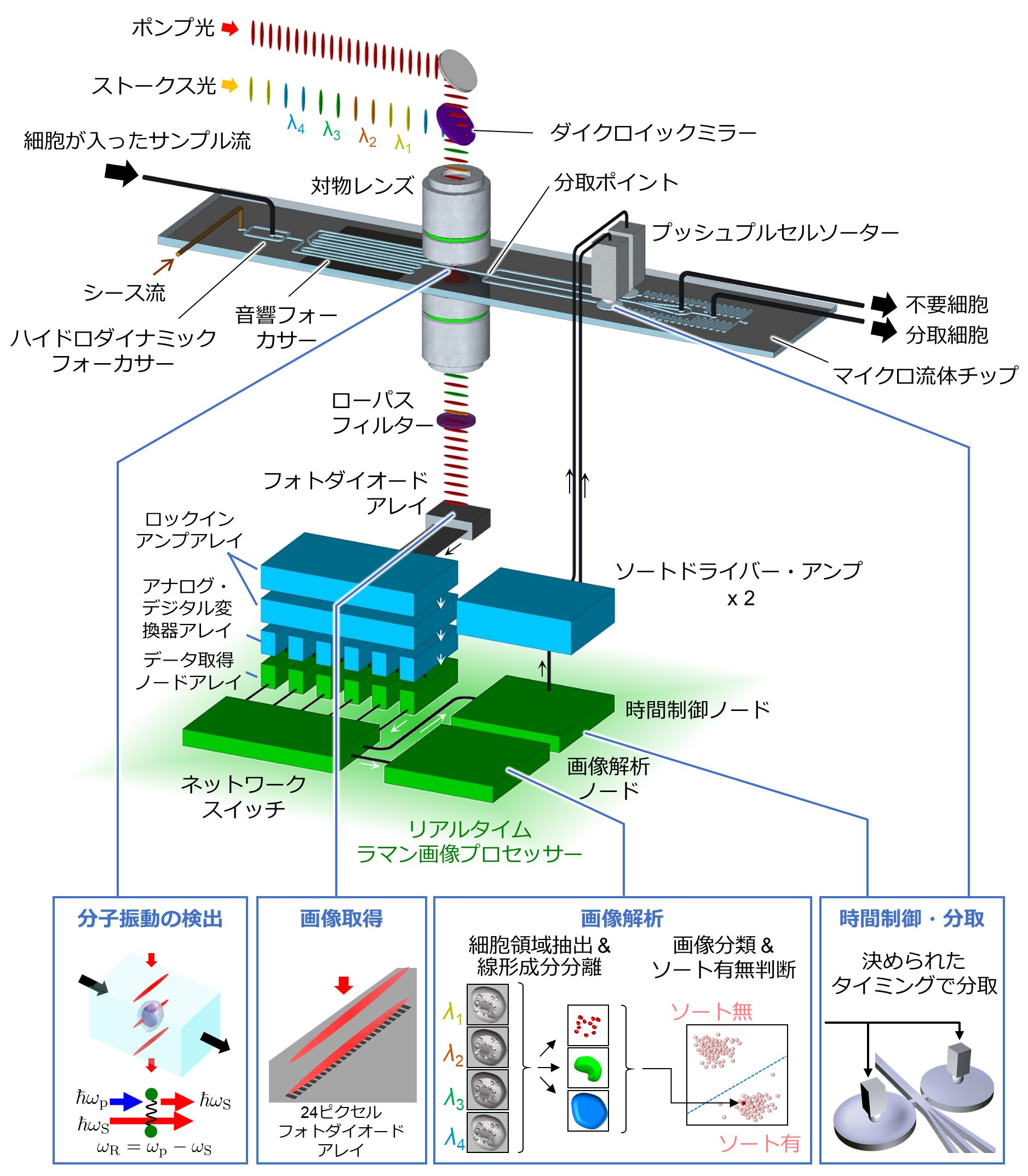
図2:本研究で開発した「ラマン画像活性細胞選抜法(RIACS)」の概略
ラマン画像活性細胞選抜装置に注入された細胞は、フォーカサーによって流れの中心に整列され、SRS顕微鏡でラマン撮像により画像化されます。画像は、リアルタイムラマン画像プロセッサーで解析され、ソートの有無がリアルタイムで判断されます。必要な細胞はプッシュプルセルソーターで分取されます。
本技術は、SRS顕微イメージング技術、10ギガビットイーサーネット(注4)による高速データ処理システム、マイクロ流体技術(注5)を活用した高速分取技術や細胞制御技術など、異分野融合での大規模な共同研究によって達成されました(図3)。

図3:ラマン画像活性細胞選抜装置の主要部分の写真
a) チタン・サファイヤレーザーとイッテルビウムファイバーレーザー
b) 4色バンドパスフィルター
c) ポンプ光源と高出力フォトニック結晶ファイバー増幅器で構成される高出力増幅器
d) マイクロ流体チップと、接続された測定サンプル、シース流チューブ、光学系
e) 24チャネルフォトダイオードアレイ回路
f) ロックインアンプアレイ、アナログ・デジタル変換器アレイ、データ取得ノードアレイ
技術の汎用性を示す実験として、3マイクロメートルから20マイクロメートル程度の異なるサイズのさまざまな細胞のラマン撮像の例を示しました(図4)。
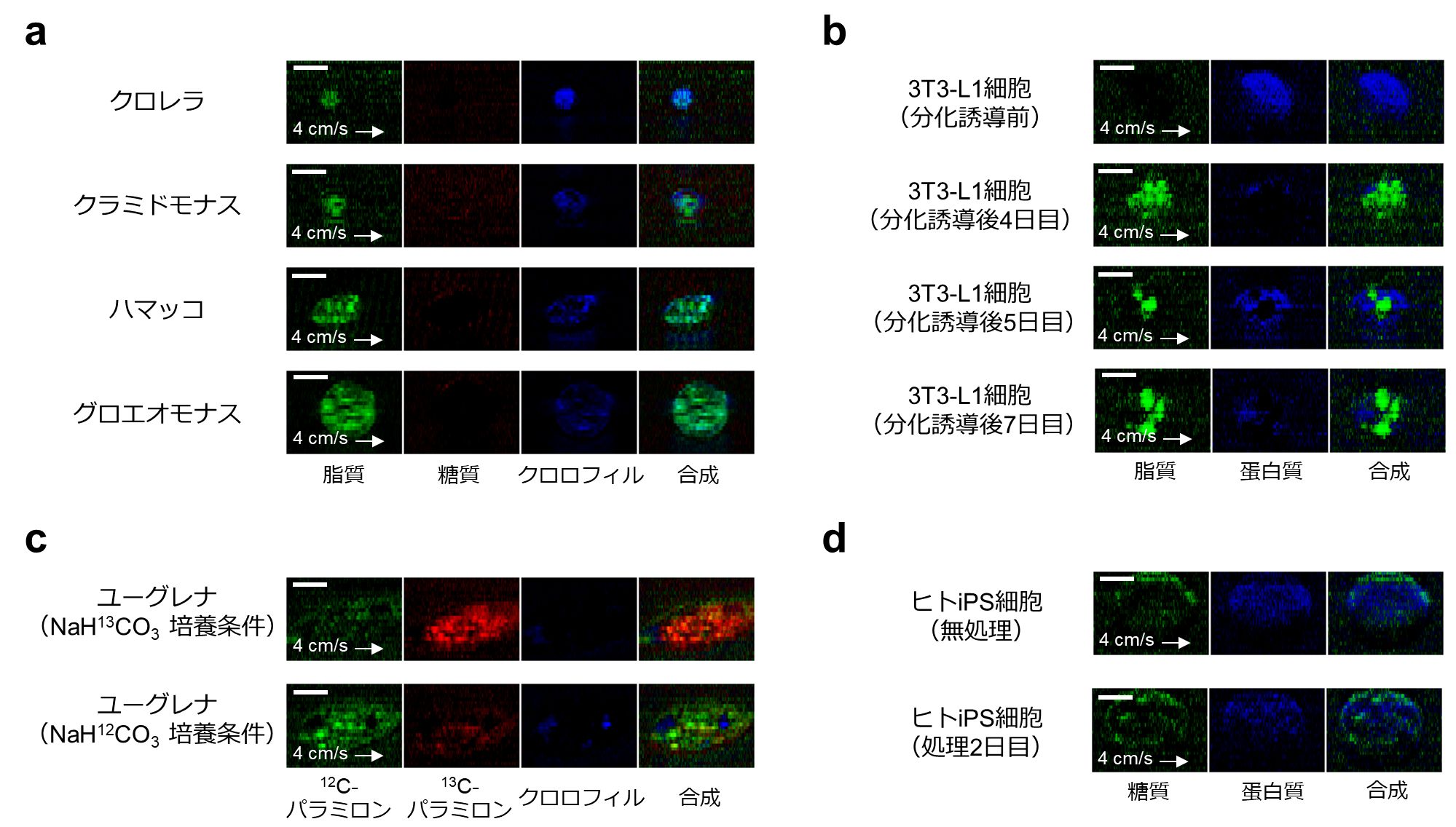
図4:本技術の汎用性実証のための撮像例
a) 細胞の大きさが3マイクロメートルから20マイクロメートルまでの大きさのさまざまな微生物のラマン画像。
b) 3T3-L1細胞のラマン画像。脂肪細胞への分化誘導により、細胞内に徐々に油脂を蓄積した様子を示す。
c) 炭素同位体による2種類の異なるラマンプローブを導入したユーグレナのラマン画像。
d) ヒトiPS細胞のラマン画像。プライム型多能性幹細胞用培地で培養した細胞(無処理)とナイーブ型多能性幹細胞用培地で培養後2日目の細胞を示す。
スケールバーはいずれも10マイクロメートル。
さらに本技術の実用的な展開として、動物細胞や微生物を、その細胞内部の生体分子の分布を指標として分取する原理実証を行い、本技術の有用性や汎用性を確認しました(図5)。
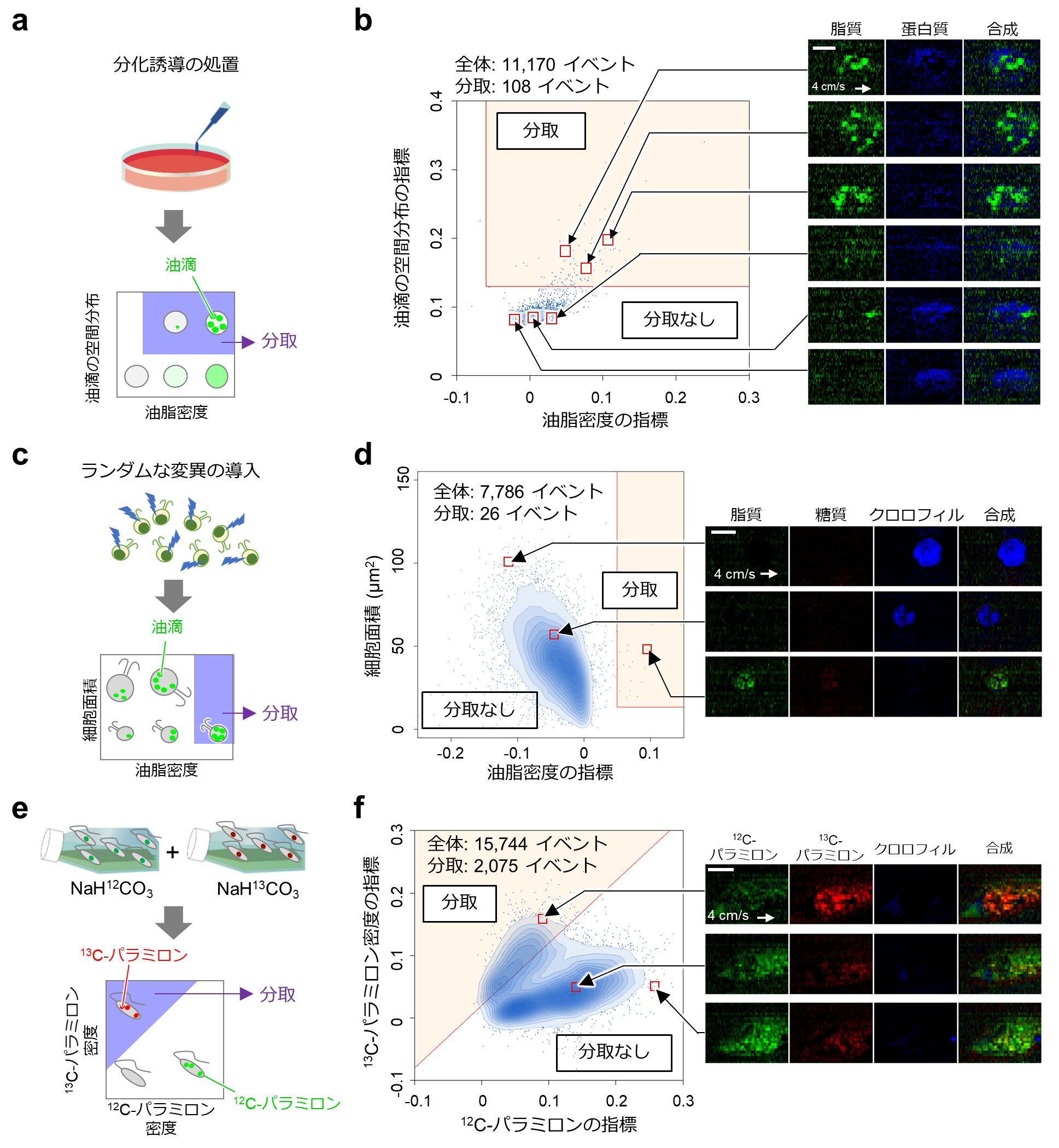
図5:RIACSを用いた各種細胞のラマン画像活性細胞選抜の結果
a) 3T3-L1由来脂肪細胞様細胞を分取する実験手順。
b) 脂肪細胞様細胞の分取結果。油脂分布の偏りが大きく油滴形成が認められる細胞をRIACSで分取した。
c) 緑藻類クラミドモナスにランダムな変異を導入し、油滴を多く蓄積している細胞を選抜する分取手順。
d) 細胞面積と脂質密度におけるクラミドモナス変異体細胞の散布図。この中から全体の0.3%の脂質密度が高いが稀なクラミドモナス変異体(黄色の領域)をRIACSで選抜した。
e) 2種類の異なる炭素同位体を導入した緑藻類ユーグレナを分取するための手順。
f) NaH12CO3およびNaH13CO3で培養したユーグレナを1:1で混合し、細胞面積あたりの炭素同位体12Cおよび13Cを含むパラミロン(ユーグレナが持つ多糖類)の強度でプロットした散布図。この中からNaH13CO3で培養したユーグレナ(黄色の領域)をRIACSで選別した。
いずれもスケールバーは10マイクロメートル。
原理実証では、医学的な応用展開に向け脂肪細胞を用いた分取実験、光合成やバイオ燃料の研究に使われる緑藻類クラミドモナスを用いた分取実験、物質生産効率の高い微生物のスクリーニングへの応用展開に向け緑藻類ユーグレナを用いた分取実験を行いました。分取実験で用いた細胞には、識別するための蛍光標識も付加することで、蛍光顕微鏡により分取結果を検証し、RIACSで正しく分取されていることを確認しました。これらの分取実験による実証結果は、細胞集団から代謝活性の高い細胞を選別し、その遺伝子や代謝経路を調べることが可能であることを示しています。ユーグレナの分取実験の例では、この細胞選別を従来のラマン顕微鏡とピペット操作による手作業で行った場合、3日以上の時間が必要となります。これに対して、本研究における分取実験は6分以内に完了しており、従来と比較すると約900倍高速に細胞選別を行うことが可能となったといえます。
今後の展開
本研究成果により、これまでの蛍光標識による分取が困難であった細胞に対して、1つ1つの細胞に含まれる生体分子の無標識画像を用いた分取により、細胞の高速選抜が可能となります。このことから、多種多様な細胞に適用可能な本技術は、生物学や医学などの基礎科学における新たな発見、がん免疫細胞療法や再生医療における細胞品質評価、創薬における細胞に対する薬効評価、バイオ燃料開発やスマートセル産業における物質生産効率の高い微生物のスクリーニングなど、さまざまな応用展開が期待されます(図1)。
本研究チームは、新田尚(研究当時:東京大学大学院理学系研究科化学専攻客員研究員/研究当時:ImPACTプログラムマネージャー補佐/株式会社CYBO代表取締役)、飯野敬矩(研究当時:東京大学大学院工学系研究科主任研究員)、磯崎瑛宏(東京大学大学院理学系研究科化学専攻特任助教/神奈川県立産業技術総合研究所常勤研究員)、山岸舞(研究当時:東京大学大学院理学系研究科生物科学専攻客員共同研究員)、 北濱康孝(研究当時:東京大学大学院理学系研究科化学専攻特任研究員)、佐久間臣耶(研究当時:名古屋大学大学院工学研究科助教/九州大学工学研究院准教授)、鈴木祐太(研究当時:東京大学大学院工学系研究科特別研究員)、手塚宏史(東京大学大学院情報理工学系研究科特任研究員)、老川稔(高知大学理工学部准教授)、新井史人(研究当時:名古屋大学大学院工学研究科教授/東京大学大学院工学系研究科教授)、浅井卓也(研究当時:東京大学大学院工学系研究科修士課程学生)、Dinghuan Deng(研究当時:東京大学大学院工学系研究科特任研究員)、福澤秀哉(京都大学大学院生命科学研究科教授)、長谷美佐(東京大学大学院理学系研究科化学専攻技術補佐員)、蓮沼誠久(神戸大学先端バイオ工学研究センター長/神戸大学大学院科学技術イノベーション研究科教授)、早川健(中央大学理工学部准教授)、平木敬(研究当時:東京大学大学院理学系研究科化学専攻特任研究員/東京大学大学院情報理工学研究科名誉教授)、平松光太郎(東京大学大学院理学系研究科化学専攻助教)、星野友(九州大学大学院工学研究院准教授)、稲葉真理(東京大学大学院情報理工学系研究科准教授)、井上友貴(研究当時:東京大学大学院工学系研究科修士課程学生)、伊藤卓朗(研究当時:東京大学大学院理学系研究科化学専攻客員研究員/研究当時:ImPACTプログラムマネージャー補佐)、梶川昌孝(京都大学大学院生命科学研究科助教)、唐川博(研究当時:東京大学大学院理学系研究科化学専攻特任研究員)、笠井宥佑(研究当時:名古屋大学大学院工学研究科博士課程学生)、加藤悠一(神戸大学大学院科学技術イノベーション研究科特命助教)、小林博文(研究当時:東京大学大学院理学系研究科化学専攻博士課程学生)、雷誠(東京大学大学院理学系研究科化学専攻客員研究員/武漢大学工業科学研究院教授)、松阪諭(筑波大学医学医療系教授)、三上秀治(研究当時:東京大学大学院理学系研究科化学専攻助教/北海道大学電子科学研究所教授)、中川敦寛(東北大学病院臨床試験推進センター特任教授)、沼田圭司(理化学研究所環境資源科学研究センターチームリーダー)、太田忠孝(東京大学大学院理学系研究科化学専攻技術補佐員)、関谷武一郎(研究当時:東京大学大学院工学系研究科技術補佐員)、 芝清隆(がん研究所蛋白創製研究部部長)、白崎善隆(研究当時:東京大学大学院理学系研究科生物科学専攻特任助教)、鈴木信勇(研究当時:東京大学大学院理学系研究科研究補助員)、田中駿士(研究当時:東京大学大学院工学系研究科修士課程学生)、上野俊之介(東京大学大学院理学系研究科化学専攻博士課程学生)、渡会浩志(研究当時:東京大学医科学研究所特任准教授/金沢大学医薬保健研究域医学系教授)、山野隆志(京都大学大学院生命科学研究科講師)、矢澤真幸(コロンビア大学メディカルセンターリハビリテーション・再生医療学科アシスタントプロフェッサー)、与那嶺雄介(北海道大学大学院生命科学院助教)、Dino Di Carlo(カリフォルニア大学ロサンゼルス校工学部バイオエンジニアリング学科教授/東京大学大学院理学系研究科化学専攻客員教授)、 細川陽一郎(奈良先端科学技術大学院大学先端科学技術研究科教授)、上村想太郎(東京大学大学院理学系研究科生物科学専攻教授)、杉村武昭(研究当時:東京大学大学院理学系研究科化学専攻客員研究員/研究当時:ImPACTプログラムマネージャー補佐/株式会社CYBO開発部長)、小関泰之(東京大学大学院工学系研究科准教授)、 合田圭介(東京大学大学院理学系研究科化学専攻教授/カリフォルニア大学ロサンゼルス校工学部バイオエンジニアリング学科非常勤教授/武漢大学工業科学研究院非常勤教授/研究当時:ImPACTプログラムマネージャー)で構成されています。
発表雑誌
- 雑誌名
Nature Communications論文タイトル
Raman image-activated cell sorting著者
Nao Nitta, Takanori Iino, Akihiro Isozaki, Mai Yamagishi, Yasutaka Kitahama, Shinya Sakuma, Yuta Suzuki, Hiroshi Tezuka, Minoru Oikawa, Fumihito Arai, Takuya Asai, Dinghuan Deng, Hideya Fukuzawa, Misa Hase, Tomohisa Hasunuma, Takeshi Hayakawa, Kei Hiraki, Kotaro Hiramatsu, Yu Hoshino, Mary Inaba, Yuki Inoue, Takuro Ito, Masataka Kajikawa, Hiroshi Karakawa, Yusuke Kasai, Yuichi Kato, Hirofumi Kobayashi, Cheng Lei, Satoshi Matsusaka, Hideharu Mikami, Atsuhiro Nakagawa, Keiji Numata, Tadataka Ota, Takeichiro Sekiya, Kiyotaka Shiba, Yoshitaka Shirasaki, Nobutake Suzuki, Shunji Tanaka, Shunnosuke Ueno, Hiroshi Watarai, Takashi Yamano, Masayuki Yazawa, Yusuke Yonamine, Dino Di Carlo, Yoichiroh Hosokawa, Sotaro Uemura, Takeaki Sugimura, Yasuyuki Ozeki, and Keisuke Goda*DOI番号
10.1038/s41467-020-17285-3
用語解説
注1 誘導ラマン散乱(stimulated Raman scattering, SRS)顕微法
誘導ラマン散乱(SRS)は、光周波数が異なる2つの光と分子の相互作用の1つ。2つの光のうち高周波側の光はポンプ光、低周波側の光はストークス光と呼ばれる。ポンプ光とストークス光の光周波数の差が、分子構造で決まる分子振動周波数と一致するとき、ポンプ光が減衰し、ストークス光が増幅される。これらの効果をSRSと呼ぶ。SRS顕微法は、顕微鏡下でSRSを検出することで試料の分子振動情報をもとに画像化する方法。
注2 スマートセル
遺伝子改変や培養条件を最適化することで、従来の化学工業的な手法では合成できない複雑な化合物を生合成できるように改変された細胞。DNAの突然変異と目的物質を生産する細胞選別を繰り返し行う指向性進化法(2018年ノーベル化学賞)を用いることでさまざまな物質を生産する細胞をデザインできる。
注3 インテリジェント画像活性細胞選抜法
細胞の高速イメージングと深層学習を用いた画像解析で細胞を1つ1つ網羅的に高速識別し、その解析結果に応じて所望の細胞を分取する世界初の基盤技術。 平成30年8月28日に本研究グループによりプレスリリース (https://www.s.u-tokyo.ac.jp/ja/press/2018/6009/)されている。
注4 10ギガビットイーサーネット
コンピューター間で1秒間に約10ギガビットのデータを送信できる極めて高速な通信規格。
注5 マイクロ流体技術
マイクロ加工技術を用いて数マイクロメートル~数百マイクロメートル程度の微細な流路構造を形成し、その流路内に流す液体の挙動を制御する技術。インクジェットプリンターや診断装置などに応用されている。
―東京大学大学院理学系研究科・理学部 広報室―