2020-07-17 理化学研究所
理化学研究所(理研)生命機能科学研究センター成長シグナル研究チーム(研究当時)の西村隆史チームリーダー(現 理研生命機能科学研究センター形態形成シグナル研究チーム上級研究員)は、キイロショウジョウバエ[1]の発育ステージの移行に必要なエネルギーが計画的に供給される原理を明らかにしました。
本研究成果は、計画的に進行する生命現象の理解をエネルギー代謝[2]の観点から深めるものであり、さまざまな生物における複雑なステージ移行の理解に貢献すると期待できます。
幼虫が成虫に移り変わる蛹(さなぎ)期では、外部からの栄養摂取が行われないため、幼虫期に摂取して貯蓄している栄養分を計画的に用いて、変態を行う必要があります。しかし、変態という発育ステージの進行に必要なエネルギー代謝がどのような仕組みで制御されているのか、その分子機序は未解明でした。
今回、西村隆史チームリーダーは、モデル生物としてキイロショウジョウバエを用いて、ステロイドホルモン[3]が一過的に貯蔵糖の消費を促し、変態に必要なエネルギーや生体高分子の材料の供給を指令していることを明らかにしました。さらに、変態に必要なステロイドホルモン自身も、貯蔵糖の消費に依存して生合成されていることから、ステロイドホルモンと糖代謝は相互に依存していることが分かりました。これらの結果から、ステロイドホルモンとエネルギー代謝が協調的に機能することで、発育ステージの移行が実現していることが分かりました。
本研究成果は、オンライン科学雑誌『Current Biology』(7月16日付:日本時間7月17日)に掲載されます。
ショウジョウハエの発育ステージの進行に必要なエネルギー代謝調節の仕組み
背景
ヒトを含め多細胞生物の一生は、さまざまな発育ステージを経て、性成熟した成体になります。多くの生物において、成熟期への移行には、ステロイドホルモンが重要な役割を果たしています。昆虫のステロイドホルモンであるエクジステロイド[4]は、胚発生、脱皮、変態といった、一連の発育段階の進行を誘導します。そのなかでも、ショウジョウバエを含めた一部の昆虫では、栄養の摂取と個体成長に最適化された幼虫は、蛹期の変態を経ることで、飛翔能力と次世代を生み出す生殖機能を備えた成虫へと、劇的に姿形が変化します。
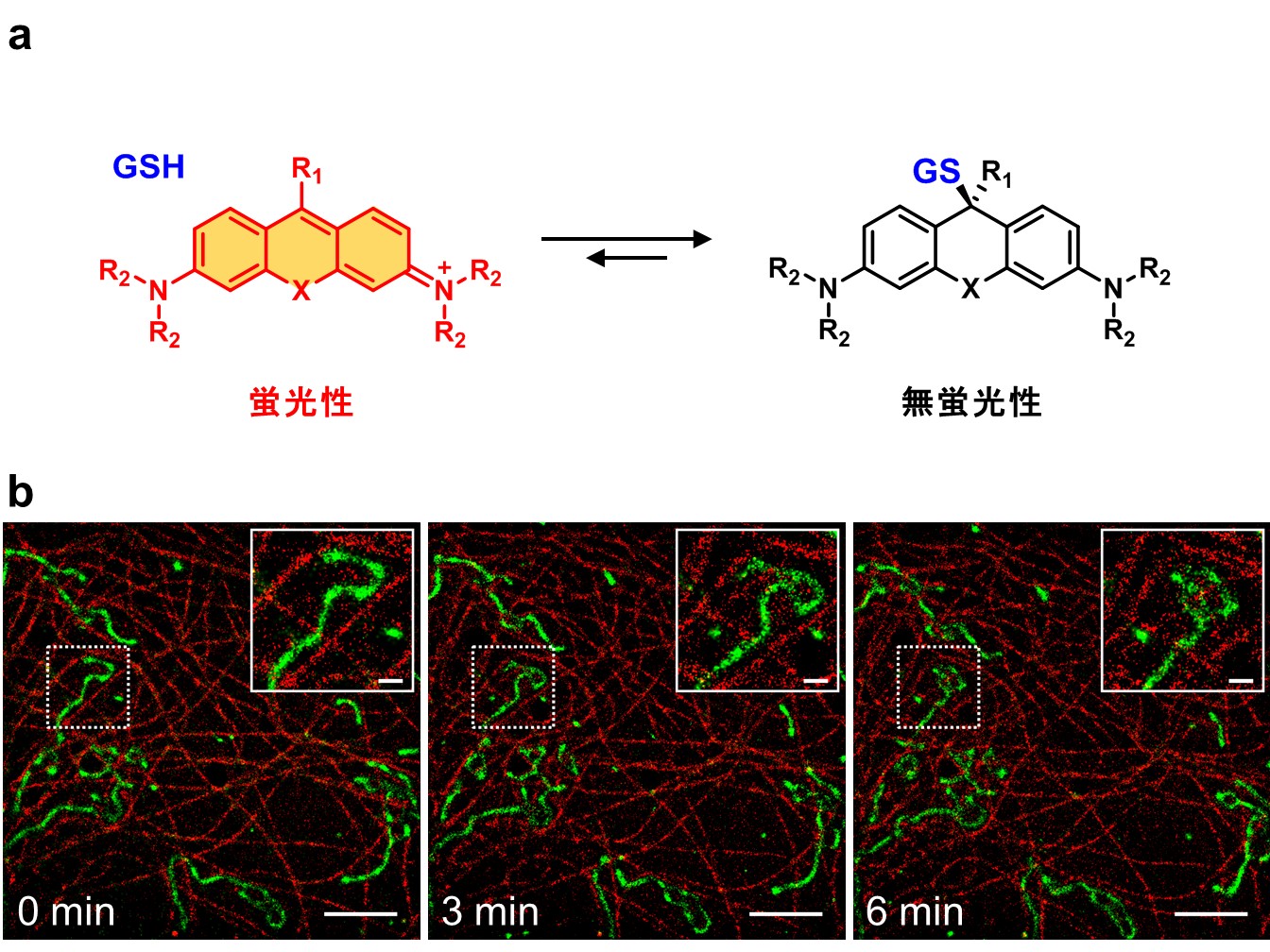
エクジステロイドは、核内受容体[5]に結合し、一連の転写因子[6]群の発現を制御することで機能を発揮します。このエクジステロイドの下流で機能する転写因子ネットワークに関する知見は、1970年代のショウジョウバエ唾腺染色体のパフ[7]誘導に関する研究がもとになっています。ショウジョウバエにおいて、エクジステロイドは摂食と成長を終えた幼虫の前蛹化[8]を誘導します。前蛹化に引き続き、エクジステロイドは、成虫器官の増殖分化を促す一方で、幼虫特異的な器官の組織溶解を引き起こし、幼虫の体から成虫の体に向けた再編成が起きます。前蛹化の一定時間後に、再びエクジステロイドの作用により、成虫の姿形になる形態変化(蛹化[8])が起こります(図1)。
一方、蛹は外部からの栄養摂取を行わないため、幼虫期に摂取して貯蓄している栄養分を計画的に用いて、変態を行う必要があります。1930年代頃から、さまざまな昆虫の変態過程における酸素消費量や二酸化炭素排出量が測定され、個体のエネルギー代謝に関する研究が行われてきました。呼吸商[9](二酸化炭素排出量/酸素消費量)の計算から、蛹期の主要なエネルギー源は脂質であると考えられていました。しかし、変態という発育ステージの進行に必要なエネルギー代謝がどのような仕組みで制御されているのか、その分子機序は未解明でした。
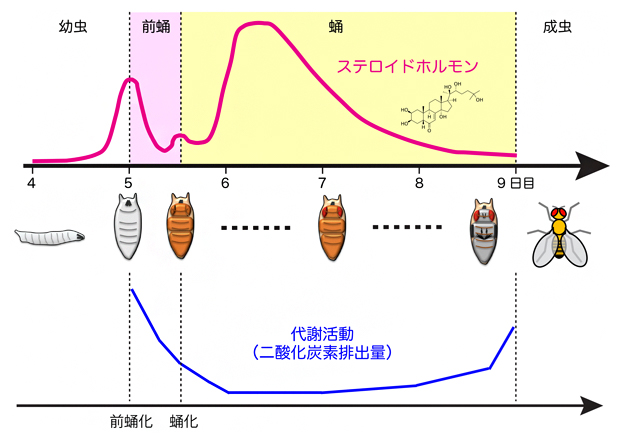
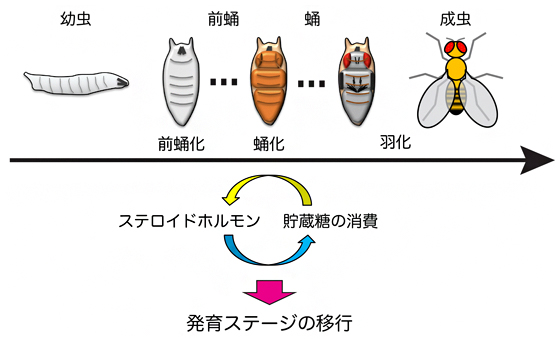
図1※ ショウジョウバエの幼虫から成虫に至る間のステロイドホルモンと代謝活動の変化
ショウジョウバエでは、ステロイドホルモンは幼虫の前蛹化を誘導する。前蛹化の一定時間後に再びステロイドホルモンの作用により、成虫の姿形になる形態変化(蛹化)が起こる。日数は産卵後の日を示す。
※出典)Riddiford, L.M. (1993). Hormones and Drosophila development. In The Development of Drosophila melanogaster, pp. 899-939, Cold Spring Harbor Laboratory Press.
Merkey, A.B., Wong, C.K., Hoshizaki, D.K., and Gibbs, A.G. (2011). Energetics of metamorphosis in Drosophila melanogaster. J. Insect. Physiol. 57, 1437-1445.
研究手法と成果
西村隆史チームリーダーは、蛹化における代謝活動を質量分析装置[10]を用いて詳しく調べました。その結果、前蛹化直後の呼吸商は0.8以下であるのに対して、蛹化に伴い一過的に0.9まで上昇することが分かりました(図2)。この結果から、蛹期における主要なエネルギー源は確かに脂質であるものの、蛹化の過程で一時的に糖質を燃焼していることが、新たに分かりました。
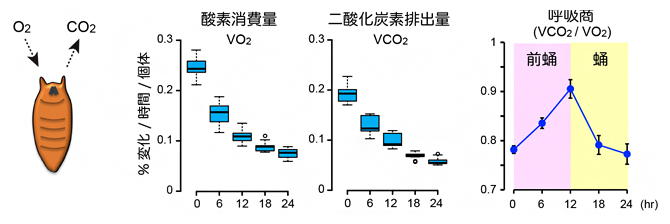
図2 蛹化におけるエネルギー代謝の変化
酸素消費量(V02)と二酸化炭素排出量(VC02)を同時に測定し、呼吸商(VC02/V02)を計測した。横軸は前蛹化後の時間を示す。
ショウジョウバエの体内には、グルコースの供給源として、体液中に存在する二糖のトレハロース[11]と、組織中に貯蓄された多糖グリコーゲンの2種類があります。トレハロースは加水分解されると、2分子のグルコースになります。成長過程にあるハエの幼虫では、グルコースの100倍相当のトレハロースが体液中を循環していて、グルコース濃度を一定に保つ役割を果たしています注1)。これらグルコース供給源の量変化を調べたところ、トレハロースは蛹化の過程で大幅に減少するのに対して、グリコーゲン量は大きな変化を示しませんでした(図3)。質量分析装置を用いて代謝産物やエネルギー物質を網羅的に解析した結果、トレハロース量の減少と一致して、グルコースやグルコースの酸化過程にある一連の代謝物の量が一過的に上昇することが分かりました。同様に、グルコースの炭素骨格をもとに生合成される核酸代謝物も、トレハロースに依存して上昇しました。そこで、トレハロースを合成できない変異体(Tps1変異体)の蛹化過程を調べたところ、野生型と比べて蛹化のタイミングが大きく遅延することが分かりました。また、Tps1変異体では、変態が正常に完了せず、形態異常を示す個体が多く観察されました。
次に、どのような仕組みでトレハロースの分解が起きているのかを調べました。トレハロース分解酵素と膜輸送体[12]の遺伝子発現を経時的に調べたところ、蛹化の直前に一過的に発現が誘導され、トレハロースの分解活性も上昇することが分かりました。この一過的な遺伝子発現を誘導する仕組みをさらに調べたところ、エクジステロイドやエクジステロイドの下流で機能する転写因子が、前蛹期に特異的なトレハロース分解酵素と膜輸送体の発現に関わることが明らかになりました。よって、前蛹期におけるトレハロースの分解は、エクジステロイドの作用で制御されていることが分かりました。また、この結果は、蛹化に必要な炭素源が必要なときに得られるように、トレハロースの分解を事前に計画していることを意味しています。
重要な点として、トレハロースを欠損する変異体では、蛹化に向けたエクジステロイド生合成が低下し、ステロイドホルモンのシグナル伝達経路が正常に機能しないことが判明しました。このことは、ステロイドホルモンの機能と糖質の燃焼は相互に依存しており、これらが協調的に機能することで、蛹化における形態形成を実現していることが分かりました(図3)。
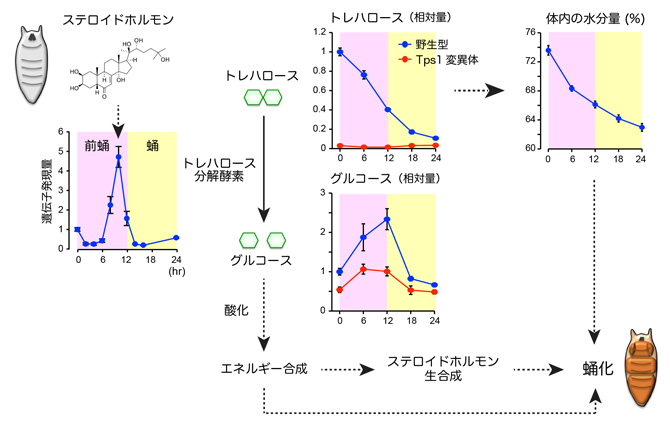
図3 トレハロースの分解により引き起こされる蛹化の仕組み
トレハロース分解酵素の遺伝子発現量の変化(左)、トレハロースとグルコースの量変化(中央)、体内の水分量の変化(右上)を示す。横軸は前蛹化後の時間を示す。ステロイドホルモンの作用で、トレハロース分解酵素の発現が一過的に誘導される(左)。体液中のトレハロースは分解されるとグルコース2分子になり、細胞内で代謝されて、エネルギー合成などに使われる(中央)。トレハロース合成酵素(Tps1)を欠損する変異体では、前蛹におけるグルコースの上昇が起きない。トレハロースの分解に伴うエネルギー産生やステロイドホルモンの生合成、水分量の減少などが協調的に作用して、蛹化が誘導される(右下)。
また、前蛹化の後に体内の水分量が減少していくことが古くから知られています。この体液量の減少は、筋収縮や体内の静水圧とともに、変態における形態変化を促す一要因であると考えられています。興味深いことに、トレハロースを分解できない変異体では、野生型と比べて体液量の減少幅が少なく、トレハロースを欠損するTps1変異体よりも、蛹化異常の表現型が強いことが分かりました。トレハロースは、体液中に存在するグルコースの供給源であると同時に、トレハロース分子自身の保水作用から、体液恒常性にも関わります注2)。よって、前蛹で計画的にトレハロースを分解することで、グルコースを供給するだけではなく、変態に必要な体液量の減少も促進する、二重の利点があると考えられます(図3)。
一方、組織中に貯蓄されたグリコーゲンは、トレハロースよりも総量が多いにもかかわらず、グリコーゲンを欠損しても、変態における顕著な異常は観察されませんでした。しかし、以前の研究で、トレハロース量が減少する変異体において、同時にグリコーゲンを欠失させると、蛹期の致死率が上昇することを明らかにしていました注3)。実際にトレハロースを欠損すると、前蛹期においてグリコーゲンが代わりに分解されることが分かりました。また、グリコーゲンの分解は、遺伝子発現による制御ではなく、細胞内のエネルギー状態により制御されていることから、グリコーゲンは必要に応じて消費され、予備的に機能する貯蔵糖として働いていると考えられます。
注1)2020年4月7日プレスリリース「器官サイズの左右差を抑制する仕組み」
注2)2016年8月24日CDBニュース「トレハロースが体内の恒常性維持に重要なはたらき」
注3)2018年3月16日CDBニュース「脂肪体のグリコーゲンは飢餓に対する最後の砦」
今後の期待
本研究成果は、転写因子ネットワークの働きにより実現するステージの移行(変態)において、転写因子で制御されうる貯蔵栄養の消費により、移行に必要なエネルギーが計画的に供給される仕組みを明らかにしました。グルコースは、燃焼に伴うエネルギー源になるだけではなく、細胞を構築する核酸などの生体高分子の合成にも使われます。器官形成や神経産生など、転写因子ネットワークにより計画的に進行する生命現象は、多く見られます。
よって本研究は、合目的的に機能している生命システムの統合的な理解につながり、転写因子ネットワークによる時期特異的なエネルギー代謝の制御機構や、多細胞生物のステージ移行そのものを支える分子メカニズムを理解することに貢献できると考えられます。
補足説明
1.キイロショウジョウバエ
ハエ目ショウジョウバエ科の昆虫で、さまざまな研究分野でモデル生物として用いられている。体長2~3mm前後の大きさで、飼育が容易であり、遺伝学的な解析に適する。
2.エネルギー代謝
生命活動に必要なエネルギー物質であるアデノシン三リン酸(ATP)は、細胞内で常に産生と消費が同時に進行している。細胞内では、栄養素であるグルコース(ブドウ糖)などの物質を酸化してエネルギーが作り出されている。このエネルギーの立場から見た物質の変換や利用をエネルギー代謝という。
3.ステロイドホルモン
コレステロールから生合成され、化学構造的にステロイド核を有するホルモンの総称。一般に、細胞膜を通過して、細胞内で核内受容体に結合し、遺伝子の発現を制御する。
4.エクジステロイド
昆虫における主要なステロイドホルモンの総称で、エクダイソン(Ecdysone)はその中の一種である。前胸腺と呼ばれる内分泌器官で産生されて、個体全体の成長や脱皮・変態の誘導をつかさどる。
5.核内受容体
ステロイドホルモンのような低分子脂溶性物質と結合する受容体は、一般的に細胞膜上ではなく細胞質内に存在する。細胞質でステロイドホルモンなどと結合した受容体は核内に移行して遺伝子発現を制御するため、核内受容体と呼ばれる。
6.転写因子
DNAの特定配列に結合し、遺伝子の発現を正または負に制御するタンパク質群。多数の転写因子が多細胞生物の発生や成長など、さまざまな生命現象に関与している。
7.パフ
唾腺染色体は、部分的に膨らんだ構造を取る。この膨らみをパフという。DNAからmRNAへの転写が盛んに起きている部位で、発生ステージや各種のストレスに特異的な部位がある。
8.前蛹化、蛹化
ハエの場合、幼虫の外皮が硬化して前蛹になる。この過程を前蛹化(囲蛹殻形成)という。この硬化した外皮の内側で、真の蛹になる過程を蛹化と呼ぶ。この蛹化の過程で、成虫原基を中心に形態変化が行われ、成虫の姿が折り畳まれたような姿が形成される。昆虫によっては蛹室や繭を作り、その中で蛹化する。
9.呼吸商
生体内で、栄養素が分解されてエネルギーに変換する過程で必要な酸素消費量に対する、二酸化炭素排出量の比率。この値から、糖質、脂質、タンパク質の中で、どの栄養素が燃焼しているのかという概要が分かる。
10.質量分析装置
試料に含まれる分子をイオン化し、その質量を測定する装置。微量な物質の定量が行える。
11.トレハロース
グルコースが1,1-グリコシド結合してできた二糖。ヒトは自身で合成できないが、グルコースに分解して消化吸収することができる。多くの昆虫では、体液中の主要な糖である。
12.膜輸送体
細胞膜上にある輸送体で、膜を通して物質の輸送を行う。トレハロースやグルコースは細胞膜を通過できないため、それぞれに特異的な膜輸送体が存在する。
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金基盤研究B「栄養環境の変化に対する適応戦略と成長・代謝制御機構の解析(研究代表者:西村隆史)」、同挑戦的研究(萌芽)「最適制御理論に基づく環境依存的な成長と代謝の調節機構に関するeco-devo研究(研究代表者:西村隆史)」による支援を受けて行われました。
原論文情報
Takashi Nishimura, “Feed-forward regulation of glucose metabolism by steroid hormones drives a developmental transition in Drosophila”, Current Biology, 10.1016/j.cub.2020.06.043
発表者
理化学研究所
生命機能科学研究センター 成長シグナル研究チーム(研究当時)
チームリーダー 西村 隆史(にしむら たかし)
(現 生命機能科学研究センター 形態形成シグナル研究チーム 上級研究員)
報道担当
理化学研究所 広報室 報道担当