2020-07-18 東京大学
出村 奏恵(生物科学専攻 博士課程1年)
草木迫 司(生物科学専攻 助教)
志甫谷 渉(生物科学専攻 特任助教)
平泉 将浩(生物科学専攻 博士課程2年/田辺三菱製薬株式会社創薬本部
創薬基盤研究所 研究員)
樽野 陽幸(京都府立医科大学大学院医学研究科細胞生理学 教授)
濡木 理(生物科学専攻 教授)
発表のポイント
- 甘味・うま味・苦味物質の認識に必須のチャネルであるCALHM1と、そのファミリーの立体構造を解明しました。
- CALHM1のATP透過機構およびCALHMファミリーの多量体化メカニズムを初めて明らかにしました。
- 今後、アルツハイマー病などのCALHMファミリーに関連した疾患や、味の感受に関わる研究が進展していくことが期待されます。
発表概要
味の認識は、人間にとって重要な機能です。Calcium homeostasis modulator 1(CALHM1)は、ヒトを含む多くの哺乳類で、甘味・うま味・苦味物質の認識に必要なチャネル(注1)です。舌にある味蕾細胞の細胞膜に発現し、活動電位に依存してATP(注2)を放出することにより、味覚情報を味覚神経に伝達します。
しかし、そのCALHM1がどのようにATPを透過するのか、また、CALHM1のホモログが同様の構造をとっているのかなど、明らかにされていないことが多くありました。
今回、東京大学大学院理学系研究科の濡木教授らのグループは、京都府立医科大学の樽野教授らのグループとの共同研究のもと、CALHM1及びそのファミリーの立体構造を、クライオ電子顕微鏡(注3)を用いた単粒子解析法(注4)によって決定しました。決定した立体構造から、CALHM1のATP透過機構およびCALHMファミリーの多量体化(注5)の構造基盤が明らかとなりました。この研究により、今後CALHMファミリーに関連した疾患の研究が進展していくことが期待されます。
本研究成果は日本時間2020年7月18日に米国科学雑誌 Science Advances のオンライン版に公開されました。
発表内容
ヒトを含む多くの哺乳類は、甘味・うま味・苦味・酸味・塩味といった基本味を、舌に存在する味蕾を用いて認識しています。このうち、甘味・うま味・苦味は味蕾細胞の細胞膜に発現するGタンパク質共役受容体によって受容され、細胞内のシグナル伝達カスケードを活性化し、最終的に神経伝達物質である ATP がチャネルを通って細胞から放出されることで、P2X受容体を発現する求心性の味神経へ味覚情報を伝達します(図1)。この ATP 放出過程には、イオンチャネルの一つであるCALHM1が必須となります。
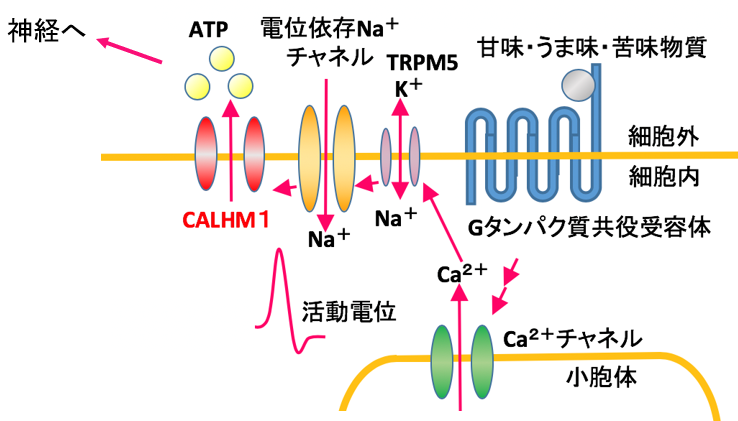
図1:味覚情報の伝達におけるCALHM1 の働き
CALHM1 は、脱分極または細胞外Ca2+濃度の減少によって活性化し、Ca2+やATPなどの小分子を透過させます。活動電位に依存した細胞からのATP放出の多くは、チャネルではなくシナプス小胞によって行われており、CALHM1は現在同定されている中では唯一の電位依存性ATPチャネルです。また、ヒトCALHM1の遺伝子多型(P86L) は、哺乳類細胞におけるCa2+透過性の減少およびアミロイドβの蓄積との関連が報告されており、アルツハイマー病との関わりが明らかとなっています。
しかし、これまでCALHM1 がどのような孔(ポア)を形成してATP を透過させるのか、また、CALHM1のホモログも同様の構造をとっているのか、といった立体構造に基づく詳細なポアの透過機構や、CALHM1のホモログの構造、多量体の形成機構などは謎に包まれたままでした。
今回、東京大学大学院理学系研究科の濡木理教授らの研究グループは、クライオ電子顕微鏡を用いた単粒子解析法により、ヒトCALHM1と60%程度の配列類似性を持つメダカ由来CALHM1、ヒト由来CALHM2、及び線虫のホモログである CeCLHM-1の立体構造を明らかにしました(図2,3)。
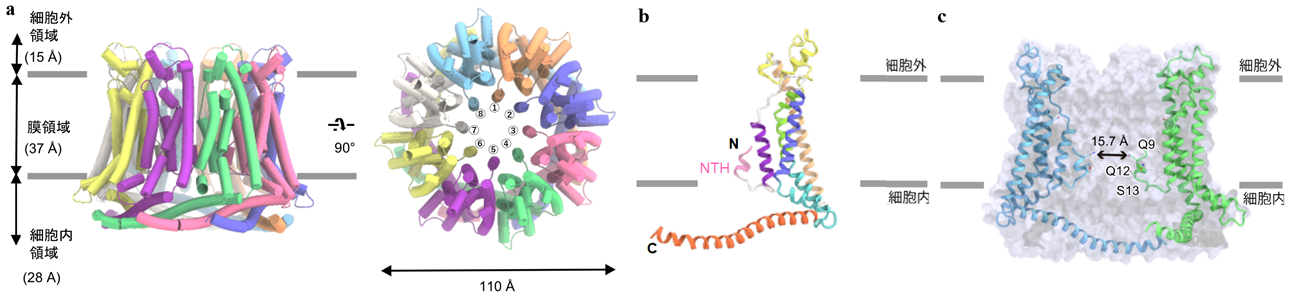
図2:(a)決定したCALHM1 の全体構造。横および細胞外側からの図。(b) CALHM1 の単量体構造。N末端のαへリックス(NTH)はピンク色で示している。(c)CALHM1 のポア構造。
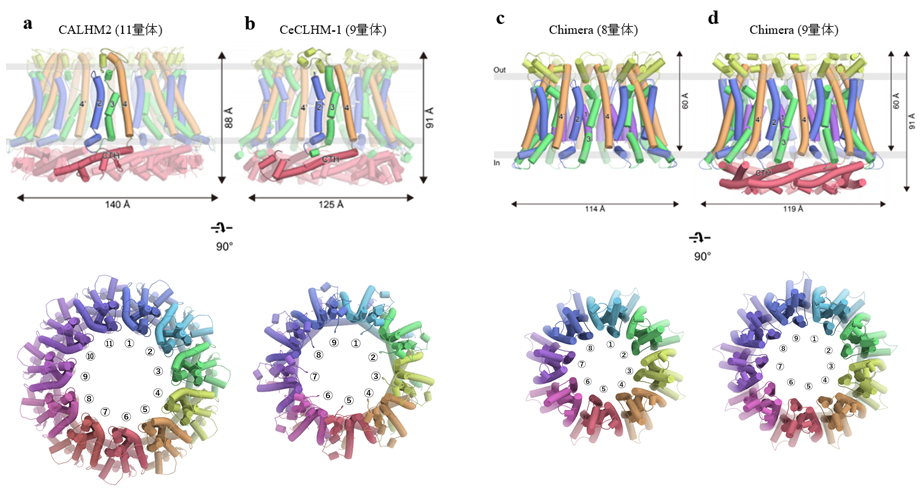
図3:決定したCALHMファミリーの全体構造。(a)CALHM2(11量体)、(b)CeCLHM-1(9量体)、(c)CALHM2とCALHM1のキメラタンパク質(8量体)、(c)CALHM2とCALHM1のキメラタンパク質(9量体)
CALHM1単量体は4本の膜貫通へリックス(注6)からなり、それが8量体のチャネルを形成することが明らかとなりました(図2a-b)。膜貫通ヘリックスのトポロジーは新しく、C末端は細胞質側に伸びてαへリックスを形成し、多量体間の相互作用に寄与していました。N末端は各単量体からリング状構造の中心にのびてαヘリックスを形成しており、この8つのヘリックスがチャネルのポア部分を形成していることが示唆されました(図2c)。
そこで、ポア部分にあたるN末端のアミノ酸残基を欠失させた変異体を作製し、京都府立医科大学樽野教授らの研究グループとの共同研究で、培養細胞を用いてCALHM1のATP放出能欠失の効果を評価しました。細胞外にCa2+が存在しない開状態では、変異体のATP放出活性は野生型と比較して著しく上昇したことから、N末端のαへリックス(NTH)がATPの放出において重要な機能を果たしていることが示唆されました(図4a)。一方で、細胞外にCa2+が存在する閉状態では、欠失変異体も野生型同様、ATP放出活性をほとんど示しませんでした(図4b)。
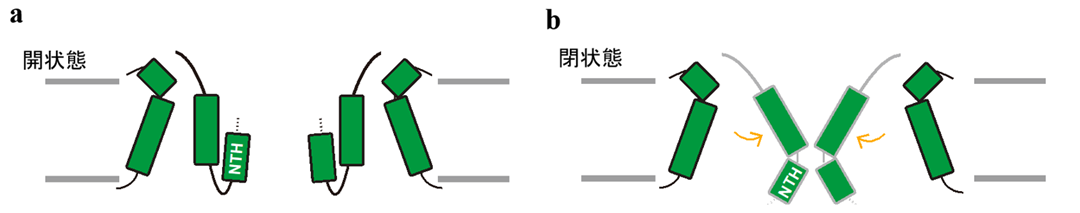
図4:本研究より提唱されたCALHM1開閉機構の模式図。(a)開構造ではN末端のαへリックス(NTH)がATPの放出において重要な機能を果たしていることが示唆された。(b)一方閉状態では、NTH以外の領域も関与していることが示唆された。
以上の知見から、CALHM1構造中のN末端は実際にATPの放出に関与しますが、チャネルの閉鎖には構造中の他の領域も関与していることが示唆されました。
一方、CALHM2 とCeCLHM-1の構造では、膜貫通部分のトポロジーはCALHMファミリー間で類似しているものの、C末端領域の構造はそれぞれ異なっていました(図3a)。また、各々11量体と9量体を形成しており、CALHMファミリー間で異なる量体数が存在することを示しました。
さらに、量体数を決定する構造基盤を解明するために8量体のCALHM1と11量体のCALHM2のキメラタンパク質を作製し、クライオ電子顕微鏡を用いた単粒子解析法により構造解析を行った結果、8量体と9量体という異なる量体数の構造が得られました(図3b)。キメラタンパク質はCALHM1の膜貫通部分とCALHM2のC末端領域からなるため、膜貫通ドメインでの相互作用が量体数の規定に寄与していることが明らかとなりました。
本研究により、CALHMチャネルのATP透過機構および多量体化のメカニズムが解明されたことで、今後、アルツハイマー病などのCALHMファミリーに関連した疾患や味の感受に関わる研究が進展していくことが期待されます。
本研究は、日本学術振興会における科学研究費助成事業の特別推進研究「物理刺激で制御される膜蛋白質の分子機構の解明」(課題番号:16H06294 研究開発代表者:濡木理)の一環で行われました。また、本研究は、国立研究開発法人日本医療研究開発機構(AMED)「創薬等ライフサイエンス研究支援基盤事業」(課題番号:JP19am01011115)の一環として、クライオ電子顕微鏡などの大型施設の外部開放を行うことで優れたライフサイエンス研究の成果を医薬品等の実用化につなげることを目的とした「創薬等先端技術支援基盤プラットフォーム(BINDS)」(支援番号:1111)の支援により行われました。
発表雑誌
- 雑誌名
Science Advances論文タイトル
Cryo-EM structures of calcium homeostasis modulator channels in diverse oligomeric assemblies著者
Kanae Demura(1), Tsukasa Kusakizako(1), Wataru Shihoya(1), Masahiro Hiraizumi(1), Kengo Nomura, Hiroto Shimada, Keitaro Yamashita, Tomohiro Nishizawa, Akiyuki Taruno*, Osamu Nureki*.DOI番号
10.1126/sciadv.aba8105論文URL
Handle Redirect
用語解説
注1 チャネル
生体膜に存在し、イオン等を透過させる膜貫通タンパク質である。脂質二重層で構成された生体膜はイオン等をほとんど透過させないため、チャネルは生体機能に必須のタンパク質である。
注2 ATP
アデノシン三リン酸の略称で、塩基と糖と3分子のリン酸からなる。生体内でエネルギー伝達物質として使われているほか、神経伝達物質としても使われている。
注3 クライオ電子顕微鏡
光学顕微鏡では可視光を用いて像を観測するのに対し、クライオ電子顕微鏡では試料を低温下に置き、電子を用いて像を拡大し観測する。電子線の持つ波長は可視光線よりも短いため、光学顕微鏡では見ることが難しい原子レベルの大きさの試料を観測することが可能となる。この手法は試料に対する制約が少なく、結晶化しにくい膜タンパク質や高分子量のタンパク質の構造解析に有効である。
注4 単粒子解析法
クライオ電子顕微鏡で撮影した多数の像を画像処理によって平均化し、タンパク質の三次元構造を再構築する方法のこと。
注5 多量体
生体内では、同種のタンパク質分子(単量体)が複数個まとまり、多量体を形成して働くことがある。1つの多量体を形成する分子の個数を量体数という。
注6 ヘリックス
タンパク質中にみられる構造の1つ。ペプチド結合でつながれたアミノ酸の鎖が、らせん状に巻かれた構造をしている。
―東京大学大学院理学系研究科・理学部 広報室―