2020-08-03 岡山大学,日本医療研究開発機構
発表のポイント
- 敗血症1)は、治療の開始が遅れると呼吸不全、ショック、播種性血管内凝固症(DIC2))などを発症しやすくなる大変重篤な病態ですが、特異的な治療薬が現在ありません。
- 敗血症の治療薬候補として研究を進めている血漿Histidine-rich glycoprotein(HRG3))タンパクの受容体Clec1Aを新規に同定しました。
- 敗血症の病態では血管内皮細胞障害が生じますが、その原因となるHMGB1の放出をHRGは強く抑え、過剰な炎症性サイトカイン類の産生を抑制することを明らかにしました。
- HRGの血管内皮細胞保護作用は、敗血症治療法の開発につながる重要な発見です。
概要
敗血症は、感染症の増悪をきっかけとして生じる重篤な病態で、治療の開始が遅れると呼吸不全、ショック、播種性血管内凝固症(DIC)などを発症しやすく、早期の的確な診断と治療の開始が必要です。敗血症の治療薬開発の研究を続けている岡山大学大学院医歯薬学総合研究科(医)薬理学の西堀正洋教授と細胞生物学の阪口政清教授らの研究グループは、この度治療薬候補として注目する血漿タンパクHRGの受容体Clec1A(C-Type Lectin Domain Family 1 Member A)を新規に同定しました。
敗血症の病態が進行すると、血管の内壁として存在する血管内皮細胞に異常な活性化が起こりますが、その機序の詳細についてはこれまで解明されていませんでした。研究グループでは、血管内皮細胞がエンドトキシンや炎症性サイトカインのTNF-αで刺激されると、内皮細胞の核内に存在する炎症反応を増幅する作用の強いHMGB1(High Mobility Group Box 1)というタンパクが細胞外へ放出されることと、この反応をHRGがClec1A刺激を介し非常に強く抑制することを明らかにしました。さらに、HMGB1が血管内皮細胞に働き種々の炎症性サイトカイン類が産生されるのを、HRGが効率よく抑制することを証明しました。以上の結果から、血漿タンパクHRGは、血管内皮細胞を保護する非常に大切な機能を担っていることがわかりました。このHRGが、敗血症の患者の血漿中では著明に低下していることは、これまでの研究で明らかにしています。本研究は2017(平成29)年度より3年間、国立研究開発法人日本医療研究開発機構(AMED)の支援を得て、産学連携医療分野研究成果展開事業として実施されたもので、「敗血症治療のためのHRG血液製剤の創出」をテーマとした研究成果です。
研究成果は、6月26日付けで、学際的国際誌「iScience」電子版に掲載されました。
発表内容
現状
敗血症は、細菌、ウイルス、真菌などの感染症による全身炎症に臓器障害が加わった病態であり、進行すると多臓器不全や敗血症性ショックといった重篤な病態になります。敗血症は、直接の死因として長らく世界的に第一位ですが、この事実はあまり知られていません。現在、世界で年間2000~3000万人が新規に発症し、その数十%が敗血症で亡くなっていると推定されています。わが国でも年間37万人が発症しています。このような状況を受け、「世界敗血症宣言」が出され、敗血症制圧に向けて世界的キャンペーンが展開されています。このキャンペーンの中では、病早期の診断と治療開始の重要性が強調されていますが、敗血症に特異的な治療法はないのが現状です。特に、敗血症病態では、血管の内壁構造である血管内皮細胞に無秩序な活性化が起こると考えられていますが、その機序の詳細はよくわかっておらず、それを改善する治療法もありません。
研究成果の内容
敗血症の病態では、過剰な血管内皮細胞の活性化があると考えられています。しかし、生体内での血管内皮細胞の恒常性維持のメカニズムはよくわかっていません。本研究では、試験管内の血管内皮細胞培養実験系で、血管内皮細胞の活性化状態を再現し、HRGの効果を解析しました。LPSやTNF-αによる刺激によって、内皮細胞の細胞核に局在しているクロマチンDNA結合タンパクのHMGB1が細胞質を経由して細胞外へ放出される(トランスロケーション)ことが分かりました(図1上)。HMGB1は細胞外で複数の因子と複合体を作る性質があり、それによって炎症性サイトカインの増幅因子の役割を果たします。HRGを刺激物質添加の前に培地に加えておくと、HRGの濃度依存的にHMGB1のトランスロケーション、炎症性サイトカインの放出が抑制されました(図1上、下)。一方、組換えヒトHMGB1で血管内皮細胞を刺激すると、炎症性サイトカイン類の分泌、パターン認識受容体や細胞接着分子の発現が誘導されましたが、HRGの添加によりそれらの反応は強力に抑制されました(図2)。HRGの作用には、特異的な細胞形質膜受容体が介在するとの仮説のもと、その探索を行い、新規にClec1A4)をHRGの受容体として同定しました。この受容体は、血管内皮細胞の恒常性の維持に働いている可能性があります。敗血症で低下した血漿HRGを補充療法で補うことで、血管内皮細胞を保護し敗血症の症状を緩和できる可能性が示唆されます。
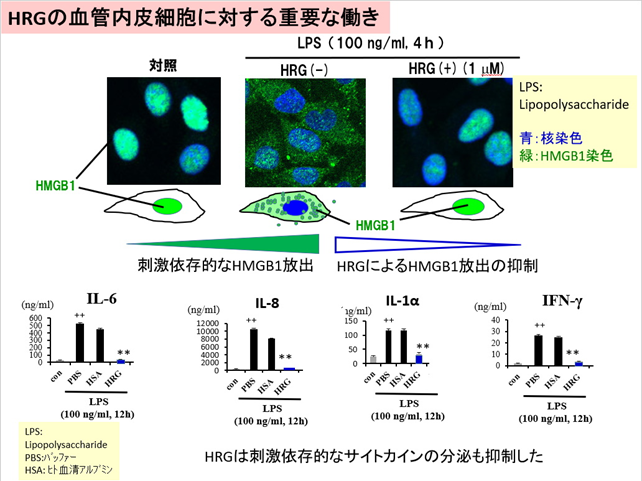
図1:血管内皮細胞からの刺激依存的なHMGB1と炎症性サイトカインの放出と、HRGによる抑制作用
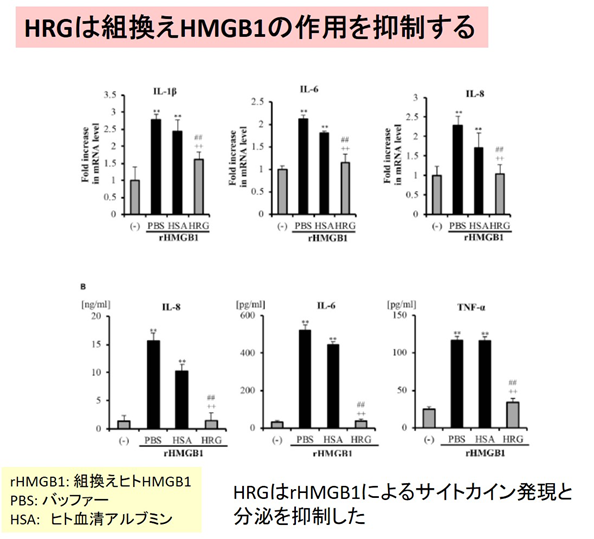
図2:組換えヒトHMGB1による炎症性サイトカインの発現と分泌に対するHRGの効果
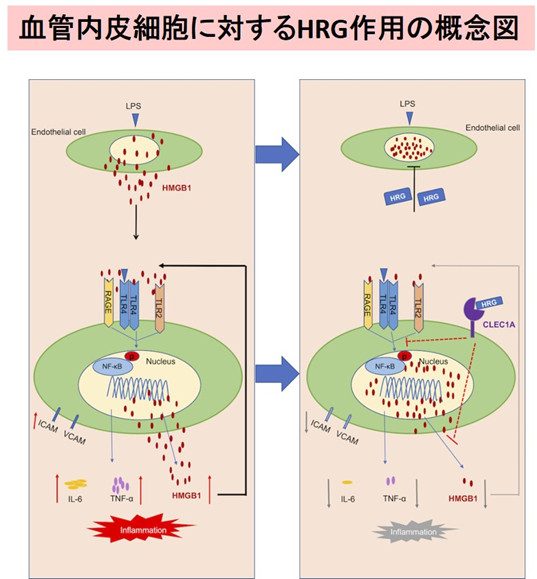
図3:LPS刺激による血管内皮細胞応答(左)とHRG存在時の抑制効果(右)
社会的な意義
敗血症の早期診断と治療法の開発には高い医療ニーズが存在します。血中HRGを測定する診断法と低下したHRGを補う治療法は、敗血症の制圧に向けて有効に働く可能性があります。現在、世界的な大流行となっている新型コロナウイルス感染による敗血症やARDSの場合には、急速な病態の悪化が問題になっています。病状の急変の可能性を予め知るために、血漿HRG測定が役立つかどうか、今後慎重に調査する必要があると考えます。
論文情報
- 論文名:
- Histidine-rich glycoprotein inhibits high mobility group box 1-mediated pathways in vascular endothelial cells through CLEC-1A
- 掲載紙:
- iScience
- 著者:
- Gao S, Wake H, Sakaguchi M, Wang D, Takahashi Y, Teshigawara K, Zhong H, Mori S, Liu K, Takahashi H, Nishibori M.
- DOI:
- 10.1016/j.isci.2020.101180.
研究資金
本研究は、下記の支援を受けて実施しました。
国立研究開発法人日本医療研究開発機構(AMED)
事業名:産学連携医療イノベーション創出プログラム 基本スキーム(ACT-M)
研究開発課題名:「敗血症治療のためのHRG血液製剤の創出」(2017~2019年度)
研究開発代表者:西堀正洋
日本学術振興会 科学研究費補助金 基盤研究(B)
研究課題名:「バイオセンサー分子としてのHMGB1の動態と多機能性解析」
研究代表者:西堀正洋
補足・用語説明
- 1)敗血症:
- 細菌、ウイルス、真菌などの感染症による全身炎症に生命維持を脅かす臓器障害が加わった病態。
- 2)DIC:
- 日本語では、播種性血管内凝固症と呼ばれる。元来、正常な血管内では血液は凝固しない仕組みを持っている。しかし、敗血症やがん・白血病の末期には、血管内で異常に血液凝固が亢進する場合があり、全身の細小血管内で微小血栓が多発し、臓器不全や出血傾向を生じる。
- 3)Histidine-rich glycoprotein(HRG):
- 肝臓で産生され、血液中に分泌される糖タンパク質の一種。分子内に多数のヒスチジン残基を有することから、このように命名された。健常人の血液中レベルは、1μM前後である。種々の因子と結合する性質があり、多彩な機能をもっていると考えられている。
- 4)Clec1A:
- C-type lectin domain family 1 member Aの略。Clecスーパーファミリーは、数十種類の構成メンバーからなり、そのうちの一つ。このグループの受容体群は、細胞接着、細胞間シグナリングや炎症調節などの重要な機能に関与することが推定されている。
お問い合わせ
お問い合わせ
岡山大学大学院医歯薬学総合研究科(医)
薬理学 教授 西堀正洋
AMEDの事業に関するお問い合わせ
国立研究開発法人日本医療研究開発機構
実用化推進部研究成果展開推進課