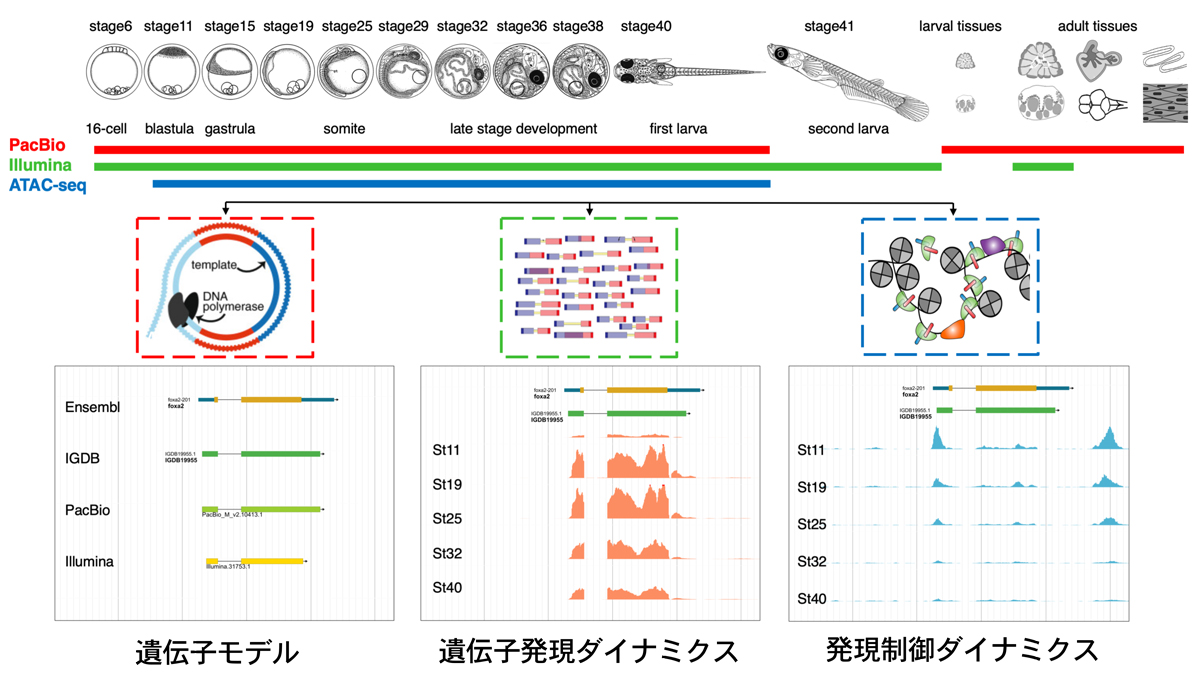
2020-08-21 熊本大学,筑波大学,日本医療研究開発機構
ポイント
- 本研究グループは、これまでに女性ホルモンであるエストロゲンが骨格筋の発育・発達や再生に重要であることを明らかにしてきましたが、その作用機序は不明でした。
- 今回、その作用機序として、筋線維や筋幹細胞に発現するエストロゲン受容体β(ERβ)を同定しました。
- 今後、ERβやその下流シグナルを標的にすることで、サルコペニアなどの筋脆弱症の病態解明と予防治療への応用を目指します。
研究概要
私たちの筋肉(骨格筋)は生後、発育・発達し、成人になると運動習慣等によってその大きさや質が変化します。また、骨格筋は激しい運動や打撲等により損傷しますが、内在する筋幹細胞の働きにより再生することができます。骨格筋を生涯にわたって健常に維持することは健康寿命延伸のカギを握ることから、骨格筋に関する研究は近年、急速に進んでいます。しかし、これまでのほとんどの基礎研究は雄性動物を対象にしたものであり、性差についてはあまり考慮されていませんでした。女性ホルモンであるエストロゲン*1は、さまざまな組織の恒常性維持に重要な役割を担っています。近年の疫学調査により、血中エストロゲンレベルの減少と筋力低下の関連が指摘されていますが、その作用機序については、よくわかっていません。
今回、熊本大学発生医学研究所筋発生再生分野の瀬古大暉特別研究学生(長崎大学大学院生)は、小野悠介准教授、筑波大学の藤田諒助教、長崎大学の北島百合子講師、愛媛大学の今井祐記教授とともに、エストロゲンの受容体の1つであるエストロゲン受容体β(ERβ)に着目し、筋線維特異的または筋幹細胞特異的ERβ遺伝子欠損マウスを作出し、解析しました。その結果、ERβの機能が阻害された雌性マウスは、骨格筋の発育・再生に異常が観察されました。この異常は雄性マウスではみられないことから、エストロゲンとその下流シグナルは女性特有の筋発育・再生メカニズムになると考えられます。本研究により、エストロゲンの作用機序を調べERβやその下流シグナルの標的を明らかにしたことで、加齢にともなう筋萎縮(サルコペニア*2)を含む様々な筋脆弱症に対する予防治療開発への展開が期待されます。
本研究成果は、国際幹細胞学会の学会誌Stem Cell Reportsのオンライン版に令和2年8月21日(日本時間)に掲載されました。
研究の説明
背景
骨格筋は生後、発育・発達し、筋量は20代でピークを迎え30代から徐々に低下していきます。しかし、筋力トレーニング等により骨格筋に負荷をかけることで筋肥大を誘導し、筋量を維持・増加させることができます。一方、骨格筋は、過度な運動や打撲等により損傷しますが、損傷しても再生します。このような骨格筋の肥大や再生には、筋線維の周囲に存在する筋幹細胞*3の働きが欠かせません。筋幹細胞の機能異常は、サルコペニアや難治性筋疾患である筋ジストロフィーなどさまざまな筋脆弱症と関連すると考えられています。近年、骨格筋の基礎研究は急速に進んでいるものの、そのほとんどの研究は性周期のない雄性動物を用いたものであり、性差はあまり考慮されていませんでした。
女性ホルモンであるエストロゲンは、さまざまな組織・臓器の恒常性を維持しています。したがって、過度なダイエット等による無月経や閉経によるエストロゲン濃度の低下は、生体恒常性の乱れにつながります。エストロゲンは細胞内にあるエストロゲン受容体(ER)と結合すると、核内移行し、ゲノムDNAに結合することで、転写因子として特定の遺伝子の発現を誘導します。ERは、ERαとERβの2種類が存在しますが、ERαとERβはともにエストロゲンに対する高い結合能がある一方、組織分布は異なり、共通したDNA結合ドメイン(結合領域)を有しておらず、互いに拮抗する作用もあるため、それぞれ異なる役割が示唆されています。また、エストロゲンの細胞への作用は、ERを介するものと介さないものがあることが知られています。
50代の閉経前後の女性を対象とした疫学調査から、血中エストロゲンレベルの減少と筋力低下の関連が指摘されています。本研究グループはこれまでに、骨格筋におけるホルモンの作用を調べており(Seko et al., FASEB J 2016)、卵巣摘出によるエストロゲン欠乏モデルマウスを用いて、エストロゲンが骨格筋の発育・発達や再生に重要であることを明らかにしてきました(Kitajima and Ono, J Endocrinol 2016)。また、エストロゲン欠乏状態での栄養介入の有効性についても検討してきました(Kitajima et al., Nutrients 2017)。しかし、エストロゲンが筋線維や筋幹細胞のERに直接的に作用して骨格筋の成長や再生を支配しているのか、それとも他の組織や臓器を介し間接的に作用しているのかは不明でした。エストロゲンシグナルを受容体レベルで解析し、機序を明確にすることは疾患の予防治療戦略を講じる上で極めて重要です。そこで今回本研究グループは、筋線維特異的あるいは筋幹細胞特異的にERβ遺伝子を誘導的に欠損できるマウスを作出し、骨格筋におけるERβの機能解析を行いました。
成果
骨格筋の発育におけるERβの役割を明らかにするために、筋線維特異的に薬剤(ドキシサイクリン)投与によってERβ遺伝子を欠損できる(mKO)マウスを作出しました。生後6週目にERβ欠損を誘導し、10-12週目に前脛骨筋の筋線維面積(個々の筋線維の太さ)と筋力(四肢の握力)を調べたところ、雌性mKOマウスは野生型と比べて両指標ともに低下していました(図1)。この骨格筋の発育低下は、雄性マウスでは観察されませんでした。筋萎縮関連遺伝子の発現を調べたところ変化がなかったことから、雌性マウスの骨格筋の発育低下は筋萎縮の亢進ではないと考えられます。また、卵巣摘出によるエストロゲン欠乏マウスでは、筋の発育低下に加え、速筋線維*4の割合が相対的に増える筋質の変化をともなうことが知られていますが(Kitajima and Ono, J Endocrinol 2016)、本研究ではmKOマウスでそのような質的変化はみられませんでした。したがって、エストロゲンは、筋線維に発現するERβを介して筋線維の発育を促進する直接作用がある一方、筋線維の質に関してはERβを介さずに制御している可能性が示唆されました。
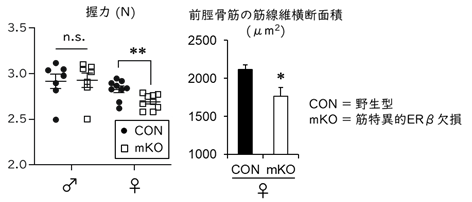
図1.筋特異的にERβを欠損した雌性マウスの筋力と筋線維面積は減少する
続いて、筋幹細胞におけるERβの機能を明らかにするために、筋幹細胞特異的に薬剤(タモキシフェン)投与によってERβ遺伝子を欠損できる(scKO)マウスを作出しました。まず、局所的に筋損傷を誘導し、scKOマウスの筋再生能を評価しました。その結果、野生型マウスでは効率よく筋再生が起こる一方、雌性scKOマウスの筋組織では、再生筋線維は細く、コラーゲン沈着による線維化がみられ、筋再生力は著しく低下していました(図2)。しかし、雄性scKOマウスの筋再生は障害されませんでした。なお、雌の筋再生障害は、卵巣摘出によりエストロゲンを欠乏状態にしても増悪しなかったことから、エストロゲンは筋幹細胞が発現するERβを介して筋再生を制御していると考えられます。
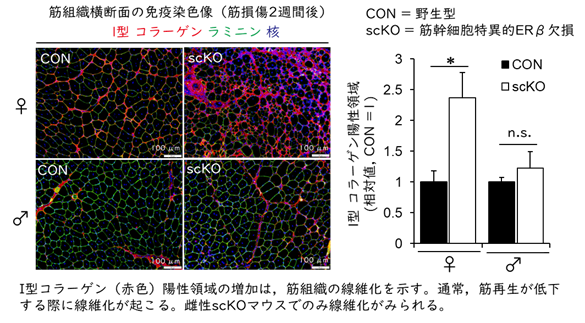
図2.筋幹細胞特異的にERβを欠損した雌性マウスの筋再生は障害される
さらに、筋再生能の低下の原因を探るために、筋幹細胞を単離し、細胞培養系で評価しました。scKOに加えsiRNA*5や阻害剤などを用いた複数の機能阻害実験によりERβの機能を評価したところ、ERβは筋幹細胞の増殖の促進と細胞死の抑制に寄与していることがわかりました(図3)。RNA-seq解析により遺伝子発現を調べたところ、scKO筋幹細胞において、ニッシェ関連遺伝子発現が減少していました。細胞老化関連遺伝子の発現増加も観察されましたが、細胞老化マーカーであるSA-β-gal染色では変化がみられませんでした。したがって、ERβの不活性化によって幹細胞ニッシェ*6の形成が阻害されることで筋幹細胞の増殖や生存に影響を与えた可能性が推察されます。
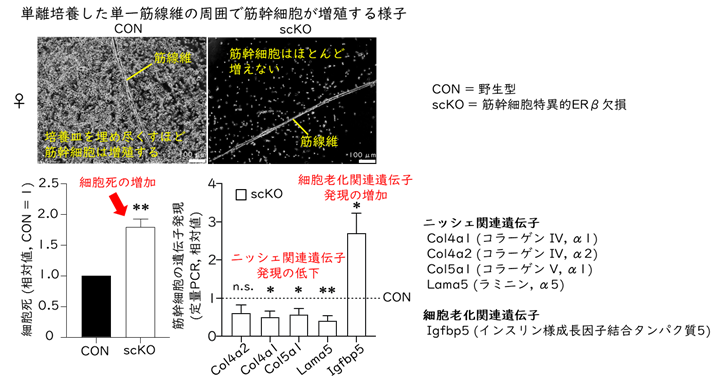
図3.ERβを欠損した筋幹細胞は増殖が低下し細胞死が増加する
本研究から、雌性マウスのERβは筋線維および筋幹細胞の双方で機能し、骨格筋の発育と再生に重要な役割を担っていることを初めて明らかにしました(図4)。一方、雄性マウスのERβの発現量は雌性マウスと同程度にあるにもかかわらず、雄性マウスにおけるERβの役割は未解明であり今後の課題です。
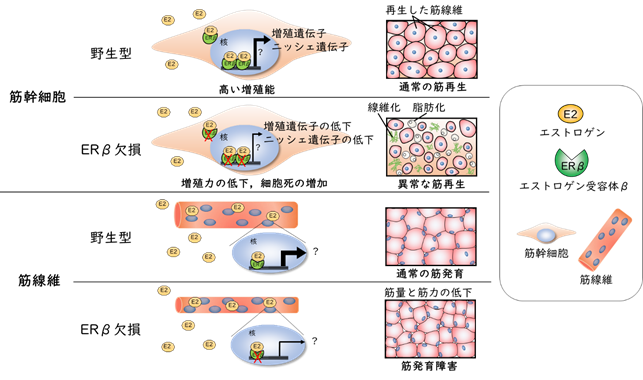
図4.ERβを介した雌性特異的な筋発育・再生メカニズム(研究成果のまとめ)
展開
本研究はエストロゲンとその下流シグナルによる女性特異的な骨格筋制御メカニズムの一端を明らかにし、これからの筋研究に性差の視座を取り入れることの重要性を指摘しました。女性アスリートにおいて過酷なトレーニングや過度なダイエット等により誘発される無月経は、女性アスリートの3主徴*7の1つとして世界的に問題になっています。本研究による動物実験の所見を直接ヒトに応用することはできませんが、無月経におけるエストロゲンの減少は、筋線維や筋幹細胞のERβ活性を抑制し、運動パフォーマンスの低下に加えスポーツ障害からの回復の遅延を招く可能性があるため、女性アスリートにとって極めて不都合な状態に陥る危険性を示唆しています。また本研究から女性特有の筋老化のメカニズムにERβの関連が見出されました。最近では培養細胞系でエストロゲンシグナルを増強すると顔面肩甲上腕型筋ジストロフィーの病態を緩和できる可能性が報告されています。今後、本研究グループはERβやその下流シグナルを標的としたサルコペニアや筋ジストロフィーの病態解明と治療開発へ展開していく予定です。
用語解説
- ※1.エストロゲン:
- コレステロールから生成されるステロイドホルモンの1種。エストロン(E1)、エストラジオール(E2)、エストリオール(E3)の3種類がある。閉経まで卵巣でつくられるE2は生理活性が高く、エストロゲンとしての主要な効果を担う。若齢でも過酷なトレーニングや過度なダイエット等により栄養不足に陥ると無月経になり生成が低下する。
- ※2.サルコペニア:
- 加齢にともなう筋力・筋量減少症。80歳以上の後期高齢者の2人に1人は罹患していると推定されている。介助の必要のない自立した生活を送るために、サルコペニア発症の予防改善策を見出すことは喫緊の課題である。
- ※3.筋幹細胞:
- 別名サテライト細胞と呼ばれる。骨格筋は筋線維の束で構成されており、筋幹細胞は筋線維と基底膜の間に位置している。筋幹細胞は、通常、休止期の状態で存在しているが、筋損傷等の刺激が入ると速やかに活性化し、増殖後に筋分化することで筋線維を再生する。筋幹細胞は強力な筋再生能をもつため、筋疾患治療への応用が期待されている。
- ※4.速筋線維:
- 筋線維は、瞬発的に速く収縮ができるが疲労しやすい速筋線維と、瞬発性には欠けるが長時間持続的に収縮ができる遅筋線維の2種類に大きく分類される。速筋線維と遅筋線維は筋肉の中に混在しており、その割合は遺伝や運動習慣により異なる。
- ※5.siRNA:
- 21~23塩基対からなる短い二重鎖RNA。siRNAはRNA干渉という現象によって相補的な塩基配列をもつ遺伝子の発現を抑制する。siRNAは標的遺伝子を効果的に抑制できるため、表現型解析に有用である。
- ※6.幹細胞ニッシェ:
- 様々な幹細胞の固有の組織環境で、幹細胞の性質を維持し、組織再生などの機能を発揮するために重要。細胞の足場となるコラーゲンやラミニンなどの細胞外基質はニッシェの主要な構成要素。
- ※7.女性アスリートの3主徴:
- アメリカスポーツ医学会が提言した女性アスリートにみられる「利用可能なエネルギー不足」、「無月経」、「骨粗鬆症」を指す。長距離選手や審美性を競う新体操あるいはフィギュアスケート選手に多く認められる。
特記事項
本研究は、AMED(再生医療実現拠点ネットワークプログラム(幹細胞再生医学イノベーション創出プログラム)、難治性疾患実用化研究事業)、JSPS科研費、武田科学振興財団、上原記念生命科学財団、神澤医学研究振興財団、明治安田厚生事業団の助成を受け実施されました。
論文情報
- タイトル
- Estrogen receptor β controls muscle growth and regeneration in young female mice(エストロゲン受容体βは若齢雌マウスにおける骨格筋の成長と再生を制御する)
- 著者
- 瀬古大暉1、2#、藤田諒2、3、4#、北島百合子2、中村晃大1、今井祐記5、小野悠介1、2、6*
- 所属
-
- 熊本大学 発生医学研究所 筋発生再生分野
- 長崎大学 医歯薬学総合研究科
- マギル大学 人類遺伝学分野
- 筑波大学 トランスボーダー医学研究センター 再生医学分野
- 愛媛大学 プロテオサイエンスセンター 病態生理解析部門
- 熊本大学 大学院生命科学研究部附属 健康長寿代謝制御研究センター
#第一著者、*責任著者
- 掲載誌
- Stem Cell Reports
- DOI
- 10.1016/j.stemcr.2020.07.017
お問い合わせ先
本発表資料のお問い合わせ先
熊本大学発生医学研究所 筋発生再生分野
准教授 小野悠介
筑波大学医学医療系
トランスボーダー医学研究センター 再生医学分野
助教(卓越研究員) 藤田諒
AMED事業に関するお問い合わせ先
日本医療研究開発機構
再生・細胞医療・遺伝子治療事業部 再生医療研究開発課