2020-09-11 理化学研究所,日本医療研究開発機構
理化学研究所(理研)脳神経科学研究センターキャリア形成推進プログラムの前川素子上級研究員(同分子精神遺伝研究チーム研究員兼務)、分子精神遺伝研究チームの吉川武男チームリーダー、大西哲生副チームリーダーらの共同研究グループ※は、脂肪細胞型脂肪酸結合タンパク質FABP4[1]が自閉スペクトラム症[2](自閉症)のバイオマーカー[3]になり得る可能性を発見しました。
本研究成果は、自閉症の病態理解のためのバイオマーカー開発に向けた取り組みに貢献すると期待できます。
自閉症の詳しい病態を明らかにするために、自閉症の生物学的再分類[4]に役立つバイオマーカーの開発が望まれています。しかし今のところ、自閉症には臨床診断に役立つバイオマーカーが存在しません。
今回、共同研究グループは、定型発達児と自閉症児の血液サンプルを用いた解析により、低年齢の自閉症児では定型発達児と比較して血中のFABP4濃度が低いことを明らかにしました。また、自閉症のDNA検体を用いた遺伝子配列解析により、機能的変化につながるまれなFABP4遺伝子の変異を発見しました。さらに、Fabp4遺伝子破壊マウスは、自閉症類似の行動および組織学的特徴を示すことを明らかにしました。これらの結果から、FABP4が自閉症バイオマーカーになり得る可能性、FABP4の機能低下が自閉症の病態形成に関与する可能性が示されました。
本研究は、科学雑誌『Brain Communications』のオンライン版(2020年9月10日付:日本時間2020年9月11日)に掲載されます。
定型発達児および自閉症児の血中FABP4濃度の比較
背景
自閉スペクトラム症(自閉症)は、コミュニケーションや社会的相互作用の障害、興味と行動の偏り、知覚過敏や多動傾向を臨床的特徴とする神経発達障害の一つと定義されています。その発症率は近年増加傾向にあると言われており、平成26年の厚生労働省の調査では全国に19万5,000人の自閉症者(医療機関に通院又は入院している自閉症、アスペルガー症候群、学習障害、注意欠陥多動性障害などの総数)がいると報告されています。しかし、その詳しい病態についてはまだ分かっていません。自閉症の病態を明らかにし、新しい診断法や治療法の開発の取り組みに貢献するため、自閉症の生物学的再分類に役立つバイオマーカーの発見が望まれています。
自閉症の病態メカニズムの一つとして、脂質代謝異常が関連する可能性が知られています。コレステロール合成が障害されるスミス・レムリ・オピッツ症候群[5]の患者の約半数が自閉性障害を合併することや、脂肪酸が脳の発達や機能に関連することがその理由です。また、自閉症児において、脂肪組織が産生・分泌する生理活性物質(アディポカイン)の値の異常が繰り返し報告されていることも、自閉症と脂質代謝異常の関連を疑わせる重要な知見となっていました。
アディポカインの一つとして報告されている脂肪細胞型脂肪酸結合タンパク質(Adipocyte fatty acid binding protein 4:FABP4)は、分化した脂肪細胞の全タンパク質の6%を占める主要なタンパク質で、脂肪細胞から血中に分泌され、全身のインスリン感受性および脂質代謝や糖代謝に深く関わることが知られています。FABP4と精神疾患との関連については、最近の前川素子上級研究員らの研究から、FABP4遺伝子はヒトの脳にも発現していること、統合失調症[6]患者の毛根細胞においてFABP4遺伝子の発現が減少していることが分かっています注1)。また、前川上級研究員らは、同じFABPファミリーのうち、FABP3、5、7と統合失調症、自閉症との関連も明らかにしています注2-4)。しかし、FABP4と自閉症の関連についての報告はまだありませんでした。
注1)2014年9月12日理化学研究所プレスリリース「頭皮の毛根細胞を利用した精神疾患の診断補助バイオマーカーの発見」
注2)2014年7月14日理化学研究所プレスリリース「脂肪酸の機能に関わる遺伝子の変異が統合失調症・自閉症に関連する可能性」
注3)Maekawa et al., Polymorphism screening of brain-expressed FABP7, 5 and 3 genes and association studies in autism and schizophrenia in Japanese subjects. J Hum Genet. 2010 Feb;55(2):127-30. doi: 10.1038/jhg.2009.133.
注4)Iwayama et al., Association analyses between brain-expressed fatty-acid binding protein (FABP) genes and schizophrenia and bipolar disorder. Am J Med Genet B Neuropsychiatr Genet. 2010 Mar 5;153B(2):484-493. doi: 10.1002/ajmg.b.31004.
研究手法と成果
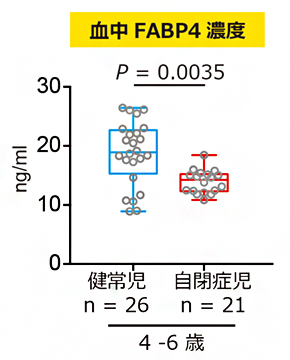
共同研究グループは、脂質代謝と自閉症病態メカニズムの関連を調べることを目的に、定型発達児と自閉症児の血液サンプルを用いて脂質代謝に関連する物質(FABP4、レプチン[7]、アディポネクチン、MCP-1[8]、インスリン、グルコース、遊離脂肪酸)の血中濃度を測定しました。身体の発達や置かれている社会環境の違いを考慮し、年齢グループごとに定型発達児と自閉症児を比較したところ、未就学児(4~6歳)のグループにおいて、自閉症児群でFABP4の血中濃度が有意に低いことが分かりました。さらに、より低年齢の幼児(2~4歳)グループでも、同様の結果が得られました(図1)。
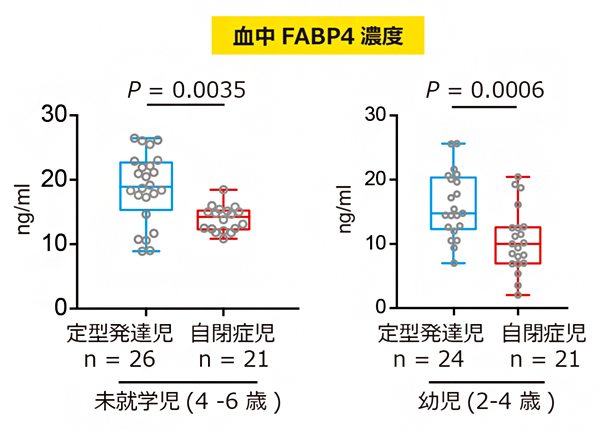
図1 定型発達児および自閉症児の血中FABP4濃度未就学児(4~6歳)、幼児(2~4歳)の年齢グループにおいて、自閉症児の血中FABP4濃度が定型発達児に比べて有意に低かった。
次に、FABP4遺伝子の機能異常が自閉症の病態形成につながる可能性を検討するため、日本人の自閉症患者(n=659)および健常者(n=1,000)のDNAサンプルを用いて、FABP4遺伝子の遺伝子配列解析を行いました。その結果、自閉症患者のサンプルから、ミスセンス変異[9]Thr8Ala 1例、ナンセンス変異[9]Trp98Stop 1例を同定しました(図2上段)。Thr8Ala変異については、ANS[10]と呼ばれる脂肪酸類似物質との結合能アッセイにより、Thr8Ala変異タンパク質では脂質結合能が影響を受けることが分かりました(図2下段左)。ナンセンス変異Trp98Stopについては、変異によってタンパク質の機能に重要な役割を果たす領域が欠けることが予想されました。また、家系解析を実施し、家系内で変異と精神疾患が共分離[11]することが明らかになりました(図2下段右)。一方、健常者サンプルでは機能的変化を起こすような変異は認められませんでした。
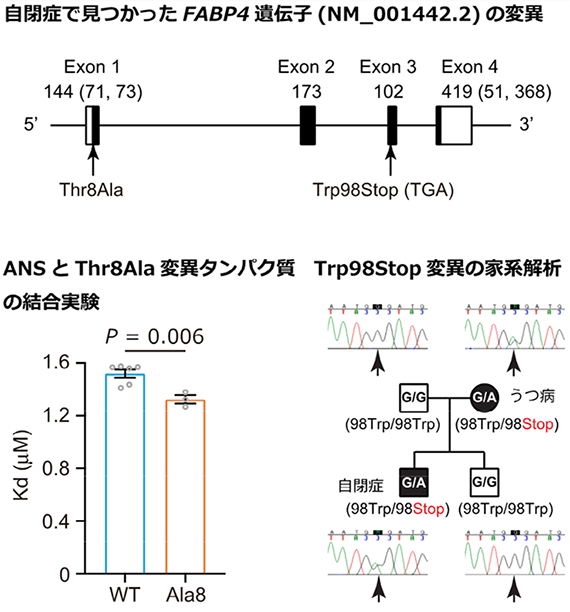
図2 自閉症患者のDNAサンプルで見つかったFABP4遺伝子の変異上段:自閉症患者のDNAサンプルにおいて、ミスセンス変異Thr8Ala 1例、ナンセンス変異Trp98Stop 1例を同定した。
下段左:Thr8Ala変異型FABP4タンパク質(Ala8)は、野生型FABP4タンパク質(WT)と比較して脂肪酸類似物質ANSとの結合能が増加した(Kd値が低いほど結合能が増加することを示す)。
下段右:自閉症児に見られたナンセンス変異Trp98Stopは、うつ病に罹患している母親から伝達されたものであることが判明した。このことから、この変異は精神疾患と「共分離」しているといえる。
また、FABP4の機能低下が自閉症の病態形成につながる可能性について、Fabp4遺伝子破壊マウスを用いて個体レベルで検証しました。精神疾患関連の行動解析を行った結果、Fabp4遺伝子を破壊すると、スリーチャンバーテスト[12]では社会的探索行動の減少が、モリス水迷路試験[13]では空間学習記憶の低下が、そして母仔分離の際の仔の超音波啼鳴試験[14]においては音声コミュニケーションの質的な障害が生じることが判明しました(図3)。これらの結果は、マウスにおいてFabp4遺伝子を破壊すると、自閉症に類似した行動表現型の変化が起こることを意味しています。
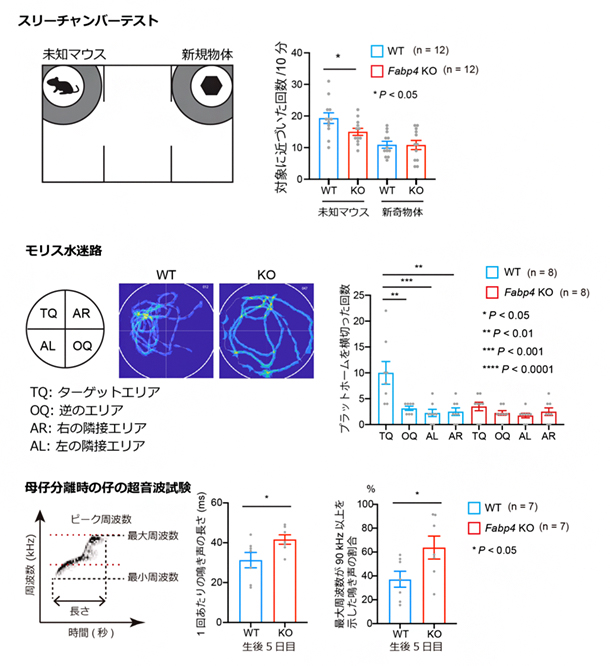
図3 Fabp4遺伝子破壊マウスの行動変化Fabp4遺伝子破壊マウス(Fabp4 KO)には、対照となる野生型マウス(WT)と比較して、スリーチャンバーテストにより社会的探索行動の減少、モリス水迷路試験により空間学習記憶の低下、母仔分離の際の仔の超音波測定により音声コミュニケーションの質的な障害が認められた。
さらに、過去に行われた解析で、自閉症患者の死後脳における大脳皮質の錐体細胞のスパイン[15]密度の増加が報告されていますが、Fabp4遺伝子破壊マウスの大脳皮質前頭前野の錐体細胞でもスパイン密度が上昇していることを見いだしました(図4)。Fabp4遺伝子破壊マウスは、組織学的にも自閉症類似の表現型を示すことが分かりました。
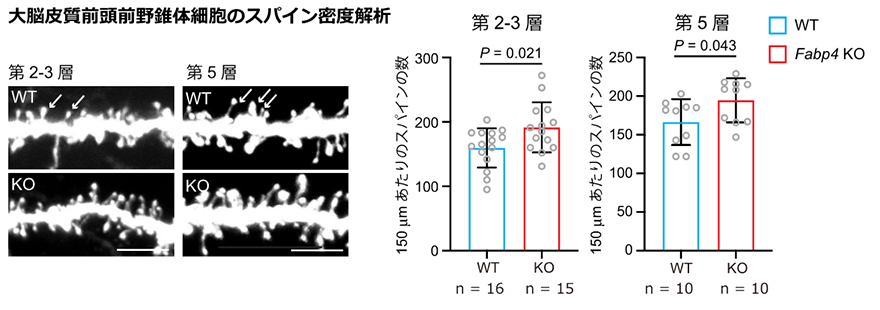 図4 Fabp4遺伝子破壊マウスのスパイン密度解析Fabp4遺伝子破壊マウス(Fabp4 KO)の大脳皮質前頭前野(第2-3層、第5層)の錐体細胞では、対照となる野生型マウス(WT)と比較してスパイン密度が増加した。白い矢印は、数えたスパインの一部を指している。
図4 Fabp4遺伝子破壊マウスのスパイン密度解析Fabp4遺伝子破壊マウス(Fabp4 KO)の大脳皮質前頭前野(第2-3層、第5層)の錐体細胞では、対照となる野生型マウス(WT)と比較してスパイン密度が増加した。白い矢印は、数えたスパインの一部を指している。
最後に、大脳皮質を用いて脂肪酸組成を解析したところ、Fabp4遺伝子破壊マウスでは野生型マウスと比較して、アラキドン酸、ドコサヘキサエン酸などの脂肪酸の割合が増加する一方、パルミチン酸、パルミトレイン酸などの割合は減少することを見いだしました(図5)。この解析から、FABP4の機能低下は、脳の脂肪酸の動態に影響を与え得ることが判明しました。
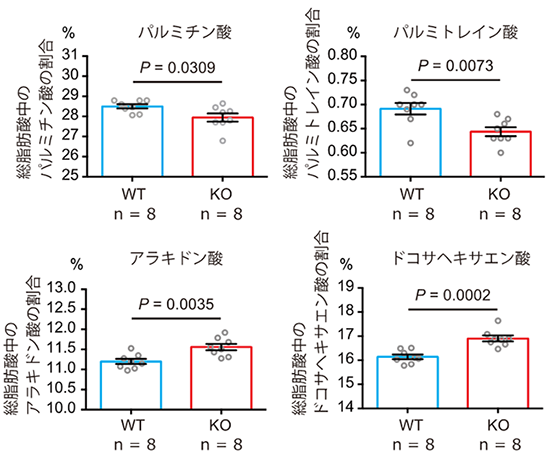
図5 Fabp4遺伝子破壊マウスの脳内の脂肪酸変化Fabp4遺伝子破壊マウス(KO)の大脳皮質では、対照となる野生型マウス(WT)と比べ脂肪酸の一種であるアラキドン酸、ドコサヘキサエン酸などの割合が増加する一方、パルミチン酸、パルミトレイン酸などの割合は減少していた。
今後の期待
今回、共同研究グループは、血中FABP4値が自閉症の早期バイオマーカーとして有用である可能性を見いだしました。この結果については、今後、より大規模なサンプルサイズで検討し、FABP4値の低下を伴う自閉症がどのような特性を持つのかを調べることで、自閉症の生物学的再分類に役立つバイオマーカーになり得るか、さらに詳しく調べたいと考えています。また、日本人以外のサンプルでも定型発達児と自閉症児の血中FABP4の濃度を調べていく必要があります。
また、今後、下記のような検討を通して、FABP4を起点とした自閉症病態メカニズム(図6)の理解を目指していきたいと考えています。
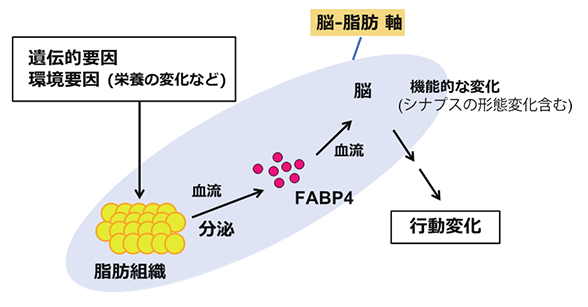
図6 FABP4を起点とした自閉症病態メカニズム自閉症病態メカニズムの一つとして、脂肪組織から分泌されたFABP4が脳の機能に影響を与える可能性が考えられる。
FABP4と自閉症病態メカニズムの関連については、脂肪組織から分泌されるFABP4が減少することで、血流を介して脳内の脂肪酸組成に影響し、その結果、さまざまな脳機能に影響を与えた可能性があり、Fabp4遺伝子破壊マウスを用いて詳細に解析する必要があります。また、自閉症患者の死後脳を用いて脂肪酸分析を行い、今回Fabp4遺伝子破壊マウスで見られたような脂肪酸組成の変動が起きているかについても調べる必要があります。
血中FABP4値が低下する原因については、自閉症児ではFABP4遺伝子の頻度の高い機能的変異が見つからなかったことから、環境要因の関与が考えられます。環境要因については、例えば、胎児期~出生頃の栄養状態が、エピジェネティクな変化[16]を介して、FABP4の発現に影響を与える可能性があり、今後、自閉症児の前向きコホート研究[17]やモデル動物を用いた研究を通じて、さらなる検討を行う必要があります。
論文情報
- タイトル
- A potential role of fatty acid binding protein 4 in the pathophysiology of autism spectrum disorder
- 著者名
- Motoko Maekawa, Tetsuo Ohnishi, Manabu Toyoshima, Chie Shimamoto-Mitsuyama, Kei Hamazaki, Shabeesh Balan, Yuina Wada, Kayoko Esaki, Shu Takagai, Kenji J Tsuchiya, Kazuhiko Nakamura, Yasuhide Iwata, Takahiro Nara, Yoshimi Iwayama, Tomoko Toyota, Yayoi Nozaki, Hisako Ohba, Akiko Watanabe, Yasuko Hisano, Shigeru Matsuoka, Masatsugu Tsujii, Norio Mori, Hideo Matsuzaki, Takeo Yoshikawa
- 雑誌
- Brain Communications
- DOI
- 10.1093/braincomms/fcaa145
補足説明
- [1]FABP4
- 脂肪酸結合タンパク質(fatty acid binding protein:FABP)ファミリーの一つで、脂肪酸と結合し、輸送する役割が知られている。脂肪組織に豊富に存在し、脂肪組織から血中に分泌される。また、末梢では他の臓器に作用する生理活性物質として知られており、メタボリックシンドロームとの関連が示されている。
- [2]自閉スペクトラム症
- 自閉スペクトラム症(自閉症)は、社会性障害、コミュニケーション障害、こだわり行動などを特徴とする、脳機能障害による発達障害。近年発症率が増加しており、厚生労働省が平成27年に公表した結果では、医療機関に通院または入院している患者(自閉症、アスペルガー症候群、学習障害、注意欠陥多動性障害など)の総数は19万5,000人と報告されている。
- [3]バイオマーカー
- ある特定の病気の存在や、病気の進行の程度を客観的に評価するために用いられる生体由来の指標。
- [4]自閉症の生物学的再分類
- 精神疾患は、その疾患に見られる症状を記述した診断基準に当てはまるかどうか面接で調べることによって診断されている。この方法では、原因の異なる疾患が見かけ上同じ疾患に分類される可能性が排除できない。この課題を改善するため、生物学的な基準によって疾患を再分類し、疾患の病態メカニズム解明に役立てようという考えがある。
- [5]スミス・レムリ・オピッツ症候群
- コレステロール合成酵素として知られる7-デヒドロコレステロール還元酵素をコードするDHCR7遺伝子の変異によって起こる症候群。コレステロール産生の低下が認められる。特徴的な症状として、成長障害、知的障害、自閉症の合併などが知られている。
- [6]統合失調症
- 幻覚や妄想、意欲の低下、感情の平板化などを主症状とする精神疾患。
- [7]レプチン
- 脂肪組織において産生・分泌される生理活性物質(アディポカイン)の一つ。視床下部に作用して、食欲の抑制に関わることが知られている。
- [8]MCP-1
- 脂肪組織において産生・分泌される生理活性物質(アディポカイン)の一つ。炎症部位に単球を誘導する。MCP-1は、Monocyte Chemotactic Protein-1の略。
- [9]ミスセンス変異、ナンセンス変異
- ミスセンス変異は、DNA中の塩基の置換によって、異なるアミノ酸への置換が起こる変異。ナンセンス変異は、塩基の置換によってアミノ酸のコドンがタンパク質鎖を終結させる終止コドンに置換され、タンパク質鎖の合成が途中で止まってしまう変異。
- [10]ANS
- 脂肪酸類似の蛍光プローブで、FABPに結合することによって蛍光を発する。ANSは8-Anilinonaphthalene-1-sulfonateの略。
- [11]共分離
- 家系内で、変異と表現型がまとまって伝達されること。その変異が疾患の原因になることの状況証拠の一つとなる。
- [12]スリーチャンバーテスト
- 自由に行き来ができる三つに区切られた部屋を用いて、マウスの行動を観察する試験。マウスの社会性などを調べられる。
- [13]モリス水迷路試験
- 水を入れた円形のプールを用いて、空間に配置した目印を頼りにゴールまでマウスを泳がせ、たどり着くまでの時間を測定する試験。空間学習記憶などを調べられる。
- [14]母仔分離の際の仔の超音波啼鳴試験
- 生後間もない仔マウスを母マウスから引き離すと、仔マウスは超音波帯の啼き声を発して母マウスに自分の居場所を知らせることが知られている。その際の超音波啼鳴を測定・評価する試験。仔マウスの音声コミュニケーション能力などを調べられる。
- [15]スパイン
- 神経細胞の樹状突起に存在する棘状の構造。シナプスの後部を形成する。
- [16]エピジェネティクな変化
- DNA塩基配列の変化を伴わない、核酸や核酸結合タンパク質の後天的な化学修飾による遺伝子発現の変化。
- [17]前向きコホート研究
- 特定の性質や条件を満たしたヒトの集団について、ある時点から未来へ向かって観察し、その期間に起きた出来事に関する情報を用いて疾患などとの関連を考察する研究。
-
※共同研究グループ
- 理化学研究所 脳神経科学研究センター
キャリア形成推進プログラム
上級研究員 前川素子(まえかわもとこ)(同分子精神遺伝研究チーム 研究員)
分子精神遺伝研究チーム
チームリーダー 吉川武男(よしかわたけお)
副チームリーダー 大西哲生(おおにしてつお)
研究員 豊島学(とよしままなぶ)
研究員 島本(光山)知英(しまもと・みつやまちえ)
研究員 シャビーシュ・バラン(Shabeesh Balan)
研究員 江崎加代子(えさきかよこ)
客員研究員 豊田倫子(とよたともこ)
テクニカルスタッフⅠ 大羽尚子(おおばひさこ)
テクニカルスタッフⅠ 久野泰子(ひさのやすこ)
テクニカルスタッフⅡ 渡辺明子(わたなべあきこ)
テクニカルスタッフ 野崎弥生(のざきやよい)
大学院生リサーチ・アソシエイト 和田唯奈(わだゆいな)
生体物質分析ユニット
専門技術員 岩山佳美(いわやまよしみ)
富山大学 医学部 公衆衛生学講座
准教授 浜崎景(はまざきけい)
浜松医科大学 医学部 児童青年期精神医学講座
教授 高貝就(たかがいしゅう)
浜松医科大学 子どものこころの発達研究センター
特任教授 土屋賢治(つちやけんじ)
弘前大学大学院医学系研究科 神経精神医学講座
教授 中村和彦(なかむらかずひこ)
医療法人社団木野記念会 福田西病院
院長 森則夫(もりのりお)
医師 岩田泰秀(いわたやすひで)
宮城県立こども病院
医師 奈良隆寛(ならたかひろ)
大分大学 医学部
特任准教授 松岡茂(まつおかしげる)
中京大学 現代社会学部
教授 辻井正次(つじいまさつぐ)
福井大学 子どものこころの発達研究センター 脳機能発達研究部門
教授 松﨑秀夫(まつざきひでお) -
研究支援
- 本研究は、日本医療研究開発機構(AMED)脳科学研究戦略推進プログラム「臨床と基礎研究の連携強化による精神・神経疾患の克服(融合脳)」の「エピジェネティク変化を介した核内受容体遺伝子発現制御による統合失調症病態メカニズム解明と治療法の開発(代表:前川素子)」「細胞内代謝・ダイナミクス制御から切り拓く発達障害・統合失調症の病理の解明・新規治療法の開発(代表:吉川武男)」、日本学術振興会(JSPS)科学研究費補助金基盤研究(C)「一細胞遺伝子発現解析の実現による統合失調症病態メカニズム解明と創薬への応用(研究代表者:前川素子)」、同新学術領域研究(研究領域提案型)「マルチスケール精神病態の構成的理解(領域代表者:林朗子、分担:吉川武男)」、公益財団法人先進医薬研究振興財団(前川素子)、による支援を受けて行われました。
原論文情報
- Motoko Maekawa, Tetsuo Ohnishi, Manabu Toyoshima, Chie Shimamoto-Mitsuyama, Kei Hamazaki, Shabeesh Balan, Yuina Wada, Kayoko Esaki, Shu Takagai, Kenji J Tsuchiya, Kazuhiko Nakamura, Yasuhide Iwata, Takahiro Nara, Yoshimi Iwayama, Tomoko Toyota, Yayoi Nozaki, Hisako Ohba, Akiko Watanabe, Yasuko Hisano, Shigeru Matsuoka, Masatsugu Tsujii, Norio Mori, Hideo Matsuzaki, Takeo Yoshikawa, “A potential role of fatty acid binding protein 4 in the pathophysiology of autism spectrum disorder”, Brain Communications, 10.1093/braincomms/fcaa145

発表者・機関窓口
発表者
理化学研究所 脳神経科学研究センター
キャリア形成推進プログラム
上級研究員 前川素子(まえかわもとこ)(同分子精神遺伝研究チーム 研究員)
分子精神遺伝研究チーム
チームリーダー 吉川武男(よしかわたけお)
副チームリーダー 大西哲生(おおにしてつお)
機関窓口
理化学研究所 広報室 報道担当
AMED事業について
国立研究開発法人日本医療研究開発機構
疾患基礎研究事業部 疾患基礎研究課