抗メタボ薬の候補としてアスピリンやEP4拮抗薬の新たな効能に期待
2020-10-14 熊本大学,日本医療研究開発機構
ポイント
- プロスタグランジン(PG)E2*1は、発熱や痛みを起こす生理活性脂質であり、アスピリン*2はPGE2産生を抑制することで解熱鎮痛作用を発揮します。
- PGE2の受容体の一つであるEP4は、食後にインスリンの刺激を受けて脂肪組織で活性化されることを見いだしました。
- EP4は、脂肪分解*3と線維化*4を促して肝臓への脂肪蓄積*5やインスリン抵抗性*6を高めることで、生活習慣病*7を招くことを発見しました(マウスでの成績)。
- EP4はヒトでも同様に働く可能性が高く、アスピリンやEP4拮抗薬でEP4の働きを弱めれば、生活習慣病の予防・治療に繋がることが期待されます。
概要説明
熊本大学大学院生命科学研究部杉本幸彦教授、稲住知明助教らの研究グループは、東京大学大学院医学系研究科村上誠教授、熊本大学大学院生命科学研究部猿渡淳二教授、尾池雄一教授、佐々木裕名誉教授、日本赤十字社熊本健康管理センター緒方康博名誉所長らとの共同研究により、脂肪組織で産生される生理活性脂質プロスタグランジン(PG)E2が、その受容体EP4を介して脂肪分解と線維化を促進し、肝臓への異所性脂肪の蓄積を引き起こして糖尿病などの生活習慣病の発症を促すことを世界で初めて明らかにし、本経路がヒトでも同様に働く可能性を示しました。本成果に基づき、アスピリンやEP4拮抗薬は、脂肪組織でのEP4の働きを弱め、生活習慣病の予防・治療に効果を発揮することが期待されます。
なお、本件研究成果をまとめた論文は、米国科学誌「Cell Reports」に令和2年10月13日(火)午前11時(米国東部標準時)付で掲載されました(日本時間令和2年10月14日(水)午前0時)。
説明
背景
脂肪組織は、過剰なエネルギーを貯蔵する組織であり、絶えず脂肪の合成と分解が行われ、両者のバランスで脂肪蓄積量が決まります。最近の研究で、脂肪組織の線維化によって脂肪細胞が脂肪を蓄積できなくなると、脂肪分解が進み、肝臓に異所性脂肪が蓄積し(脂肪肝)、インスリン抵抗性が引き起こされることがわかってきました。従って、脂肪分解の制御は代謝性疾患の成因を考える上で重要な要素となります。これまで、脂肪分解は絶食時に放出されるグルカゴン*8や、低温暴露で分泌されるエピネフリン*9によって促進されることが知られていましたが、他にどのような刺激で促進されるのかは不明でした。また脂肪組織の線維化はどのような制御を受けるのかについても不明でした。
研究の内容
本研究では、脂肪細胞の機能に影響を与えるPG受容体を同定するため、8種類のPG受容体欠損マウスを比較しました。その結果、受容体EP4欠損マウスは、白色脂肪*10組織(WAT)の重量が増加するものの、肝脂肪の蓄積が少なくインスリン感受性も高い「代謝健康肥満」の表現型を示しました(図1のA~E)。研究グループは、脂肪細胞特異的EP4欠損マウスやEP4作動薬*11を用いた一連の研究により、摂食時のインスリン刺激がWATのEP4経路を動かし、脂肪リパーゼ関連分子*12を介して脂肪分解を促進すること、また、EP4経路はコラーゲン*13の発現亢進によりWATの線維化を促進することを発見しました(図2)。つまり、摂食(インスリン)刺激がWATのEP4経路を活性化し、脂肪分解と線維化をともに促すことを見いだしました。このEP4の作用は、元来絶食から再摂食への個体の環境適応に寄与するものですが、現代の飽食環境においては、摂食の度にEP4が脂肪分解と線維化を亢進させ、糖尿病など生活習慣病の発症を招いてしまうと考えられます。さらに研究グループは、ヒトEP4発現量と相関する一塩基多型*14を同定し、EP4発現の低い人は非アルコール性脂肪肝*15に罹患しにくいこと、また脂肪肝患者では、EP4発現が低いと血中脂肪酸量も低く、脂肪分解が低く抑えられていることを発見しました(図1のF、G)。本知見は、ヒトでもEP4が脂肪分解を促して脂肪肝や糖尿病の発症を促す可能性を強く示唆するものです。
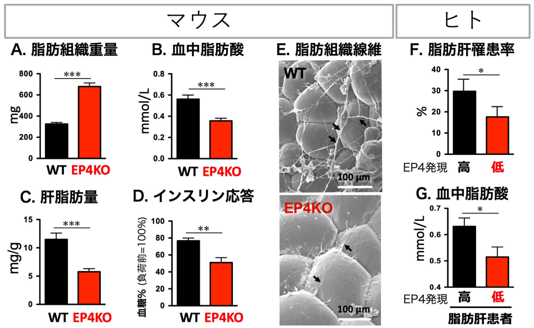
図1.EP4経路の減弱は「代謝健康肥満」を呈する
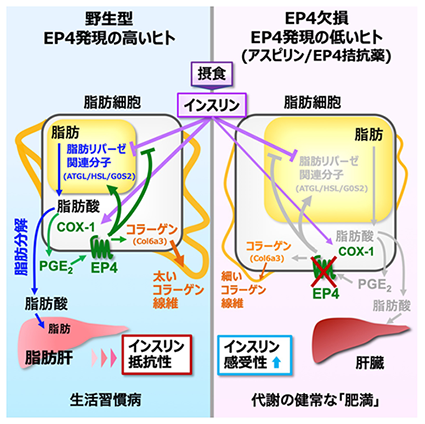
(右)EP4欠損やEP4発現の低いヒトでは、本経路減弱により脂肪分解レベルや肝脂肪量が低く抑えられる。アスピリンやEP4拮抗薬でEP4の働きを弱めれば、生活習慣病の予防・治療に繋がることが期待される。
成果
本研究は、脂肪肝や糖尿病の発症機構に関する新たな学術的理解を与えるとともに、摂食が生活習慣病を誘導する新しいメカニズムの一端を解明したものです。
展開
アスピリンやEP4拮抗薬は、脂肪組織でのEP4の働きを弱め、生活習慣病の予防・治療に効果を発揮することが期待されます。さらに今回同定したヒトEP4遺伝子の一塩基多型は、EP4が関与する疾患の予防や治療法の選択に有益なバイオマーカーとしての応用が期待されます。
用語解説
- *1 プロスタグランジンE2(Prostaglandin E2:PGE2)
- PGE2は最も代表的な生理活性脂質であり、発熱や痛覚過敏、炎症惹起など多彩な生理作用を発揮する。細胞が種々の刺激を受けるとホスホリパーゼA2(PLA2)により細胞膜リン脂質から脂肪酸の一種アラキドン酸が切り出される。アラキドン酸はシクロオキシゲナーゼ(COX)によりPG前駆体(PGH2)へと変換され、さらに、PGE合成酵素によりPGE2へ変換される(図3)。PGE2の作用は、Gタンパク質共役型受容体(GPCR)である4種類の受容体(EP1~EP4)を介して発揮されるが、EP4は細胞内cAMP産生亢進を介して種々の細胞応答を引き起こす。本研究では、脂肪細胞においては、ATGL/HSLリパーゼによる脂肪分解で遊離したアラキドン酸から、COX-1及びPGE合成酵素により、PGE2が産生されることを発見した。
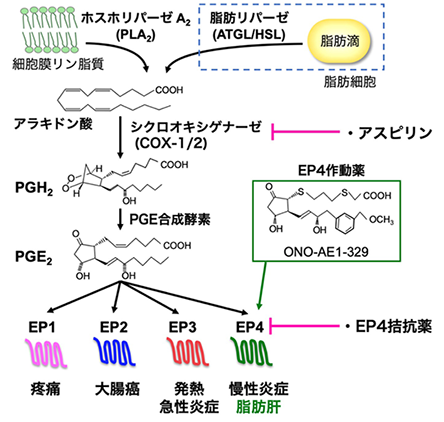
図3.プロスタグランジン(PG)E2の産生経路と4種類のEP受容体 細胞が刺激を受けるとPLA2が活性化され、細胞膜リン脂質からアラキドン酸が切り出される。アラキドン酸はシクロオキシゲナーゼ(COX-1・COX-2)によりPGH2へと変換され、さらに、PGE合成酵素によりPGE2に変換される。PGE2の作用は4種類のGPCRを介して発揮される。本研究で使用したEP4作動薬ONO-AE1-329の構造を示した。脂肪細胞では、ATGL/HSLによる脂肪分解で遊離したアラキドン酸から、COX-1(インスリン刺激で誘導)及びPGE合成酵素により、PGE2が産生されることを発見した。 - *2 アスピリン(Aspirin)
- アスピリンは、最も代表的な非ステロイド性抗炎症薬(Non-Steroidal Anti-Inflammatory Drugs:NSAIDs)であり、PG産生の律速酵素であるCOX(COX-1/2)を不可逆的に阻害し、PGの生合成を阻害することで解熱鎮痛抗炎症作用を発揮する。NSAIDsとしては他にインドメタシンやイブプロフェン、ジクロフェナクなど多くの薬物が存在し、セレコキシブなどCOX-2選択的な阻害薬も存在する。
- *3 脂肪分解(Lipolysis)
- 脂肪組織は、過剰なエネルギーを脂肪として貯蔵する組織であり、脂肪酸とグリセロールを基質とした脂肪の合成反応とリパーゼによる脂肪の分解反応を行い、両反応のバランスで脂肪蓄積量が決定される。脂肪分解は、グリセロールの水酸基にエステル結合した三つの脂肪酸(アシル基)が一つずつ外されていく反応であり、第一、第二の脂肪酸遊離を担うリパーゼ、ATGLとHSLを律速酵素として反応が進む。*11も参照のこと。
- *4 線維化(Fibrosis)
- 臓器が何らかの原因で機能不全に陥ると、その機能回復のための適応機構の一つとして、線維芽細胞が細胞外マトリクスであるコラーゲン線維を産生・分泌することが知られる。こうしたコラーゲン線維の集積で組織が堅くなることを線維化と呼ぶ。
- *5 肝臓への(異所性)脂肪蓄積、*6 インスリン抵抗性(Insulin resistance)
- 脂肪は本来、脂肪組織中の脂肪細胞に蓄積されるが、脂肪組織の線維化や他の理由で脂肪分解が進むと、遊離脂肪酸が血液を介して各組織に運搬され、本来存在するべきでない肝臓や他の内臓に異所性に蓄積し、脂肪毒性を発揮して臓器間ネットワーク機構に障害をもたらす。その代表例がインスリン抵抗性であり、筋肉や肝臓のインスリン応答性が低下して血糖をうまく取込むことができなくなるため、糖尿病の発症に繋がる。
- *7 生活習慣病(Lifestyle diseases)
- 糖尿病、脂質異常症、高血圧など、生活習慣が発症原因に関与していると考えられる疾患の総称であり、かつては成人病と呼ばれた。これら疾患と肥満が複合している場合にはメタボリックシンドロームと総称される。広義では脳血管疾患や心臓病なども生活習慣との関わりが深いため、生活習慣病に含まれて用いられることも多い。
- *8 グルカゴン(Glucagon)
- 主に膵臓のランゲルハンス島α細胞で産生されるホルモンで、血糖を増加させる働きをもつ。肝臓では糖新生を高めるとともに、グリコーゲン分解を促進する。脂肪細胞に対しては、脂肪分解を促進して遊離脂肪酸の放出を高める。
- *9 エピネフリン(Epinephrine)
- 副腎皮質から分泌されるホルモンであり、アドレナリン(adrenaline)とも呼ばれる。交感神経による興奮性応答を引き起こし、心血管系を介した運動機能亢進を誘発する。褐色脂肪組織の脂肪細胞に存在するβ3受容体に作用すると、脂肪分解を促進して遊離脂肪酸産生を高めるとともに、脱共役タンパク質(UCP-1)を産生し、ミトコンドリアでの熱産生応答を引き起こす。*10も参照のこと。
- *10 白色脂肪(White adipose)
- 脂肪細胞は、脂肪を貯蔵する白色脂肪細胞と脂肪を燃焼する褐色脂肪細胞に分類される。白色脂肪細胞は単一の巨大脂肪滴を持ち、局在により内臓脂肪と皮下脂肪に分けられる。内臓脂肪の蓄積は生活習慣病の要因となる。褐色脂肪細胞はミトコンドリアと小型の脂肪滴を豊富に含んでおり、肩甲骨近傍の褐色脂肪組織に分布する。褐色脂肪細胞は脂肪を活発に分解し、ミトコンドリア内膜に存在する脱共役タンパク質(UCP-1)を使って熱を産生する。
- *11 EP4作動薬(EP4 agonist)
- 複数の製薬会社において、クローン化EP4受容体を用いて探索開発されたEP4を特異的に活性化する化合物。本研究では小野薬品工業株式会社から供給されたONO-AE1-329(図3)を使用した。他にも、L-902,688、CAY-10598などがある。
- *12 脂肪リパーゼ関連分子
- 脂肪細胞における脂肪分解の律速酵素は、脂肪であるトリグリセリドをジアシルグリセロールに変換するATGL(Adipose triglyceride lipase)、ジアシルグリセロールをモノアシルグリセロールに変換するHSL(Hormone-sensitive lipase)であり、前者は主として遺伝子発現によって、後者はプロテインキナーゼ-Aによるリン酸化で活性が制御される。前者はまた特異的な阻害タンパク質G0s2(G0/G1 switch protein 2)によって活性制御を受けている。EP4受容体はcAMP産生を介して、これら三種類の脂肪リパーゼ関連分子を制御することで、すなわちATGLの発現誘導、HSLのリン酸化(活性化)、G0s2の発現抑制により、脂肪分解を促進する。
- *13 コラーゲン(Collagen)
- 生体に存在する最も代表的な細胞外マトリクスタンパク質である。ポリペプチド三本が左巻の三重らせんを形成して線維を形成する。脂肪細胞のEP4経路によって発現が促進するのはVI型コラーゲンCol6a3であり、これはマイクロフィブリル(細線維)を形成するコラーゲンである。
- *14 一塩基多型(Single Nucleotide Polymorphism:SNP)
- ある生物の遺伝子配列上に見られる一塩基の変異で、通常集団の1%以上の頻度のものを一塩基多型(SNP)と呼ぶ。ヒトSNP情報の多くはデータベース化されており、遺伝子産物の欠失や機能変化を来したり、タンパク質発現量やmRNA安定性に影響したりするものがある。本研究で注目したSNPは、EP4遺伝子の5’-上流域に存在するrs4495224で、 日本人では約4割がEP4発現の低いタイプ、約6割がEP4発現の高いタイプと考えられた。
- *15 非アルコール性脂肪肝(Non-Alcoholic Fatty Liver Disease:NAFLD)
- 非アルコール性脂肪性肝疾患とも呼ばれる疾患で、飲酒歴の有無に関わらず、肝細胞中に中性脂肪が蓄積することで脂肪毒性を発揮し、肝障害をきたす疾患の総称である。インスリン抵抗性や脂質異常症、2型糖尿病などの生活習慣病との相関が示唆されている。
研究プロジェクトについて
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMED-CREST)「疾患における代謝産物の解析および代謝制御に基づく革新的医療基盤技術の創出」研究開発領域における研究開発課題「PLA2メタボロームによる疾患脂質代謝マップの創成とその医療展開に向けての基盤構築」(研究開発代表者:村上誠)、革新的先端研究開発支援事業ステップタイプ(FORCE)(研究開発代表者:村上誠)および日本学術振興会科学研究費補助金(新学術領域研究・基盤研究)の一環として行われました。
論文情報
- 論文名
- “Prostaglandin E2-EP4 axis promotes lipolysis and fibrosis in adipose tissue leading to ectopic fat deposition and insulin resistance”
- 著者
- Tomoaki Inazumi, Kiyotaka Yamada, Naritoshi Shirata, Hiroyasu Sato, Yoshitaka Taketomi, Kazunori Morita, Hirofumi Hohjoh, Soken Tsuchiya, Kentaro Oniki, Takehisa Watanabe, Yutaka Sasaki, Yuichi Oike, Yasuhiro Ogata, Junji Saruwatari, Makoto Murakami, Yukihiko Sugimoto
- 掲載誌
- Cell Reports
- doi
- 10.1016/j.celrep.2020.108265
お問い合わせ先
熊本大学大学院生命科学研究部(薬)
担当:杉本幸彦
AMED事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構(AMED)
シーズ開発・研究基盤事業部 革新的先端研究開発課