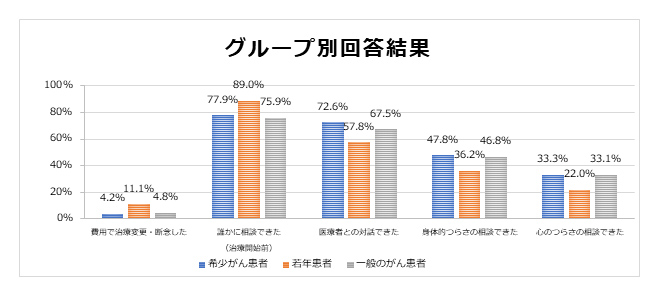
2020-10-13 大阪国際がんセンター
地方独立行政法人 大阪府立病院機構 大阪国際がんセンター(以下、当センター) 研究所・糖鎖オンコロジー部は、がんの進行を引き起こす物質の入っているナノサイズの小さな袋(細胞外小胞=EV、以下、EV)※1を放出する仕組みを解明しました。本研究の成果は、EVによるがんの進行のメカニズムの解明と、EVを標的としたがんの治療法の開発に貢献すると考えられます。本研究は、鹿児島大学大学院医歯学総合研究科(システム血栓制御学講座、皮膚科学分野、呼吸器内科学分野)、藤田医科大学(共同利用研究設備サポートセンター)、理化学研究所(環境資源科学研究センター 生命分子解析ユニット、開拓研究本部 鈴木糖鎖代謝生化学研究室)との共同研究によるもので、2020年10月13日、米国の学術誌『Cell Reports』オンライン版に掲載されました。
がんは、さまざまな物質の作用で増殖や転移がおこり、進行すると考えられてきました。近年、その物質が入っているEVが、がん細胞から全身にばらまかれることで、がんの増殖や転移が促進されることが明らかになり、このEVを抑え込むことががんの治療につながると期待が高まっています。EVには、大きさや成分が異なるいくつかの種類が存在し、その中でも、エクソソームというEVががんの増殖や転移と関連すると言われて、これまでは研究の中心でした。
一方、エクソソームとは別種のEV(非エクソソーム)もがんの進行に関わる物質を含んでいますが、これまで詳細な役割は分かっていませんでした。
このような背景の中、共同研究チームはがん細胞の小胞体※2において、タンパク質の構成成分であるアスパラギンというアミノ酸に糖鎖が付くことで※3エクソソームと異なるEVを選択的に作り出していることを突き止めました【補足図】。この仕組みを利用することで、このEVの放出をコントロールすることができ、ひいては将来のがん治療への応用が期待できます。
これまでにも、タンパク質の構成成分である別のアミノ酸に糖鎖が付くことが※4、マイクロベシクルと呼ばれるEVの形成に関わると報告されています。本研究を含めて、糖鎖の付き方がEVの作り分けに関わる普遍的な仕組みの一つである可能性が示されました。
多様なEVが作られる仕組みをさらに理解していくことで、EVが関わる生命現象や疾患の発症メカニズムの理解が進むとともに、EVを標的とした疾患の治療法の開発に貢献することが期待されます。
【用語説明】
※1 Extracellular vesicleの略。大きさが数十ナノメートルから数千ナノメートルの微細な小胞。ナノメートルは、10億分の1メー
トル。
※2 細胞内小器官の1つ。細胞から分泌されたり、細胞の表面に発現したりするタンパク質の合成の場。
※3 小胞体で合成される分泌タンパク質や膜タンパク質中の特定のアスパラギン残基に糖鎖が付加される。
※4 分泌タンパク質や膜タンパク質中のセリンもしくはスレオニン残基に糖鎖が付加される。
<補足資料>
共同研究チームは、がん細胞は、増殖するために解糖系※5と呼ばれる代謝経路を活性化して多量のブドウ糖(グルコース)を消費することに着目し、ワールブルグ効果※6と呼ばれる解糖系の異常な活性化が多様なEVを作り出す原動力になっているのではないかと仮説を立てました。
ワールブルグ効果を抑える作用を持つ2-デオキシグルコースというグルコースに似た薬剤をがん細胞に投与すると、EVの分泌量が半分程度に減少することが分かりました。EVに含まれるタンパク質成分の幅広い範囲での解析から、2-デオキシグルコースはエクソソームやエクソミアの分泌には影響せずに、新種のEVの分泌を減少させることが分かりました。本研究で見つけたEVは、エクソソームと大きさがよく似ているものの、タンパク質成分が異なることから、暫定的に非エクソソーム小胞と名付けました。ところが、2-デオキシグルコースとは異なる手法を用いてワールブルグ効果を抑えても、非エクソソーム小胞の分泌量は減りませんでした。これらのことから、2-デオキシグルコースは、ワールブルグ効果の抑制とは異なるメカニズムで非エクソソーム小胞の分泌を減らしている可能性が示されました。
続いて、2-デオキシグルコースの作用メカニズムを詳細に解析した結果、この薬剤の代謝産物が、小胞体で起こるタンパク質のアスパラギン(N)結合型糖鎖修飾を抑制していることを突き止めました。そこで、N結合型糖鎖修飾が非エクソソーム小胞の分泌に関わるかどうかを明らかにする目的で、N結合型糖鎖修飾を直接的に抑制する薬剤をがん細胞に投与すると、エクソソームやエクソミアに影響することなく非エクソソーム小胞の分泌量が減少しました。さらに、N結合型糖鎖修飾は特定のタンパク質を非エクソソーム小胞に積み込む過程に関与することも分かりました。これらの結果から、がん細胞はN結合型糖鎖修飾を利用して非エクソソーム小胞を選択的に作り出していることが分かりました【補足図】。
※5 細胞が取り込んだグルコースの主要な代謝経路。エネルギーの産生だけでなく、核酸や糖鎖の合成材料の産生にも関わる。
※6 好気的な環境でも解糖系によるグルコース代謝が亢進する現象。
【補足図】

【共同研究グループ】
大阪国際がんセンター 研究所 糖鎖オンコロジー部
チームリーダー 原田 陽一郎
研究員 大川 祐樹
研究所長兼部長 谷口 直之
藤田医科大学 共同利用研究設備サポートセンター
講師 中嶋 和紀
鹿児島大学大学院医歯学総合研究科 システム血栓制御学講座
特任教授 丸山 征郎
皮膚科学分野
技能補佐員 福重 智子
教授 金蔵 拓郎
呼吸器内科学分野
大学院生 近藤 清貴
教授 井上 博雅
理化学研究所 環境資源科学研究センター 生命分子解析ユニット
専任技師 鈴木 健裕
ユニットリーダー 堂前 直
開拓研究本部 鈴木糖鎖代謝生化学研究室
テクニカルスタッフI 清野 淳一
主任研究員 鈴木 匡
【研究支援】
本研究は、日本学術振興会(JSPS)科学研究費補助金基盤研究(C)「がんエクソソームの分泌におけるワールブルグ効果の役割の解明(研究代表者:原田陽一郎)」の支援を受けて行われました。
【原著論文情報】
Yoichiro Harada, Kazuki Nakajima, Takehiro Suzuki, Tomoko Fukushige, Kiyotaka Kondo, Junichi Seino, Yuki Ohkawa, Tadashi Suzuki, Hiromasa Inoue, Takuro Kanekura, Naoshi Dohmae, Naoyuki Taniguchi and Ikuro Maruyama, “Glycometabolic regulation of the biogenesis of small extracellular vesicles”, Cell Reports, 10.1016/j.celrep.2020.108261
【お問い合わせ先】
事務局 総務・広報グループ