2020-10-16 国立精神・神経医療研究センター,浜松医科大学,神奈川県立こども医療センター
国立研究開発法人 国立精神・神経医療研究センター(NCNP)神経研究所疾病研究第2部の李コウ研究員や井上健室長らの研究グループは、浜松医科大学医化学講座才津浩智教授、神奈川県立こども医療センター遺伝科黒澤健司部長、熊本再春医療センターとの共同研究により、小児の遺伝性神経難病である先天性大脳白質形成不全症の1つ、Pol III関連白質変性症(Pol III-associated leukodystrophies)の新たな病態メカニズムを見出しました。
髄鞘(ミエリン)は、脳の神経細胞からの指令となる電気信号を次の神経細胞に伝える軸索の周囲を巻く膜様構造物で、絶縁体として働くことで、この指令を素早く的確に伝える脳の情報ネットワークの機能に重要な働きをします。先天性大脳白質形成不全症*1は、この髄鞘が十分に形成されないために、乳幼児期から運動および認知の発達に著しい遅れを引き起こす小児の神経難治性疾患です。わが国での患者数は220人ほどと推定されています1)。先天性大脳白質形成不全症の1つであるPol III関連白質変性症は、原因遺伝子としてPOLR3A、POLR3B、POLR1Cの3つが知られており、これらの遺伝子産物が構成するRNAポリメラーゼIII(Pol III)*2の機能不全が本疾患の原因と考えられています。しかし、なぜすべての細胞の根本的な生存維持に必須であるPol IIIの異常が髄鞘の形成を妨げるのか、そのメカニズムは全くわかっておりません。今回、井上室長らのグループは、原因不明の先天性大脳白質形成不全症1家系からPOLR1C遺伝子の新規の変異を同定しました。さらに培養細胞や患者由来末梢血を用いた発現解析を行なった結果、Pol III関連白質変性症の新たな細胞病態として標的遺伝子のスプライシング*3の異常を引き起こす可能性を明らかにしました(図1)。
本研究成果は米国東部標準時間2020年10月13日に、米国のオンライン総合学術雑誌「Neurology Genetics」に掲載されました。
研究の背景
頭部MRI画像検査で典型的な髄鞘形成不全を呈する所見を示す症例の中には、特異的診断をつけることが困難である症例が少なからずあります。これらの症例の中から、本センター小児神経科の佐々木征行部長らは2009年に髄鞘形成不全に小脳萎縮と脳梁低形成を合わせもつ一群を新たな疾患として報告しました2)。類似の疾患は、同時期に他の研究者からも報告されており、それらの異同が論議されていましたが、2011年に原因遺伝子としてPol III複合体の主要な構成タンパク質であるPOLR3AおよびPOLR3Bをコードする遺伝子の変異がこれらの疾患の原因として同定され3-5)、Pol III関連白質変性症として疾患概念が確立されました。さらに2015年に同複合体の構成タンパク質の1つをコードするPOLR1C遺伝子の変異も同定されました6)。近年、これら3つの遺伝子変異をもつPol III関連白質変性症の症例の報告が増えており、臨床像の多様性も明らかになってきました。
Pol IIIは、トランスファーRNA(tRNA)、5S リボゾームRNA(rRNA)、U6核内低分子RNA(snRNA)など小さなRNAの転写を担うRNAポリメラーゼで、生体内のほぼすべての細胞に発現され、細胞機能の根幹となる作用を担っておりますが、なぜその機能の欠損が脳の髄鞘形成不全という特異的な現象を起こすのか、その分子病態については全く解明されておりません。
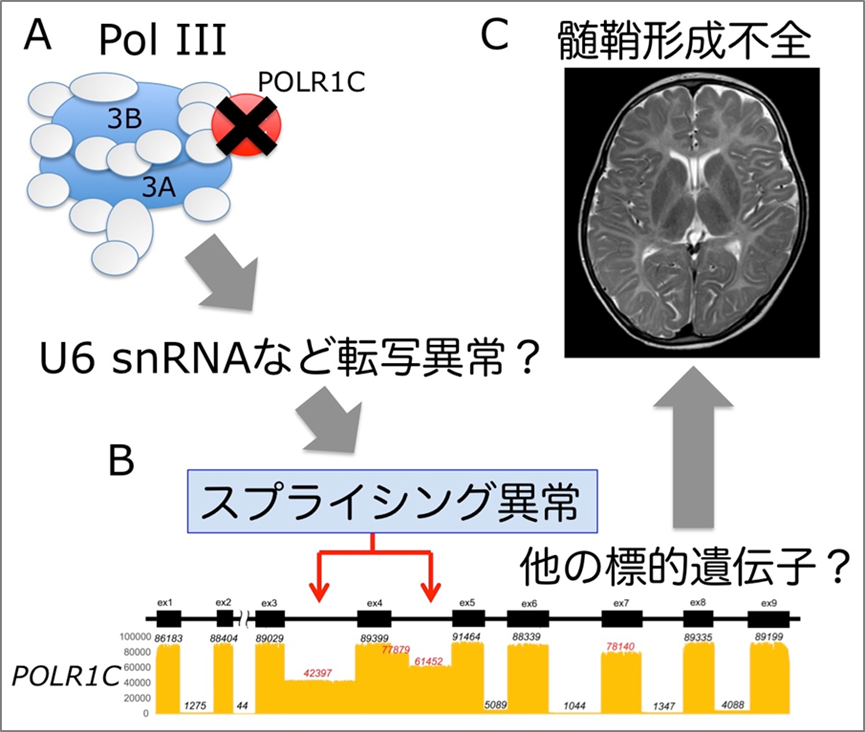
図1 A. Pol III複合体の構成員の1つPOLR1Cの変異により、Pol IIIに機能障害を来たし、U6snRNAなどの転写に異常をきたすことが推測される。これらのRNA分子は遺伝子のスプライシングの制御に関与していることが知られている。B. 実際にPOLR1C変異を持つ患者細胞では、スプライシイング異常(上段:黒ボックスはエクソン、黒線はイントロンを示す。下段:ロングリードシーケンスの結果、メッセンジャーRNAに通常はないイントロン部分[赤矢印]が多く含まれている)が検出され、同様のスプライシング異常は他の遺伝子でも生じている可能性が高い。C. 本症例の頭部MRI画像は、典型的な髄鞘形成不全を示す。どのような遺伝子のスプライシング異常がこの髄鞘形成不全を引き起こすのか、今後、iPS細胞を用いた解析などにより解明されることが期待される。
研究の概要
今回の研究は、2016年に熊本再春医療センターからの1例の患者さんの診断に関する相談から始まりました。井上室長らは以前より「PMDと類縁疾患に関するネットワーク」というウェブサイト7)を通じて、診断に難渋している先天性大脳白質形成不全症の患者さんに関する診断コンサルテーションを研究班として実施しており、本症例もここで相談を受けました。患者さんの脳MRIでは、広範な髄鞘化不全を認めたため、原因不明の先天性大脳白質形成不全症と考え、メンデル遺伝病パネルエクソーム解析*4を実施したところ、POLR1C遺伝子に疾患の原因と思われる変異を見つけました。正常とは異なるアミノ酸配列に変化させる2つの変異は、それぞれ両親から1つずつ引き継いでおり、複合ヘテロ接合体*5であることを確認しました。
さらにこれらの変異がどのようにPOLR1Cタンパク質の機能障害を引き起こすのかを検証するために、培養細胞や患者さんの末梢血細胞を用いてPOLR1C遺伝子およびタンパク質の発現解析を実施しました。その結果、それぞれ1箇所のアミノ酸の変異をもつPOLR1Cタンパク質は細胞内での分布が異常になることがわかりましたが、それ以外にスプライシング異常によりイントロン部分を含む異常なPOLR1CメッセンジャーRNA(mRNA)が存在することがわかりました。このスプライシングの異常を詳細に検討するために、近年可能になったロングリードシーケンシング*6を用いた全長のPOLR1CmRNA解析を実施しました(図1)。その結果、患者では85%以上の転写産物にスプライシング異常があることがわかりました。また、健常な保因者である両親でも同様の解析を行ったところ、両親ともに同様のスプライシング異常を認めました。さらに驚いたことにこのスプライシング異常は変異を持たない正常のPOLR1C遺伝子アレル*7にも生じていることが判明しました(図2)。
もしPOLR1C変異が自身のスプライシング異常を直接引き起こしていると仮定すると、両親での変異のないPOLR1C遺伝子アレルにスプライシング異常が存在することを説明できません。むしろ、変異によってPol IIIタンパク質の機能が損なわれた結果、本来PolIIタンパク質によって正常に転写されるはずのRNAに異常をきたし、その影響がPOLR1C遺伝子自身を含む標的遺伝子のスプライシング制御に異常をもたらしたと考えられます(図1)。これらの結果から、Pol IIIの生理的機能の1つとして、U6snRNAなどの標的RNAの転写調節を介して様々な遺伝子のスプライシングを制御していると考えられました。そして、その構成要因であるPOLR1Cの変異よってスプライシング制御の異常をきたすことがPol III関連白質変性症を引き起こしている可能性が示唆されました。
これまでPol III関連白質変性症の病態機序は全くわかっておりませんでしたが、今回の研究によりスプライシング制御の異常がその一端を担っていると推測されました。
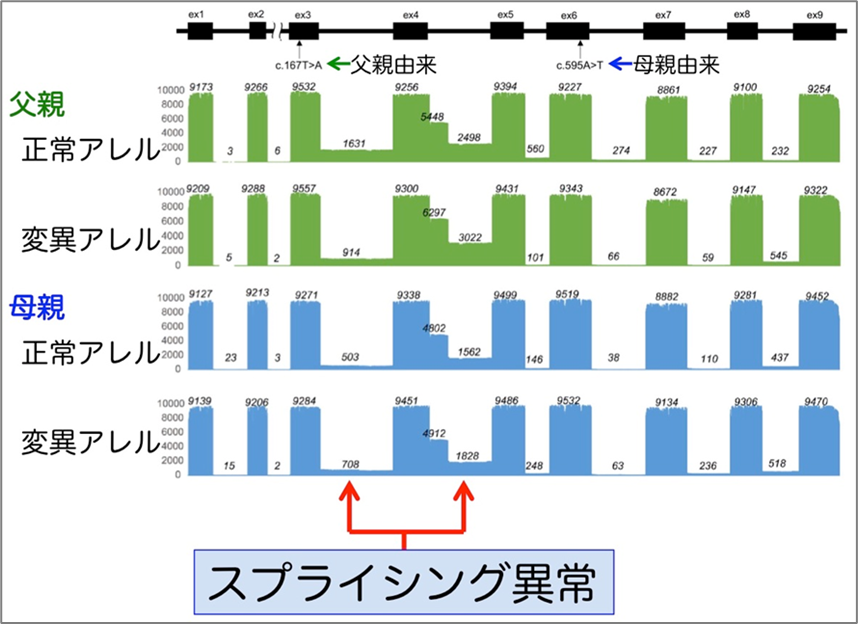
図2 両親のPOLR1CmRNAの解析結果。父親(緑)、母親(青)ともに変異の有無に関わらず、スプライス異常を同程度に認めた。もし変異アレルのみにスプライス異常がある場合は変異がその直接の原因であることが推測されるが、正常アレルにもスプライス異常があるため、スプライシング機構そのものに変化をきたしていることが推測される。
今後の展望
今回の研究結果は、Pol III関連白質変性症の病態解明の第一歩となると考えられますが、本疾患の理解と克服のためには、まだ解明しなければならない課題が数多く存在します。具体的には、髄鞘形成を担うオリゴデンドロサイト*8でどのような遺伝子がPol IIIによるスプライシング制御を受けているのかを明らかにする必要があります。研究グループでは今後、POLR1C遺伝子変異を持つ患者さんの血液細胞由来のiPS細胞を樹立し、これを用いた解析を進めることで、今回明らかになったスプライシング異常が髄鞘化の障害を引き起こすメカニズムを解き明かすことを目指しています。またPOLR1C以外のPol III関連白質変性症の原因遺伝子(POLR3AおよびPOLR3B)でも共通した病態が存在するのか、解析を進めていく予定です。これらの病態メカニズムを明らかにすることで、本疾患の治療標的分子を明らかにし、今後の治療に繋げることができると期待されます。
参考文献
1)Numata Y, Gotoh L, Iwaki A, Kurosawa K, Takanashi JI, Deguchi K, Yamamoto T, Osaka H, Inoue K. Epidemiological, clinical, and genetic landscapes of hypomyelinating leukodystrophies. J Neurol. 2014; 261(4):752-8. DOI: 10.1007/s00415-014-7263-5</li>
2)Sasaki M, Takanashi J, Tada H, Sakuma H, Furushima W, Sato N. Diffuse cerebral hypomyelination with cerebellar atrophy and hypoplasia of the corpus callosum. Brain Dev. 2009 Sep;31(8):582-7. doi: 10.1016/j.braindev.2008.09.003.
3)Bernard G, Chouery E, Putorti ML, Tétreault M, Takanohashi A, Carosso G, Clément I, Boespflug-Tanguy O, Rodriguez D, Delague V, Abou Ghoch J, Jalkh N, Dorboz I, Fribourg S, Teichmann M, Megarbane A, Schiffmann R, Vanderver A, Brais B. Mutations of POLR3A encoding a catalytic subunit of RNA polymerase Pol III cause a recessive hypomyelinating leukodystrophy. Am J Hum Genet. 2011;89(3):415-23. doi: 10.1016/j.ajhg.2011.07.014.
4)Saitsu H, Osaka H, Sasaki M, Takanashi J, Hamada K, Yamashita A, Shibayama H, Shiina M, Kondo Y, Nishiyama K, Tsurusaki Y, Miyake N, Doi H, Ogata K, Inoue K, Matsumoto N. Mutations in POLR3A and POLR3B encoding RNA Polymerase III subunits cause an autosomal-recessive hypomyelinating leukoencephalopathy. Am J Hum Genet. 2011;89(5):644-51. doi: 10.1016/j.ajhg.2011.10.003.
5)Tétreault M, Choquet K, Orcesi S, Tonduti D, Balottin U, Teichmann M, Fribourg S, Schiffmann R, Brais B, Vanderver A, Bernard G. Recessive mutations in POLR3B, encoding the second largest subunit of Pol III, cause a rare hypomyelinating leukodystrophy. Am J Hum Genet. 2011;89(5):652-5. doi:10.1016/j.ajhg.2011.10.006.
6)Thiffault I, Wolf NI, Forget D, Guerrero K, Tran LT, Choquet K, Lavallée-Adam M, Poitras C, Brais B, Yoon G, Sztriha L, Webster RI, Timmann D, van de Warrenburg BP, Seeger J, Zimmermann A, Máté A, Goizet C, Fung E, van der Knaap MS, Fribourg S, Vanderver A, Simons C, Taft RJ, Yates JR 3rd, Coulombe B, Bernard G. Recessive mutations in POLR1C cause a leukodystrophy by impairing biogenesis of RNA polymerase III. Nat Commun. 2015;6:7623. doi:10.1038/ncomms8623.
7)先天性大脳白質形成不全症:PMDと類縁疾患に関するネットワークhttp://plaza.umin.ac.jp/~pmd/
用語解説
*1先天性大脳白質形成不全症:小児の遺伝性神経難病の1つで、指定難病の1つ。遺伝性の原因により脳をはじめとする中枢神経系の髄鞘がうまく形づくられないために運動や知的な発達に著しい障害をきたす疾患の一群。
*2RNAポリメラーゼIII:DNAからRNAを転写する際に必要なタンパク質の複合体で、ヒトでは3種類あるRNAポリメラーゼのうちトランスファーRNA(tRNA)、5SリボゾームRNA(rRNA)、U6核内低分子RNA(snRNA)など小さなRNAの転写を担当する。
*3スプライシング:遺伝子がDNAからメッセンジャーRNAに翻訳される際に、主にタンパク質をコードするエクソンのみを残し、タンパク質をコードしないイントロンは取り除かれること。今回明らかになったスプラシングの異常ではこのイントロンの一部が取り除かれずに残ってしまうため、正常なタンパク質を作ることができなくなると考えられる。
*4メンデル遺伝病パネルエクソーム解析:主なメンデル遺伝形式をとる疾患原因遺伝子の変異を探索することができる次世代型シーケンサーを用いたエクソーム解析の手法。
*5複合ヘテロ接合体:2本の常染色体上にある同じ遺伝子にそれぞれ別の変異が存在することで、常染色体劣性遺伝形式の疾患の原因となる状態。多くの場合、保因者である両親から1つずつ変異を持つ染色体を引き継ぐことで生ずる。
*6ロングリードシーケンシング:従来の次世代型シーケンサーでは読むことができない長いDNA配列を解読することができる新世代DNAシーケンサーを用いた解析手法。今回の解析ではPOLR1Cの全長cDNAをPCR法で増幅し、この手法を用いた解析を行った。
*7遺伝子アレル:通常、遺伝子は父親由来と母親由来の2本の相同染色体にそれぞれ1つずつ配置されている。それぞれの染色体にある遺伝子をアレルと呼ぶ。常染色体に位置する遺伝子は、2つのアレルをもつ。
*8オリゴデンドロサイト:中枢神経系の髄鞘を作る細胞。先天性大脳白質形成不全症は、オリゴデンドロサイトの異常によって正常な髄鞘を作ることができなくなる病気と考えられている。
原著論文情報
・著者:Hitoshi Kashiki, Heng Li, Sachiko Miyamoto, Hiroe Ueno, Yoshinori Tsurusaki, Chizuru Ikeda, Hirofumi Kurata, Takumi Okada, Tomoyuki Shimazu, Hoseki Imamura, Yumi Enomoto, Jun-ichi Takanashi , Kenji Kurosawa, Hirotomo Saitsu , and Ken Inoue.
・論文名:POLR1C variants dysregulate splicing and cause hypomyelinating leukodystrophy.
・掲載誌: Neurology Genetics
・DOI: 10.1212/NXG.0000000000000524
・https://ng.neurology.org/content/6/6/e524
助成金
本研究は日本医療開発研究機構AMED難治性疾患実用化研究事業(16ek0109016 および17ek0109270)、厚生労働科学研究費難治性疾患政策研究事業(H30-難治等(難)-一般-008)により実施されました。
お問い合わせ先
【研究に関するお問い合わせ】
国立精神・神経医療研究センター神経研究所疾病研究第二部
井上 健
【報道に関するお問い合わせ】
国立精神・神経医療研究センター 総務課広報係
浜松医科大学 総務課広報室
神奈川県立こども医療センター 総務課