細胞内のエネルギー状態を検知して、抗ウイルス応答の強さを調節
2020-11-11 大阪大学,久留米大学,九州大学,日本医療研究開発機構
研究成果のポイント
- RNAウイルス感染時の応答に、細胞内のエネルギー生産を担うミトコンドリアが関わっていることが知られていましたが、その理由はわかっていませんでした。
- 今回、ミトコンドリア上で「Mffタンパク質※1」がRNAウイルス感染に対する応答に関わることを見出しました。
- Mffタンパク質はミトコンドリア上でエネルギー状態を検知して、ウイルスに対する応答の強さを調節していることがわかりました。これまで謎であった、ミトコンドリア上にウイルス感染を検知するシステムが存在する理由の一端が解明されました。
- ウイルスに対する感染応答に栄養・代謝状態が関わっていることが明らかとなりました。ミトコンドリアを標的とした、ウイルス感染に対する重症化予防などの治療法開発につながることが期待されます。
概要
大阪大学大学院理学研究科生物科学専攻の花田有希特任研究員(筆頭著者)・石原直忠教授(責任著者)(元久留米大学分子生命研究所教授)、久留米大学医学部の野村政壽教授らの研究グループは、RNAウイルスへの応答に関わるMAVSタンパク質の新しい制御機構を発見しました。
細胞内の構造体であるミトコンドリア※2の上には、感染したRNAウイルス※3を検知するシステム(MAVSタンパク質※4)が存在しています。しかし、酸素呼吸によりエネルギーを作る役割を持つミトコンドリアが、なぜウイルス応答に関わるのか、その理由は知られていませんでした。
今回、ミトコンドリアの分裂に働くミトコンドリア上のMffタンパク質を解析したところ、MAVSタンパク質を調整しウイルス感染を制御する重要な役割を果たしていることを見出しました。さらに、このMffタンパク質は、ミトコンドリアのエネルギー生産が低下すると、ミトコンドリア上でそれを検知し、ウイルスに対する応答を弱めることがわかりました。
栄養不足やミトコンドリア機能低下などのエネルギー低下時において、感染直後に起きる過剰な炎症反応を抑える代わりに長期的な免疫応答を維持できるようになると考えられます。これまで謎であった、ミトコンドリア上にウイルス感染を検知するシステムが存在する理由が解明されました。
この研究により得られた新知見は、様々なウイルスに対する生体応答の理解を発展させ、ウイルス感染時の重症化のメカニズム解明に貢献することが期待されます。
本研究成果は、国際科学誌「Nature Communications」に、2020年11月11日(水)19時(日本時間)に公開されます。
研究の背景
ミトコンドリアは細菌の細胞内共生に由来する細胞小器官であり、分裂と融合を繰り返しながらダイナミックにその形を変化させています。ミトコンドリアは酸素を利用して細胞内エネルギー通貨として知られるATP※5を産生するだけでなく、細胞の生死を制御するなど、さまざまな細胞内シグナル伝達においても多機能に働いています。その例として、ウイルスが感染したときに起きる自然免疫応答にもミトコンドリアが関与することがわかっています。細胞に感染したRNAウイルスのゲノム(RNA)は、細胞内で検知されると、その後にミトコンドリア上に運ばれ、MAVSタンパク質を足場とした複合体を介してウイルス感染に対抗する応答が進行します。
一方で、ミトコンドリアは細胞内で分裂と融合※6を行うことで、活発に形を変化させており、このミトコンドリアの動きは、栄養や免疫応答に伴って変化することがこれまでに知られていました。しかし、ミトコンドリアの形と機能と感染防御メカニズムの3者の関係性は十分には理解されておらず、「なぜ免疫応答がミトコンドリア上で起きるのか」わかっていませんでした。
研究の成果
今回、本研究グループは、RNAウイルスへの応答に関わるMAVSタンパク質の新しい制御機構を発見しました。
ミトコンドリアの分裂に機能することが知られている、ミトコンドリア上のMffタンパク質の遺伝子を欠損した細胞を構築し解析したところ、RNAウイルス感染に対する応答が大きく低下することを見出し、また、詳細な解析から、Mffタンパク質はMAVSタンパク質をミトコンドリア上の一部に局所的に集めて(MAVSクラスター※7)活性化させることを見出しました。これにより、Mffタンパク質はこれまでに知られていたミトコンドリア分裂に加えて、ミトコンドリア上でのウイルスへの応答という新しい機能を持つことが明らかになりました(図1)。
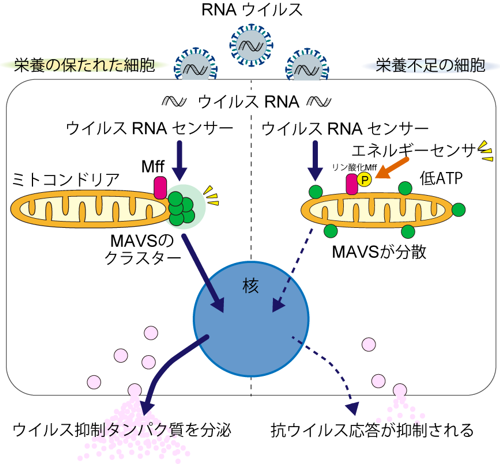
図1 RNAウイルスに対する応答は、ミトコンドリアのMffタンパク質によってエネルギー依存的に制御される。緑の丸はMAVSタンパク質を、ピンクの長丸はMffタンパク質を、また黄色いPはMffのAMPKによるリン酸化を表している。
一方でMffタンパク質は、細胞内のATP濃度が低下するとAMPK※8という酵素によりリン酸化※9されることが知られていましたが、その役割はわかっていませんでした。
今回、栄養・エネルギー低下時にMffタンパク質のMffがリン酸化され、その結果として抗ウイルス応答が抑制されることがわかり、ミトコンドリア膜上に存在するMffタンパク質は、ミトコンドリアで産生されるATPを速やかに検知・応答し、MAVSタンパク質の分布変化を介して応答の強さを調節していることが明らかになりました。ミトコンドリア膜上で、ミトコンドリアによって産生されるATPに応答するのは、最短距離で細胞内エネルギー産生状況を感知しシステムを調節できるため非常に合理的だと考えられます。
エネルギー低下時の過剰な炎症反応は人体にとって危険なため、それを回避することで、より長い期間にわたり応答を起こし続けることができるようになると考えられます。新型コロナウイルス(SARS-COV-2)感染症であるCOVID-19においても、肥満や糖尿病などの基礎疾患が重症化リスクとなることが知られており、ウイルス感染に対する重症化予防などの治療法開発につながることも期待されます。
本研究成果が社会に与える影響(本研究成果の意義)
ミトコンドリア・栄養・抗ウイルス応答の3つの間を繋ぐMffタンパク質の理解により、ミトコンドリアの新しい機能が見出されました。代謝関連疾患などの治療法開発にも応用可能となる可能性も期待されます。この研究は培養皿に取り出し培養した細胞を解析した基礎的な研究ですが、今後様々な種類の細胞や個体レベルでの解析を行うことで、コロナウイルスを含む様々なRNAウイルスに対する感染防御機構の理解をより深めることも期待されます。
特記事項
本研究成果は、2020年11月11日(水)19時(日本時間)に国際科学誌「Nature Communications」(オンライン)に掲載されます。
- タイトル
- “MAVS is energized by Mff which senses mitochondrial metabolism via AMPK for acute antiviral immunity”
- 著者名
- Yuki Hanada, Naotada Ishihara*(責任著者), Lixiang Wang, Hidenori Otera, Takaya Ishihara, Takumi Koshiba, Katsuyoshi Mihara, Yoshihiro Ogawa, and Masatoshi Nomura
- DOI
- 10.1038/s41467-020-19287-7
なお、本研究は、主に国立研究開発法人日本医療研究開発機構(AMED)革新的先端研究開発支援事業AMED-CREST「全ライフコースを対象とした個体の機能低下機構の解明」研究開発領域における研究開発課題「ミトコンドリアの経年劣化による個体機能低下の分子基盤」(研究開発代表者:石原直忠)の一環として行われ、九州大学大学院医学研究院の小川佳宏教授ならびに福岡大学理学部の小柴琢己教授らの協力を得て行われました。
用語説明
- ※1 Mffタンパク質
- Mff(Mitochondrial fission factor)タンパク質は、ミトコンドリア外膜上に存在する膜タンパク質です。ミトコンドリア分裂を実行するタンパク質であるDrp1を細胞質からミトコンドリア表面に運ぶ受容体として働いていることが知られていましたが、今回の研究で、ウイルス感染時の細胞応答にも関わることがわかりました。細胞内エネルギーセンサーであるAMPK※8によってリン酸化され、ミトコンドリア分裂を促進することも知られていました。
- ※2 ミトコンドリア
- ミトコンドリアは真核細胞の中にある2重膜構造の細胞小器官です。酸素呼吸を行うことで、生体内の主要なエネルギー産生を担っています。酸素呼吸だけでなく、様々な物質の合成と分解(代謝)、さらに細胞死などの様々な細胞応答にも重要な機能を持つことから、その多面的な機能に近年注目が集められています。
酸素呼吸細菌であるα-プロテオバクテリアを古細菌が取り込んで共生したことが起源と考えられています。
また、ミトコンドリアを蛍光染色し蛍光顕微鏡で観察すると、長くつながったミトコンドリアが観察され、また動いている様子を観察できます(下写真)。
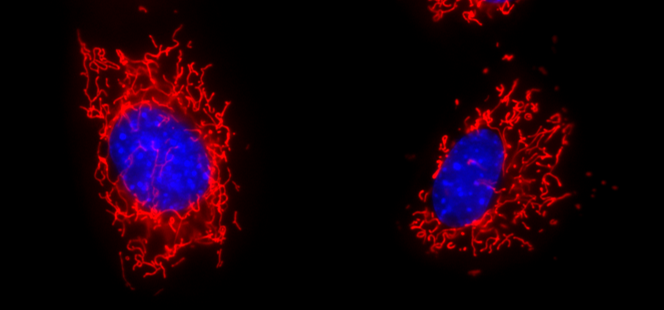
マウス胎児線維芽細胞のミトコンドリアを赤く、核を青く染色した蛍光顕微鏡像。この視野に2つの細胞が映っている。ミトコンドリアは細長いネットワークとして細胞内に広く分布している。 - ※3 RNAウイルス
- RNAウイルスは、遺伝情報をRNAとして保有するウイルスの総称です。C型肝炎ウイルスやインフルエンザウイルス、センダイウイルスなどが知られています。新型コロナウイルスであるSARS-CoV-2もRNAウイルスに属します。
- ※4 MAVSタンパク質
- MAVS(Mitochondrial antiviral signaling)タンパク質は、ミトコンドリアの外膜上に存在する膜タンパク質です。RNAウイルスが感染した細胞で、RNAと受容体を介して結合し、細胞の応答を活性化させます。その結果、ウイルス複製を抑えるためのタンパク質群(インターフェロンやサイトカイン等)が急激に合成されます。
- ※5 ATP
- ATP(アデノシン3リン酸)は、細胞内のエネルギー通貨であり、さまざまな反応に必要な物質です。ミトコンドリアと細胞質で産生されます。ミトコンドリアの酸素呼吸の機能が低下するとATP産生が低下します。
- ※6 分裂と融合
- ミトコンドリアのダイナミックな形態制御。生きた細胞の中のミトコンドリアをライブ観察すると、ちぎれて2つに分かれたり(分裂)、2つのミトコンドリアが1つに合体したり(融合)する様子を頻繁に観察できます。細胞の状態やおかれた環境によって、分裂と融合のバランスが変動しミトコンドリアの形態が決まります。
- ※7 MAVSクラスター
- MAVSタンパク質は顕微鏡観察で、ミトコンドリア膜上の全体に多数の点状の構造として観察されます。この構造体を今回「MAVSクラスター」と呼んでいます。
- ※8 AMPK
- AMPKは「AMP(adenosine monophosphate)活性化プロテインキナーゼ」です。細胞内のATPの増減を感知し、ATP減少時には自身のリン酸化酵素(キナーゼ)としての活性を活性化します。
- ※9 リン酸化
- リン酸化は、タンパク質内のアミノ酸側鎖にリン酸が付加される酵素反応です。
本件に関するお問い合わせ先
研究に関すること
大阪大学 大学院理学研究科 教授 石原直忠(いしはらなおただ)
久留米大学医学部 内科学講座 内分泌代謝内科部門 主任教授 野村政壽(のむらまさとし)
広報・報道に関すること
大阪大学 理学研究科 庶務係
久留米大学 本部事務局 総合企画部 広報室
九州大学 広報室
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
シーズ開発・研究基盤事業部 革新的先端研究開発課