K+チャネルの病因性変異による機能変調機構を解明
2020-11-13 理化学研究所
理化学研究所(理研)生命機能科学研究センター生体分子動的構造研究チームの嶋田一夫チームリーダーらの共同研究グループは、カリウムイオン(K+)チャネル[1]に生じた病因性の変異がK+を細胞内に透過させる「細胞内ゲート[1]」の構造平衡[2]状態を変え、K+透過活性を低化させていることを明らかにしました。
本研究成果は、周期性失調症[3]といったK+チャネルが関わる神経疾患などの治療法の開発や、K+チャネルを標的とした医薬品の合理的な分子設計の指針になることが期待できます。
K+チャネルは細胞膜に埋め込まれた膜タンパク質で、細胞内外のK+の濃度勾配に応じてK+を透過させる機能を持ちます。K+チャネルの変異は細胞内K+濃度の変調を引き起こし、神経系などの異常につながります。
今回、共同研究グループは、核磁気共鳴(NMR)法[4]を用い、K+チャネルの病因性変異により、K+チャネルの細胞内側に位置する細胞内ゲートの動的構造が変化し、細胞内側のK+が細胞外へ透過できない閉じた構造に構造平衡が遷移することで、K+透過活性が低下することを明らかにしました。また、K+チャネルのさまざまな変異体を解析した結果、構造平衡の制御には膜貫通ヘリックス[5]同士の接触部位が重要であることが分かりました。さらに、構造平衡による細胞内ゲートの開閉の遷移とK+透過状態-非透過状態の活性変化が、時間的に対応していることをチャネル電流解析[6]で示しました。
本研究は、科学雑誌『Nature Communications』オンライン版(10月14日付)に掲載されました。
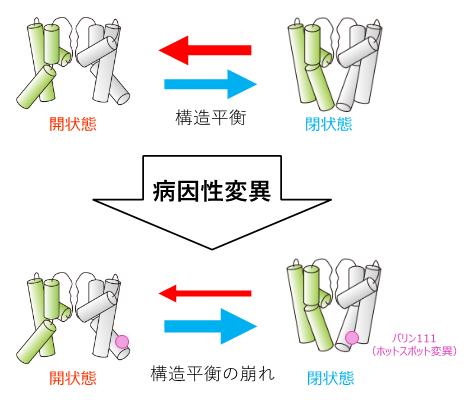
K+チャネルの病因性変異は、細胞内ゲートの構造平衡を閉状態に偏らせる
背景
細胞内外には、カリウムイオン(K+)やナトリウムイオン(Na+)などのイオン濃度勾配が生じており、これらの濃度勾配は細胞内側が負に帯電した膜電位[1]を生じさせます。膜を介したイオンの輸送は、膜電位の変化を介して細胞の興奮性の制御や神経伝達などの重要な生理機能をつかさどります。
K+チャネルは、K+の濃度勾配に応じた輸送を行う膜タンパク質です。膜電位の変化やシグナル伝達物質の結合などのさまざまな刺激に応じて、K+を透過させる「開構造」と、透過させない「閉構造」との間を遷移することにより、K+の透過量を制御します。K+チャネルの遺伝子にミスセンス変異[7]が入り、K+チャネルの開閉に変調が生じると、K+透過の制御が崩れさまざまな疾病を引き起こすことが知られています。このことは、周期性失調症やてんかんなどの神経疾患、QT延長症候群[8]などの心疾患の患者の遺伝子に、K+チャネルのミスセンス変異が見いだされていることからも支持されています。
K+チャネルの開閉の立体構造は、主にX線結晶構造解析[9]によって調べられてきました。これまでの解析から、K+透過路を形成する膜貫通領域は、3本の膜貫通ヘリックス(アウターヘリックス、ポアヘリックス、インナーヘリックス)からなるサブユニットが四つ集まって、回転対称の4量体構造を形成することで機能し、K+透過路の立体構造はK+チャネル間で高度に保存されていることが分かっています(図1A)。また、K+透過路には、細胞外側においてK+の細胞内への選択的透過を担う「選択フィルター」と、細胞内側においてインナーヘリックス同士が会合しK+の細胞外への透過を阻む「細胞内ゲート」の2カ所のゲート部位が存在し、これらのゲートが協奏的にK+透過を制御していることが提唱されていました。
また、さまざまなK+チャネルの変異体解析から、変異導入に伴いK+透過活性が変化する「ホットスポット部位[10]」が存在することが知られています(図1A)。特に、ヒトの神経細胞や筋細胞に発現するK+チャネル(Kv1.1)のホットスポット部位(408番目のバリン残基)は、一型周期性失調症[3]の患者において変異が見いだされており、バリン残基からアラニン残基への変異によって、K+透過活性が低下することが報告されていました。したがって、これらのホットスポット部位の変異によってK+透過活性が低下する機構を理解することは、これらのミスセンス変異が原因となって生じる疾患に対する新しい治療戦略の確立、そしてK+チャネルの活性を調節する医薬品の開発を実現する上で重要です。
しかし、これまでのX線結晶構造解析の結果からは、ホットスポット部位変異体と野生型との立体構造の違いはわずかであり、ホットスポット変異によってなぜK+透過活性の低下が生じるのか、その構造機構は明らかではありませんでした。
研究手法と成果
共同研究グループは、K+チャネルが開構造と閉構造との間を遷移する動的な構造平衡状態にあることに着目しました。ホットスポット変異がK+チャネルの構造平衡を閉構造側に偏らせるとすれば、立体構造の大きな異常を伴わないK+透過活性の低下を説明できると考えられるからです。しかし、結晶構造に代表されるような静的構造のスナップショットの比較だけからは、ホットスポット変異による動的な構造平衡状態の変化を解明することは難しいと考えました。
そこで、K+チャネルの溶液環境における動的構造情報を得ることができる核磁気共鳴(NMR)法を用いて、変異によるK+チャネルの動的構造への影響を調べました。研究対象として放線菌由来のpH依存性K+チャネルKcsA[11]を用い、ホットスポット部位に相当する残基番号111のアラニン残基をバリン残基に置換したホットスポット変異体(A111V変異体)(図1A)と野生型における残基番号76のバリン残基のNMRスペクトル[4]を比較しました。その結果、ホットスポット部位の変異体では、野生型が開口状態となるpH3.0の酸性溶液中においても、細胞内ゲートが閉じた構造が形成されていることが明らかになりました(図1B)。さらにこのときには、膜貫通領域も野生型の閉口状態と同じ構造をとっていました。このことは、ホットスポット変異がKcsAの動的構造を変化させ、細胞内ゲートが閉じた状態に構造平衡を遷移させていることを示しています。
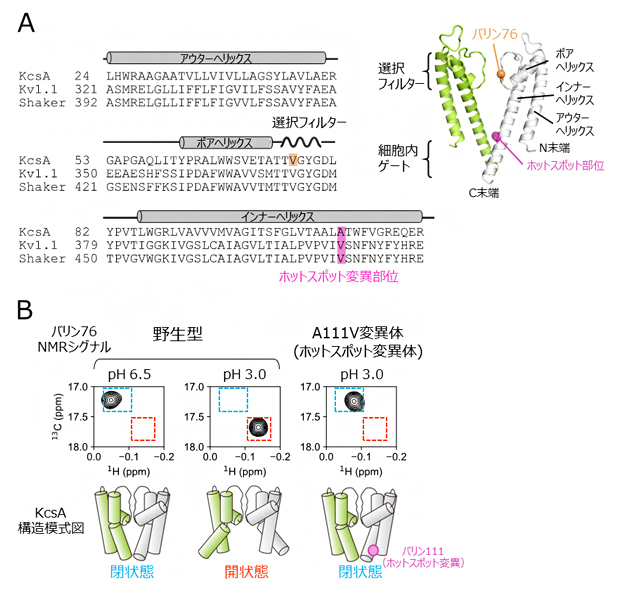
図1 K+チャネルの構造と核磁気共鳴(NMR)解析
(A)放線菌由来KcsA、ヒト由来Kv1.1、ショウジョウバエ由来Shaker K+チャネルの膜貫通領域のアミノ酸配列の比較。配列の上には各膜貫通ヘリックスとの対応、KcsAのバリン76の位置、そしてホットスポット変異部位を示した。右上にはKcsAの結晶構造(PDB ID: 1K4C)を示し、選択フィルター、細胞内ゲート、3本の膜貫通ヘリックス、バリン76、そしてホットスポット変異部位の位置をそれぞれ表示した。4量体のうち向かい合う二つのサブユニットのみを、緑と白色にてそれぞれ表示した。
(B)野生型KcsAの細胞内ゲートの閉状態(pH 6.5の弱酸性溶液中)、開状態(pH 3.0の酸性溶液中)、そしてA111V変異体(ホットスポット変異体)のpH 3.0における残基番号76のバリン残基のNMRシグナルの拡大図を比較した。このバリンは、KcsAの選択フィルターならびに細胞内ゲートの構造平衡状態を鋭敏に反映することが知られている。細胞内ゲートが閉状態、開状態であることを表すNMRシグナルの位置をそれぞれ青、赤色の点線にて示した。下には各状態を表すKcsAの模式図を示した。
次に、膜貫通領域の変異が細胞内ゲートの構造平衡に与える影響を調べるために、膜貫通領域の変異体を網羅的に解析し、細胞内ゲートの構造平衡を遷移させるものがあるか探索しました(図2A)。その結果、膜貫通ヘリックス同士が接触する部位に相当する残基番号91のバリン残基や106のバリン残基などを、イソロイシン残基のようによりかさ高いアミノ酸[12]残基に置換した場合(V91I変異体やV106I変異体)に、細胞内ゲートが閉じた状態に構造平衡が遷移しました。細胞内ゲートが閉じた状態と開いた状態の立体構造の詳細な比較、ならびに他の変異体を用いた検証実験から、膜貫通ヘリックスへの変異導入は細胞内ゲートが開いた構造でのヘリックス間の立体障害を増大させるため、細胞内ゲートが閉じた状態へと構造平衡を遷移させていることが分かりました。
さらに、構造平衡の遷移によってK+透過活性が低下する機構をより詳細に調べるために、野生型、ホットスポットの変異体、ならびに新たに見いだした膜貫通領域の変異体を用いて、脂質平面膜上における単一チャネル電流[6]を比較しました(図2B)。その結果、単一チャネル電流解析においてミリ秒(1000分の1秒)の時間領域で生じるK+非透過状態の存在割合が、NMRシグナル強度比から算出された細胞内ゲートが閉じた状態の存在割合と強く相関していることを見いだしました。このことは、細胞内ゲートの構造平衡の遷移が、ミリ秒の時間領域で生じるK+透過状態-非透過状態の活性の変化と対応していること示します。
以上の結果から、K+チャネルの病因性変異による機能変調機構は次のように説明できます。K+チャネルのホットスポットに変異が生じると、膜貫通ヘリックス同士の接触部位における立体障害が増大します。これは、細胞内ゲートの構造平衡を閉じた状態へと遷移させ、ミリ秒の時間領域で生じるK+非透過状態の増大を引き起こします。この結果、K+チャネルの立体構造自体に大きな異常がないにもかかわらず、K+透過活性が低下します。
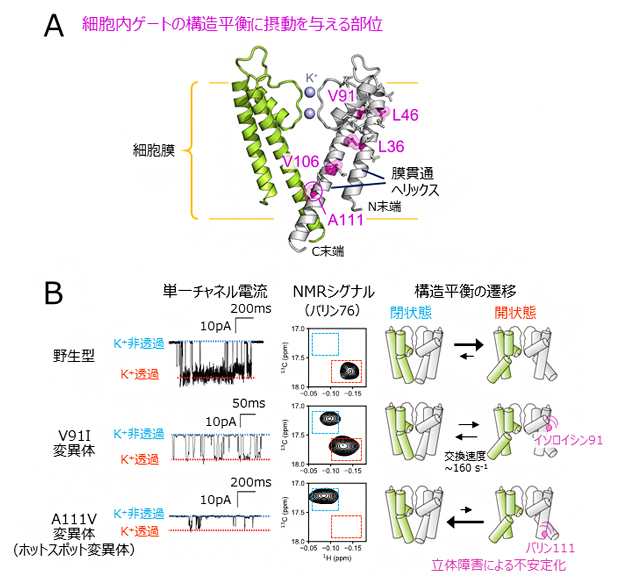
図2 膜貫通領域の変異解析と単一チャネル電流解析
(A)細胞内ゲートの構造平衡を遷移させることが示された変異部位の、KcsAの結晶構造(PDB ID: 1K4C)へのマッピング。本文で記した二つのバリン(V)残基を含む、二つのロイシン(L)と一つのアラニン(A)残基をマゼンタで示した。4量体のうち向かい合う二つのサブユニットのみを、緑と白色にてそれぞれ表示した。
(B)野生型、V91I変異体、A111V変異体(ホットスポット変異体)のK+透過活性とNMRシグナル、構造平衡状態の比較。左は、KcsAの単一チャネル電流プロファイル。K+非透過状態と透過状態の電流値をそれぞれ青色、赤色の点線にて示した。中央は、バリン76のNMRシグナルの拡大図を比較した。細胞内ゲートが閉状態、開状態であることを表すNMRシグナルの位置をそれぞれ青、赤色の点線にて示した。右は、KcsAの構造平衡状態を示す模式図を示した。ミリ秒の時間領域で生じるK+非透過状態の存在割合が、NMRシグナル強度比から算出された細胞内ゲートが閉じた状態の存在割合と強く相関している。
今後の期待
本研究から明らかとなったK+チャネルの機能変調機構は、K+チャネルへのミスセンス変異によって生じる疾病に対する新たな治療法の確立、ならびにK+チャネルの活性を制御する医薬品の合理的な設計に貢献できます。
また、本研究からその重要性が示された膜貫通ヘリックス同士の接触部位は、K+チャネルに対して作用する医薬品の新たな標的部位となる可能性があります。このような医薬品を設計するには、分子サイズが大きく、広い構造領域を認識することが可能な中分子医薬品[13]を用いた創薬戦略が有効です。本研究で得られた知見は、このような中分子創薬を実現する上での指針となるものであり、NMR法を用いたタンパク質の動的構造の解析は、中分子創薬の基盤技術となると期待できます。
補足説明
1.カリウムイオン(K+)チャネル、細胞内ゲート、膜電位
生体内では、細胞の内外にさまざまなイオンが存在するが、細胞膜の主成分である脂質二重膜はイオンを透過させにくく、膜に開いた孔がイオンの通路となる。イオンチャネルはタンパク質で構成された孔であり、特定のイオンを選択的に透過させることで、細胞内外にイオン濃度差と電気力の平衡状態が生み出される。これにより発生する電位を「膜電位」と呼ぶ。「カリウム(K+)イオンチャネル」は、K+を濃度勾配に従って透過させるイオンチャネルであり、細胞外側のK+の細胞内への選択的透過を担う選択フィルターと、細胞内側のK+の細胞外への透過を阻む「細胞内ゲート」の2カ所のゲート部位を持つ。
2.構造平衡
タンパク質の構造が一つではなく、複数の異なる構造間の交換状態にあること。
3.周期性失調症、一型周期性失調症
周期性失調症は運動失調疾患の一つで、周期的・発作的に症状が現れる。一型周期性失調症は、電位依存性カリウム(K+)イオンチャネルをコードするKCNA1遺伝子の変異が原因であることが分かっている。
4.核磁気共鳴(NMR)法、NMRスペクトル
強い磁場中に置かれた原子核に電磁波を照射すると、核スピンの共鳴現象により、原子核の性質や周囲の環境に応じた周波数(共鳴周波数)の電磁波の吸収や放出が起こる。NMR法は、その電磁波をNMR信号として捉えることで、物質の分子構造の解析や物性の解析を行う手法。ラジオ波の周波数領域の電磁波を扱う分光法の一種であることからNMR分光法とも呼ばれ、NMR信号を共鳴周波数ごとに分解したNMRスペクトルで表すことができる。NMR法は溶液試料、固体試料のどちらにも適用できるが、本研究で溶液中での構造平衡を捉えるため、K+イオンチャネルを界面活性剤で可溶化し、溶液NMR法で測定した。NMRはNuclear Magnetic Resonanceの略。
5.膜貫通ヘリックス
ヘリックスはタンパク質の代表的な二次構造で、3.6アミノ酸残基で1回転する右巻きらせん構造をとる。膜タンパク質の細胞膜に埋め込まれた部分のヘリックス領域を、膜貫通ヘリックスと呼ぶ。
6.チャネル電流解析、単一チャネル電流
膜電位の存在下でイオンチャネルが開くと、イオンの透過が電流の変化として観測される。この変化はチャネル1分子が起こす電流(単一チャネル電流)に対しても観測可能である。チャネル電流の観測によるチャネル機能の解析をチャネル電流解析と呼び、本研究ではパッチクランプ法を用いた。
7.ミスセンス変異
遺伝子内の塩基置換が生じることでコドン内の塩基配列が変化し、他のアミノ酸をコードするようになる点突然変異の一種。
8.QT延長症候群
致死性不整脈を発症して心臓突然死の原因となる疾患。心電図検査時のQT波形が正常に比べて長いという特徴がある。原因遺伝子の多くが、カリウム、カルシウム、ナトリウムなどのイオンチャネルとそれらと関連のある遺伝子群であることが分かっている。
9.X線結晶構造解析
結晶化させた試料にX線を照射したときの回折パターンから電子密度分布を取得し、分子の立体構造を解析する方法。
10.ホットスポット部位
塩基配列の変化は遺伝子のさまざまな領域に起こりうるが、しばしば変異が特定の部位に集中することがある。このような部位をホットスポットと呼ぶ。
11.KcsA
放線菌Streptomyces lividans由来のpH依存性K+チャネル。中性条件ではK+を透過しない閉状態をとり、pH 5.0以下の酸性条件においてK+を透過する開状態をとる。
12.かさ高いアミノ酸
タンパク質を構成するアミノ酸は、側鎖の違いにより20種に分類される。このうちバリンとイソロイシンはどちらも側鎖が脂肪族で似た性質を持つが、イソロイシンはバリンよりも炭素原子が二つ多く、よりかさ高いアミノ酸といえる。
13.中分子医薬品
低分子医薬品と、抗体医薬品などの高分子医薬品の中間に位置付けられ、分子量が数百から数千程度の領域にある医薬品群。タンパク質間相互作用のように広い相互作用面を標的とすることが可能である。
共同研究グループ
理化学研究所 生命機能科学研究センター
生体分子動的構造研究チーム
チームリーダー 嶋田 一夫(しまだ いちお)
東京大学大学院薬学系研究科
生命物理化学教室
大学院生(研究当時) 岩橋 優太(いわはし ゆうた)
博士研究員(研究当時) 外山 侑樹(とやま ゆうき)
博士研究員(研究当時) 今井 駿輔(いまい しゅんすけ)
(現、理研生命機能科学研究センター 生体分子動的構造研究チーム 上級研究員)
天然物合成化学教室
教授 井上 将行(いのうえ まさゆき)
助教 伊藤 寛晃(いとう ひろあき)
慶應義塾大学薬学部
生命機能物理学講座
教授 大澤 匡範(おおさわ まさのり)
研究支援
本研究は、日本医療研究開発機構(AMED)次世代治療・診断実現のための創薬基盤技術開発事業「革新的中分子創薬技術の開発 中分子シミュレーション技術の開発(研究代表者:嶋田一夫)」および日本学術振興会(JSPS)科学研究費補助金(特別推進研究)「核磁気共鳴法による膜タンパク質のin situ機能解明(研究代表者:嶋田一夫)」による支援を受けて行われました。
原論文情報
Yuta Iwahashi, Yuki Toyama, Shunsuke Imai, Hiroaki Itoh, Masanori Osawa, Masayuki Inoue & Ichio Shimada, “Conformational equilibrium shift underlies altered K+ channel gating as revealed by NMR”, Nature Communications, 10.1038/s41467-020-19005-3
発表者
理化学研究所
生命機能科学研究センター 生体分子動的構造研究チーム
チームリーダー 嶋田 一夫(しまだ いちお)
報道担当
理化学研究所 広報室 報道担当