2020-12-17 岡山大学,国立精神・神経医療研究センター
◆発表のポイント
・先天性の筋疾患である中心核ミオパチーは、骨格筋の収縮に必要な筋組織の構造(T管)に生まれつき異常があり、筋力や筋緊張の低下が起こる難病です。
・本研究では、T管の形成が異常になるプロセスを試験管内および細胞内再構成系を用いて解析し、ミオパチーの発症機構を明らかにしました。
・本研究の成果は、難病である中心核ミオパチーの新たな治療法や創薬開発に役立つことが期待されます。
岡山大学大学院医歯薬学総合研究科生化学分野の藤瀬賢志郎大学院生、竹田哲也助教、竹居孝二教授らと、国立精神・神経医療研究センター神経研究所疾病研究第一部の大久保真理子研究員、野口悟室長、西野一三部長の共同研究グループは、先天性筋疾患である中心核ミオパチーにおいて、骨格筋の収縮に必要な筋組織の構造である「T管」の形成異常が起こる仕組みを解明しました。本研究の成果は11月13日、米国生化学分子生物学会(The American Society for Biochemistry and Molecular Biology)の国際科学誌「Journal of Biological Chemistry」に掲載されました。
中心核ミオパチーは、骨格筋の先天的な構造異常により筋力が低下する筋疾患で、根治的な治療法がありません。骨格筋は高度に組織化された器官で、神経細胞を介して脳からのシグナルが伝達され、筋収縮が起こります。T管は、神経細胞からのシグナルを筋細胞深部にまで伝える役割を持ちますが、中心核ミオパチーの患者で、T管の形成異常が起こるメカニズムは明らかになっていませんでした。
研究グループは、試験管内や培養細胞内でT管構造を再構成する実験系を確立し、中心核ミオパチーでT管の形成異常が起こる仕組みを解析しました。その結果、細胞膜を「切る」機能を持つダイナミンが、細胞膜を「曲げる」機能を持つBIN1と相互作用し、T管を安定化する新たな機能を発見しました。一方、中心核ミオパチー型のダイナミン変異体は、細胞膜を切る活性が高まり、T管が正常に形成されなくなることを明らかにしました。本研究で用いた研究手法や得られた研究成果は、中心核ミオパチーの早期診断法や治療法、創薬開発に役立つことが期待されます。
発表内容
<現状>
先天性ミオパチー注1は生まれながらに骨格筋の構造に異常があり、加齢とともに筋力が低下する進行性の筋疾患です。筋力低下の影響で、呼吸・嚥下障害や、発育の遅れなどを伴うこともあります。国内の患者数は1000~3000人と推定されますが、2015年に厚生労働省の難病指定を受け(指定難病111)、根治的な治療法開発に向けた発症メカニズムの解明が急務になっています。
先天性ミオパチーの一つである中心核ミオパチーの患者の筋組織では、T管の形態異常が観察されます(図1)。T管は筋細胞膜の陥入構造で、神経細胞からのシグナルを筋細胞深部にまで伝達し、骨格筋を収縮させる重要な役割を担います。中心核ミオパチーの病因遺伝子であるDNM2とBIN1は、細胞膜の変形や切断(膜リモデリング)を行うダイナミン2注2)とBIN1注3)をコードしますが、これらの膜リモデリング分子の機能異常によってミオパチーが発症するメカニズムは、これまで明らかになっていませんでした。
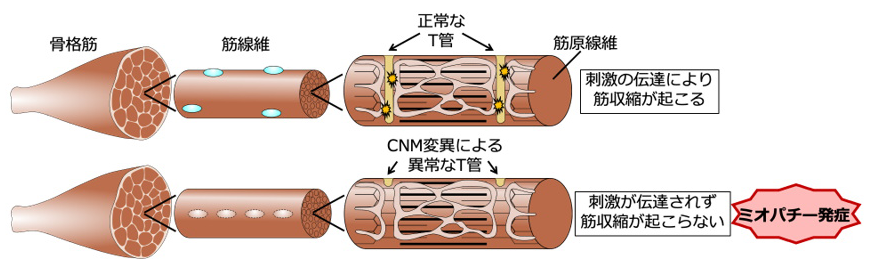
図1. T管の形態異常による中心核ミオパチー発症モデル
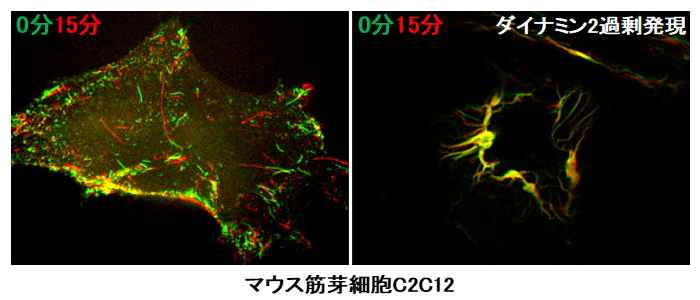
図2. ダイナミン2によるT管構造の安定化 撮影スタート後0分(緑)と15分(赤)の重ね合わせ図。ダイナミクスが少ない部分は黄色に見え、ダイナミン2の過剰発現により、チューブ状のT管構造が安定化したことが分かる
<研究成果の内容>
本研究では、培養細胞と試験管内の再構成系注4を用いて、ダイナミン2およびBIN1によるT管構造の形成メカニズムを解析しました。まず、マウス筋芽細胞C2C12においてダイナミン2の発現量を増やすと、T管構造が安定化することを、ライブイメージング法注5により明らかにしました(図2)。一方、RNA干渉注6を用いて、培養細胞内のダイナミンの発現量を減少させると、T管構造の形成が阻害されました。ダイナミン2の発現抑制に伴うT管の形成阻害は、正常なダイナミン2を細胞内に導入することで回復しましたが、BIN1と相互作用しないダイナミン2変異体では回復しませんでした。これらの結果から、T管構造の形成には、ダイナミン2とBIN1の相互作用が重要であることが明らかになりました。
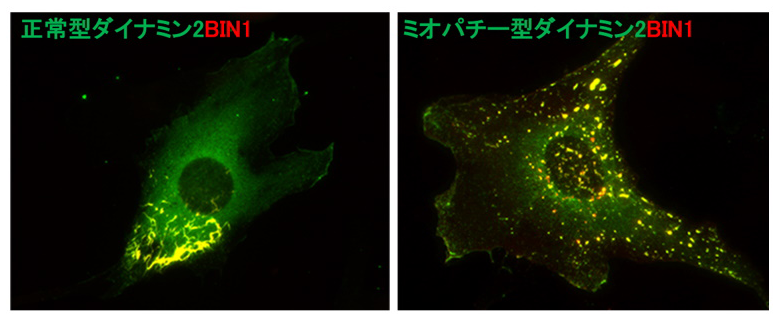
図3.ミオパチー型ダイナミンによるT管の形態異常 正常型ダイナミン2ではチューブ状のT管構造が形成されるが、ミオパチー型ではドット状に切断されたT管構造が形成される。
次に、ダイナミン2によりT管構造が安定化する仕組みを明らかにするために、ダイナミン2とBIN1の精製タンパク質を用いて、両者の機能的な相互作用を解析しました。ダイナミンはGTPアーゼ注6で、GTP加水分解に伴う構造変化を起こして膜を切断します。生化学的な解析から、BIN1はダイナミン2に結合してGTPアーゼ活性を抑制し、T管構造の安定化に寄与することが明らかになりました。また、中心核ミオパチー型のダイナミン2はBIN1による制御を受けず、GTPアーゼ活性が恒常的に亢進していることが分かりました。中心核ミオパチー型のダイナミン2を培養細胞において発現すると、T管構造が顕著に短くなったことから(図3)、ダイナミン2の膜切断機能の活性化が、T管の形成異常が引き起こす可能性が強く示唆されました。
以上の結果より、骨格筋のT管形成には、ダイナミンとBIN1による協調的な膜リモデリング機能が必要であり、中心核ミオパチーの患者では膜リモデリング異常によってT管の形成が正常に起こらず、ミオパチーが発症することが本研究によって明らかになりました。
<社会的な意義>
近年の次世代シークエンサー技術の進歩により、先天性ミオパチーの患者さんから新たな遺伝子変異が多数見つかってきています。本研究のアプローチは、従来の遺伝学的、臨床病理学的な診断法に加えて、新たな病因性変異を簡便に同定するのに役立ち、先天性筋疾患の発症機序の解明や新たな治療法の確立に、今後貢献していくことが期待されます。
論文情報
論 文 名:Mutant BIN1-Dynamin 2 complexes dysregulate membrane remodeling in the pathogenesis of centronuclear myopathy
掲 載 紙:Journal of Biological Chemistry
著 者:Kenshiro Fujise, Mariko Okubo, Tadashi Abe, Hiroshi Yamada, Ichizo Nishino, Satoru Noguchi, Kohji Takei* and Tetsuya Takeda* (*Corresponding authors)
D O I:10.1074/jbc.RA120.015184
U R L:https://www.jbc.org/content/early/2020/11/13/jbc.RA120.015184.long
研究資金
本研究は、科研費(18K07198、19KK0180、19H03225、19J12028)、国立精神・神経疾患研究開発費(28-6、29-4、30-9、2-5)、AMED(JP19ek0109285h0003)、ウエスコ学術振興財団、両備檉園記念財団の支援を受けて実施しました。
補足・用語説明
注1)先天性ミオパチー
筋組織に生まれつき異常があり、筋力や筋緊張の低下、呼吸障害、嚥下障害などが発症する骨格筋の難病。中心核ミオパチーはその一つで、筋細胞の中心に核が局在する特徴的な病理像を示す。
注2)ダイナミン2
エンドサイトーシスにおける膜切断に必要な高分子量のGTPアーゼ。らせん状の多量体を形成し、GTP加水分解に共役した構造変化により膜を切断する。ダイナミン2は、哺乳類に存在する3つのアイソフォーム(ダイナミン1、2、3)の一つで、全組織で発現している。
注3)BIN1
骨格筋のT管形成に必須の機能を持つ蛋白質。細胞膜に結合し、膜の変形および曲率を感知するBAR(BIN/Amphiphysin/Rvs)ドメインを持つ。またSH3ドメインも持ち、ダイナミンのプロリンリッチ(PR)ドメインに直接結合する。
注4)再構成系
対象とする生命現象を最小の構成要素を用いて人為的に再現する実験系。本研究では、①培養細胞でBIN1を過剰発現してT管様構造を誘導する実験系と、②BIN1とダイナミン2の精製蛋白質を用いて、試験管内でリポソーム(人工脂質膜)からT管様構造を形成する2種類の再構成系を用いている。
注5)ライブイメージング法
組織や細胞の挙動を生きたまま解析する顕微鏡観察手法。GFPなどの蛍光タンパク質と観察対象のタンパク質を繋ぐことで、目的タンパク質の動態をリアルタイム観察することができる。
注6)RNA干渉
2本鎖RNAがいくつかの蛋白質と複合体を作り、相同な塩基配列をもつメッセンジャーRNAと特異的に対合、切断することにより、遺伝子発現を抑える現象のこと。
お問い合わせ
岡山大学大学院医歯薬学総合研究科
助教 竹田哲也
岡山大学大学院医歯薬学総合研究科
教授 竹居孝二
国立研究開発法人国立精神・神経医療研究センター総務課 広報係