2021-04-20 理化学研究所,慶應義塾大学医学部,生理学研究所,生命創成探究センター,日本医療研究開発機構
理化学研究所(理研)生命医科学研究センター皮膚恒常性研究チームの松井毅副チームリーダー(研究当時)、葛野菜々子訪問研究員(研究当時)、天谷雅行チームリーダー(慶應義塾大学医学部皮膚科学教室教授)らの共同研究グループは、皮膚表皮細胞の細胞死の過程を明らかにし、新しい細胞死「Corneoptosis(コルネオトーシス)」を提唱しました。
本研究成果は、皮膚の表面にある角層のバリア障害が知られているアトピー性皮膚炎などのアレルギー疾患の発症機序の解明に役立つと期待できます。
皮膚の表皮では、表皮細胞が生きていく上で必要な細胞核やミトコンドリアなどが消失(細胞死)し、残った細胞体を利用して、角層(表皮の最外層)が形成されています。しかし、核やミトコンドリアがどのように消失するのかはこれまで明らかにされていませんでした。
今回、共同研究グループは独自にライブイメージング法[1]を開発し、生きたマウスの表皮を観察しました。その結果、角層の内側にある顆粒層細胞の細胞死の過程では、細胞内のカルシウムイオン(Ca2+)濃度が約1時間上昇した後、Ca2+濃度が高いまま細胞内が酸性化することが分かりました。この酸性化がないと、核の消失が起こらず、正常な角層細胞(Corneocyte)[2]になりません。また、この酸性化のタイミングは、温度感受性カルシウムチャネルのTRPV3タンパク質が制御していることも明らかになりました。
本研究は、科学雑誌『Proceedings of the National Academy of Sciences of the United States of America(PNAS)』オンライン版に近日中に掲載されます。
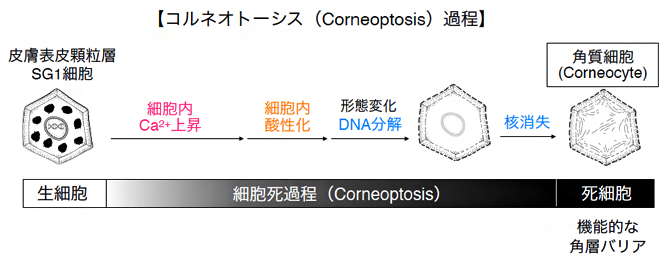
顆粒層SG1細胞の細胞死(Corneoptosis)過程で酸性化が起きる
背景
組織の中で細胞死が起こると、細胞機能は失われます。特に、アポトーシス[3]やネクローシス[3]と呼ばれる細胞死の場合は、死んだ細胞(死細胞)が残存すると炎症を起こす物質となるため、死細胞は取り除かれる必要があります。一方、ヒトでは、眼のレンズや赤血球など死細胞を機能的な材料として利用している場合もあります。
皮膚は、表皮・真皮・皮下組織から成ります。表皮は、外側から角層、顆粒層、有棘層(ゆうきょくそう)、基底層の4層の多重構造です。一番外側の角層には死細胞が数層から十数層も積み重なり、機能的なバリアを形成しています。これは「角層バリア」と呼ばれ、私たちの体を機械的刺激、乾燥、病原体などから守っています。
角層バリアは、角層の内側にある顆粒層細胞が細胞死により細胞核やミトコンドリアが消失し、残った細胞体を利用して生成した角層細胞(Corneocyte)から形成されます。この角層バリア形成のことを「角化」と呼びますが、その初期段階で起こる細胞死に関しては、限られた実験手法しかないために、多くの部分が未解明のままでした。
研究手法と成果
共同研究グループは、独自に開発したライブイメージング法を用いて、生きたマウス個体の角化における細胞死現象を詳しく解析しました(図1)。細胞内イオン変化とpH(酸性~中性~アルカリ性)に着目するため、カルシウムイオン(Ca2+)プローブのGCaMP3とR-CaMP1.07を顆粒層で最も外側に存在するSG1細胞に発現させました。その結果、SG1細胞では、細胞内Ca2+濃度が上昇したのちに細胞内が急激に酸性化することが明らかになりました(図2)。
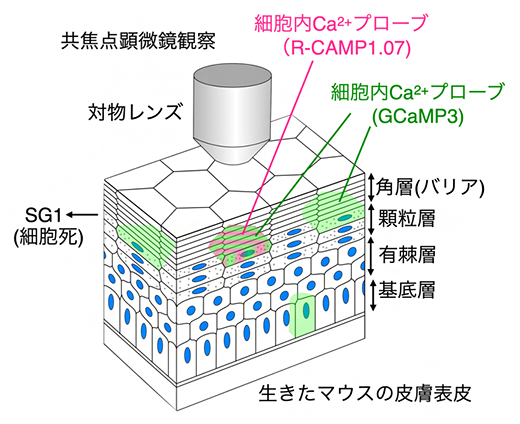
図1 本研究で開発した表皮観察用のライブイメージング法
生きたマウスの顆粒層SG1細胞の細胞死過程で起きるカルシウムイオン(Ca2+)の変化やpHの変化を観察できる。
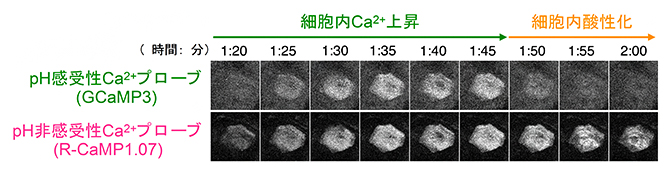
図2 ライブイメージングによる細胞内の変化
pH感受性と非感受性のCa2+プローブを用いて、ライブイメージングを行った結果、顆粒層SG1細胞の細胞死過程では細胞内Ca2+濃度が上昇し、続いてCa2+濃度が高いまま酸性化が起こることが分かった。
このことから、角化の初期に起きる顆粒層の細胞死過程では、主に以下のような二つの特殊な細胞内イオン状態を経ることが分かりました。
1)細胞内Ca2+濃度が高く、中性の状態が約1時間
2)細胞内Ca2+濃度が高く、弱酸性の状態が数時間以上
この細胞内酸性化の生理的意義を明らかにするために、SG1細胞特異的に改変型緑色蛍光タンパク質(EGFP)を発現するマウスを作製し、EGFPの蛍光を指標にしてSG1細胞を分離培養することに成功しました(図3)。この分離SG1細胞をさまざまなCa2+濃度とpHで培養したところ、「細胞内Ca2+濃度が高く、弱酸性」の条件下においてのみ、SG1細胞内のケラトヒアリン顆粒[4]と核内DNAが消失することが分かりました。このことは、顆粒層細胞が角化特有の形態変化を行うために、細胞内酸性化が重要であることを示しています。
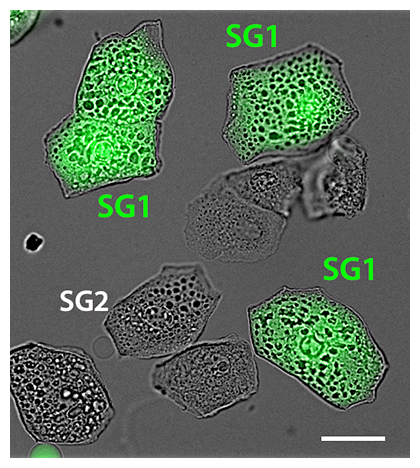
図3 分離したマウス顆粒層SG1細胞の顕微鏡画像
緑色がEGFPによって蛍光発色しているSG1細胞である。スケールバーは10マイクロメートル(μm、1μmは1000分の1mm)。
また、分離したSG1細胞を用いて、SG1細胞としては初めてパッチクランプアッセイ法[5]を行い、どのような細胞膜タンパク質がSG1細胞内のイオン変化を制御するのかを解析しました。その結果、温度感受性のCa2+透過性チャネルであるTRPV3タンパク質が、SG1細胞に発現していることが分かりました(図4)。
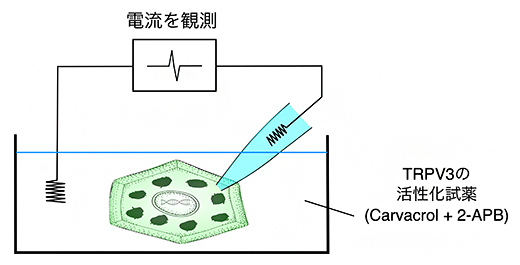
図4 マウス顆粒層SG1細胞の電流測定
パッチクランプアッセイ法により、分離したマウス顆粒層SG1細胞の電流測定を行った。TRPV3タンパク質を活性化するCarvacrol/2-APBを添加すると電流を検出した。
そこで、TRPV3タンパク質の顆粒層における機能を明らかにするために、TRPV3遺伝子を欠損したマウスを作製して、SG1細胞のCa2+濃度、細胞内pH変化を観察した結果、酸性化が起きるタイミングが早まったり、遅れたりする異常が生じることが明らかになりました。これは、TRPV3タンパク質が顆粒層SG1細胞の細胞死における酸性化のタイミングを決定していることを示唆しています。
これらの結果から、皮膚表皮顆粒層SG1細胞は特殊な細胞内イオン変化を経て細胞死を起こし、その死細胞は機能的な角層バリアを形成することが明らかになりました。そこで共同研究グループは、従来の死細胞が不必要となり排除される細胞死とは異なり、機能的な角層細胞(Corneocyte)を形成するこの細胞死を「Corneoptosis(コルネオトーシス)」と命名しました。
今後の期待
本研究では、皮膚表皮顆粒層細胞の細胞死過程を詳細に解析することによって、その死細胞が新たな役割を持つまでの過程を明らかにしました。これらの知見は、死細胞は不必要であるとされてきた細胞死に対する従来の考えに新しい概念を提供します。従って、角層バリア障害が知られているアトピー性皮膚炎などのアレルギー疾患の発症機序の解明に大きく役立つものと期待できます。
補足説明
1.ライブイメージング法
生きたマウスの細胞内に起こる現象を可視化し、観察できる技術。本研究では、蛍光タンパク質を発現する遺伝子組換えマウス生体を麻酔下において、共焦点顕微鏡で観察する手法を開発した。
2.角層細胞(Corneocyte)
皮膚表皮顆粒層の細胞が死んで形成する角質層(角層)を構成する死細胞。数層から数十層が重なることで、陸上脊椎動物の体表面において機能的なバリアを作っている。
3.アポトーシス、ネクローシス
アポトーシスは、多細胞生物の細胞で起こる、能動的な管理制御された細胞死のこと。DNAが細かく断片化されるが、特定の遺伝子により制御されている。一方ネクローシスは、外的環境が変化した要因により起こる制御されていない受動的細胞死のこと。
4.ケラトヒアリン顆粒
皮膚表皮顆粒層の細胞質内において観察される、塩基性の顆粒。主にプロフィラグリンやロリクリンなどの疎水性タンパク質から形成されている。
5.パッチクランプアッセイ法
分離した細胞に対して、細胞膜に電極を当て、細胞内外を流れる電流を測定する方法。これにより、どのような機能タンパク質が存在しているのかが分かる。
共同研究グループ
理化学研究所
生命医科学研究センター
皮膚恒常性研究チーム
訪問研究員(研究当時) 葛野 菜々子(かどの ななこ)
(日本学術振興会特別研究員)
(現 株式会社 ちふれ)
大学院リサーチアソシエイト(研究当時) 古市 祐樹(ふるいち ゆうき)
基礎科学特別研究員(研究当時) 白神 慧一郎(しらが けいいちろう)
(現 京都大学農学部 助教)
客員主幹研究員(研究当時) 佐々木 博之(ささき ひろゆき)
(現 東京保健医療専門職大学 教授)
副チームリーダー(研究当時) 松井 毅(まつい たけし)
(現 同チーム客員主幹研究員、東京工科大学 応用生物学部 教授)
チームリーダー 天谷 雅行(あまがい まさゆき)
(慶應義塾大学医学部皮膚科学教室 教授)
組織動態研究チーム
研修生(研究当時) 石田 梓(いしだ あずさ)
(横浜市立大学大学院生命医科学研究科 大学院生)
研修生(研究当時) 高橋 苑子(たかはし そのこ)
(横浜市立大学大学院生命医科学研究科 大学院生)
(現 理化学研究所生命医科学研究センター 特別研究員)
チームリーダー 岡田 峰陽(おかだ たかはる)
(横浜市立大学大学院生命医科学研究科 大学院客員教授)
免疫器官形成研究チーム
専任研究員 ジャファル・シャリフ(Jafar Sharif)
環境資源科学研究センター
質量分析・顕微鏡解析ユニット
上級技師 豊岡 公徳(とよおか きみのり)
生命機能科学研究センター
生体モデル開発チーム
技師 阿部 高也(あべ たかや)
チームリーダー 清成 寛(きよなり ひろし)
脳神経科学研究センター
細胞機能探索技術研究チーム
チームリーダー 宮脇 敦史(みやわき あつし)
自然科学研究機構
生理学研究所/生命創成探究センター
教授 富永 真琴(とみなが まこと)
助教(研究当時) 鈴木 喜郎(すずき よしろう)
(現 岩手医科大学准教授)
研究支援
本研究は、日本医療研究開発機構革新的先端研究開発支援事業(AMED-CREST)ユニットタイプ「微生物叢と宿主の相互作用・共生の理解と、それに基づく疾患発症のメカニズム解明」研究開発領域の研究課題「皮膚細菌叢と宿主の相互作用理解に基づく炎症性疾患制御法の開発(研究開発代表者:天谷雅行、研究開発分担者:松井毅)」、公益財団法人内藤記念科学振興財団、公益財団法人武田科学振興財団による支援を受けて行われました。
原論文情報
Matsui T, Kadono-Maekubo N, Suzuki Y, Furuichi Y, Shiraga K, Sasaki H, Ishida A, Sonoko Takahashi S, Okada T, Toyooka K, Sharif J, Abe T, Kiyonari H, Tominaga M, Miyawaki A, Amagai M, “A unique mode of keratinocyte death requires intracellular acidification.”, Proceedings of the National Academy of Sciences of the United States of America (PNAS), 10.1073/pnas.2020722118
発表者
理化学研究所
生命医科学研究センター 皮膚恒常性研究チーム
チームリーダー 天谷 雅行(あまがい まさゆき)
(慶應義塾大学医学部皮膚科学教室 教授)
副チームリーダー(研究当時) 松井 毅(まつい たけし)
(現 同チーム客員主幹研究員)
報道担当
理化学研究所 広報室 報道担当
慶應義塾大学信濃町キャンパス総務課
自然科学研究機構 生理学研究所 研究力強化戦略室
自然科学研究機構 生命創成探究センター 広報担当
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
シーズ開発・研究基盤事業部 革新的先端研究開発課