B細胞受容体レパトア解析に基づく成果
2021-04-27 国立精神・神経医療研究センター,日本医療研究開発機構
国立精神・神経医療研究センター(NCNP)神経研究所免疫研究部の佐藤和貴郎室長、山村隆部長らの研究グループは、筋痛性脳脊髄炎/慢性疲労症候群(ME/CFS)の新たな免疫異常を発見し、それが診断に有用な血液診断マーカーとなりうることを発見しました。
筋痛性脳脊髄炎/慢性疲労症候群(ME/CFS)は、年余にわたる強い疲労感や脱力、記憶や注意、思考の障害、その他様々な症状のために日常生活を送ることが困難となる原因不明の慢性疾患ですが、血液検査や脳画像検査で異常がでないために診断が難しく、医学研究、治療法の開発が中々進まないというのが現状です1)。しかし近年、脳内炎症を示す研究論文や免疫治療の有効性を示唆する報告が発表されたことを受け、世界的にME/CFSの研究が活性化し、注目されています。研究グループはリンパ球の一種であるB細胞に着目した研究を展開し、B細胞受容体(BCR)レパトア解析*1という手法を用い、特定のB細胞受容体が患者群で増加していること、この解析法が診断マーカーとしても有用であることを突き止めました。この研究成果は、ME/CFSにおける感染と免疫病態の関連性の理解につながるものであり、ME/CFSの客観的診断法の確立や治療薬開発への応用が期待されます。
この研究成果は、「Brain Behavior and Immunity」オンライン版に報道解禁日を2021年4月27日午後3時として掲載されます。
研究の背景
筋痛性脳脊髄炎/慢性疲労症候群(ME/CFS)は、長期間にわたって睡眠や休息で改善しない強い疲労感や脱力、その他さまざまな症状によって、日常生活を送るのが困難になる原因不明の病気です。仕事や勉強、家事などの「労作」のあと何日も起きあがれなくなるなど、身体的・認知的・精神的な負荷のあとに極端な症状の悪化(労作後の消耗)が起こることが特徴です1)。通常、睡眠障害(過眠や不眠、熟眠感がないなど)および認知機能障害(記憶や集中力、思考力の低下)を伴います。その他、微熱が続く、体温調節が困難になる、立っているのが難しい(POTS:体位性頻脈症候群)、音や光、匂いや化学物質に耐えられない(刺激過敏や化学物質過敏症)などの症状が多いことや、全身の強い痛み(線維筋痛症に類似した症状)、腹痛や下痢、便秘が持続する過敏性腸症候群を合併しやすいことが知られています。
この病気の診断は、特徴的な症状の組み合わせと他の病気の可能性を除外することによって行われますが、診断がなかなかつかないケースが多いのが実情です。理由の一つに、血液検査や画像検査では異常が出ないことがあげられます。また根治的な治療法もなく、活動量の調整(適切な休憩)や対症療法が試みられているのが現状で、この病気に対し保険適応が認められた治療法・薬剤はまだありません。
ME/CFSは、発熱や喉の痛み、嘔吐や下痢などの「風邪症状」を契機に突然発症することが多いことから、ウイルスや細菌が免疫系に作用することが発症に重要と考えられています。2003年にはカナダや香港でSARS感染後のME/CFS集団発生が報告されています。そのほか、毒物(例:有機リン系殺虫剤)への曝露、予防接種、大きな外傷やトラウマの後に発症することがありますが、いずれも免疫系に影響を及ぼす可能性があります。しかし先行する疾患や外傷が一切認められない患者もいますし、疾患の長期化に関わる因子もまだよく分かっていません。
海外からの報告によると、リンパ球の一種であるB細胞を除去する治療(抗体療法)や抗体を吸着し除去する治療(免疫吸着療法)が少なくとも一部の患者には有効のようです。また、ME/CFSの中核となる症状は脳機能の異常と考えることができ、PETを用いた脳画像研究により「脳内炎症」の証拠が示されており、MRI画像の詳細な解析(拡散テンソル解析)から、炎症でダメージを受けた部位が推定されています。このような背景から、研究グループはME/CFSを神経免疫疾患としてとらえ、その病態の解明を目指した研究を進めています。
研究成果
ME/CFSを疑われ、NCNP病院を紹介受診し、国際的に使用されているME/CFSの診断基準を満たす患者から同意を得て血液を採取し解析に使用しました。ME/CFS患者のB細胞の特徴を調べるために、1)B細胞受容体(B cell receptor: BCR)の種類の頻度分布、2)B細胞の一種であるプラズマブラスト(Plasmablast)に着目した解析を実施しました。
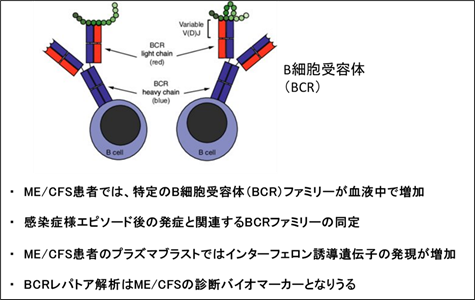
B細胞は、T細胞とともに獲得免疫系を担う細胞で、多種多様な病原体に反応し、抗体産生やT細胞への抗原提示、サイトカイン産生などの機能を発揮することで、感染症制御に役立ちますが、自己免疫疾患では悪化に働く細胞であり、重要な治療標的となっています。B細胞はその表面に抗体と同じ構造をしたB細胞受容体を出していますが、遺伝子再構成など多様性を生み出す仕組みを用いて多種多様なB細胞受容体が作られます。B細胞が多種多様な病原体(すなわち抗原)に対応するために有用な仕組みとなっています。ある人が持っているBCRのコレクションをBCRレパトアといい、個々のBCRが使用している遺伝子を指標にすることによって、BCRレパトアを数多くのBCRファミリーに分類することが可能です。BCR遺伝子を網羅的に解析することによって、ある個人のB細胞がもつ、さまざまな種類のBCRファミリーのそれぞれの頻度を明らかにすることが可能です。過去の報告から、感染症やワクチン、自己免疫疾患では特定の種類のBCRファミリーが増えていることが分かっています。
今回、次世代BCRレパトア解析という新しい技術を使って(用語解説参照)ME/CFS患者のBCRレパトアを調べてみたところ、健常者集団と患者集団ではBCRレパトアが有意に異なることを確認しました。すなわち、患者集団では特定のBCR遺伝子を発現しているBCRファミリーの増加傾向が認められ、これらは、ある種の抗原に反応して選択的に増加したB細胞集団の増加を反映したものであると考えられました。得られたデータを基にROC解析という統計解析を行ったところ、かなり良い精度で患者と健常者を区別できることもわかりました。さらに、最初の解析を実施したあとで研究に参加したME/CFS患者集団で追試をしたところ、ほぼ同様の結果が再現されました。
研究に参加した患者の約半数は、明確な感染症様エピソードを経て病気を発症していました。そこで感染症様エピソードとBCRの関係について調べたところ、IGHV3-30(および近縁の3-30-3)を持つBCRファミリーを持つ患者は、感染症様エピソードのあとME/CFSを発症し、また発症後の期間が比較的短い患者でとくに多いことがわかりました。またBCRが抗原と結合する部位として重要なCDR3(相補性決定領域3)について調べたところ、特定の長さのCDR3をもつIGHV3-30(3-30-3)がとくに増えていることが確認でき、抗原によって選択されたことが強く示唆されました(図1、図2)。
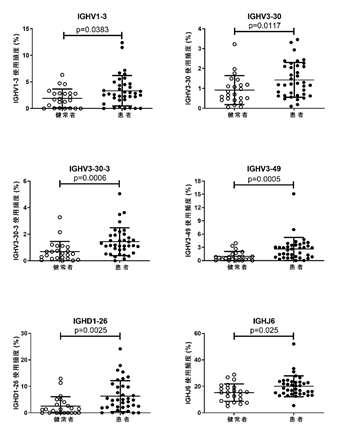
図1:患者と健常者のB細胞受容体を構成する遺伝子の頻度分布IGHV1-3など6つのB細胞受容体ファミリーにおいて、患者集団は健常者集団と比較し有意にその頻度が高かった。個々の丸は個人ごとのデータを示す。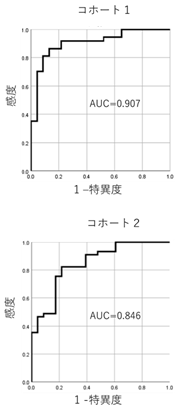
図2:6つのB細胞受容体ファミリーの頻度データを用いて作成したROC曲線二つの別の時期に参加した患者集団(コホート1、コホート2)において、良好な感度・特異度で患者集団と健常者集団を区別できることがわかった。(AUC: Area under the curve)
一方、フローサイトメーターを用いて、レパトア解析と同じ集団の血液中のB細胞の頻度を調べた結果、患者群では健常者群と比較し、B細胞の頻度が有意に高いことがわかりました。B細胞の一種であるプラズマブラストは、全身性エリテマトーデスや視神経脊髄炎など自己抗体の産生を特徴とする疾患で増加していることが知られていますが、ME/CFS患者の約20%で増加していました。この細胞のはたらきを調べるため、患者由来のプラズマブラストの特徴について網羅的遺伝子発現解析を行いました。その結果、患者のプラズマブラストではインターフェロン誘導遺伝子と呼ばれる遺伝子の機能が亢進していることがわかりました。インターフェロンはウイルス感染などに伴って体内で産生される物質ですが、患者のプラズマブラストではインターフェロンに反応して起こる細胞活動が慢性的に活性化している可能性が考えられました。興味深いことに、プラズマブラストにおけるインターフェロン誘導遺伝子のはたらきがとくに増えている患者では、IGHV3-30(および3-30-3)の頻度が多いことがわかり、両者は関連していました。
過去の報告によると、IGHV3-30(および3-30-3)はインフルエンザウイルスやマラリア、COVID-19感染症によって誘導されやすいB細胞受容体です。多様な病原体がこのB細胞受容体をもつB細胞に反応すると考えられることから、「抗原」は必ずしも病原体由来とは限らず、自己由来あるいは腸内細菌など共生微生物由来である可能性も考えられ、今後の検討が必要です。
まとめますと、今回の研究成果は、1)B細胞受容体レパトアの異常というこれまで知られていなかったME/CFSの免疫病態の一端が明らかとなったこと、2)B細胞受容体レパトア解析が、診断の難しいME/CFSの血液診断法として有用である可能性を見出したことです。
今後の展望
今回、ME/CFS患者では、BCRのレパートリーにかたよりがあること、とくにIGHV3-30(3-30-3)というBCR遺伝子をもつB細胞の増加は、感染症様エピソード後に発症した患者で認められ、かつ抗体産生能の高いB細胞であるプラズマブラストの機能異常と関連していることが明らかとなりました。 感染症など発症のトリガーとなる刺激が、特定のB細胞受容体の選択という免疫系の変化を長期間にわたって誘導することがわかり、ME/CFSの免疫病態の一端が明らかになりました。
ME/CFSでは、さまざまな抗自律神経受容体抗体が検出されることが報告されており、自律神経異常の原因となっている可能性が指摘されています2)。したがって特定のBCRをもつB細胞が選択的に増え、ME/CFSにおける自己抗体産生を担う細胞となっている可能性が考えられます。私達とNCNP病院放射線診療部の研究グループは、頭部MRI画像解析と抗自律神経受容体抗体の関連を示す研究成果を昨年発表しました3)。自律神経系の神経伝達物質であるノルアドレナリンやアセチルコリンの受容体に対する自己抗体に着目し、MRI画像を用いた構造ネットワーク解析と抗自律神経受容体抗体価との関連について調べたところ、抗β1および抗β2アドレナリン受容体抗体が、ME/CFS患者の痛みを始めとする様々な症状を説明しうる脳内の特定の部位の異常と結びついていることが分かりました。この研究成果と合わせて考察すると、感染症など発症のトリガーとなる刺激が、特定のBCRをもつB細胞を選択的に増やし、抗自律神経受容体抗体産生などを介し、脳機能異常を惹起しているという病態仮説が考えられます。
BCRレパトアのかたよりについて、異なる時期に参加した別のグループの患者を用いた検討でも、同様のかたよりを認め、結果が再現されました。また、患者群で増えていたBCRの頻度情報を用いて、患者と健常者を良い精度で区別することができました。したがってBCRの頻度情報はME/CFSの診断に役立つ可能性があります。今後この方法を実臨床で活用するためには、似たような症状を呈するうつ病などの疾患との比較や、簡便な検査法の開発が必要となります。また、ME/CFS治療として、B細胞除去療法や免疫吸着療法が一部の患者で有効であるとの報告がありますが、BCRのかたよりが治療反応性と関連する可能性が考えられます。今回の発見を契機に、ME/CFS患者の治療法開発が進むことが期待されます。
研究成果のまとめ
用語解説
- ※1 B細胞受容体レパトア解析
- 主要なリンパ球の一つであるB細胞は、抗原を認識する受容体分子として、細胞表面にB細胞受容体(B cell Receptor: BCR)を発現し、病原体などの抗原が結合すると活性化します。遺伝子再構成などの機構によって、多様なBCRが生み出され多様な抗原に反応することが可能となっています。多様なBCRのコレクションをBCRレパトア(レパートリーと同義)と呼びます。具体的には、BCRはV(variable),D(diversity),,J (joining)遺伝子から成り、それぞれIGHV, IGHD, IGHJ遺伝子とよばれています。次世代BCRレパトア解析は、非バイアス遺伝子増幅技術と専用バイオインフォティクスソフトにより、従来の技術と比較し、定量性に優れたレパトア解析です。
参考URL:https://www.repertoire.co.jp/research/technology/repertoire/
参考文献
1)国際ME/CFS学会編「臨床医のための手引書 2014年版
原文のURL
https://growthzonesitesprod.azureedge.net/wp-content/uploads/sites/1869/2020/10/Primer_Post_2014_conference.pdf PDF
和文翻訳のURL
https://mecfs.ncnp.go.jp/wp/wp-content/uploads/2020/06/4b906f6d9911d2f0d1eb62554ce0cb92.pdf PDF
2)Loebel, M., Grabowski, P., Heidecke, H., Bauer, S., Hanitsch, L. G., Wittke, K., … & Scheibenbogen, C. (2016). Antibodies to β adrenergic and muscarinic cholinergic receptors in patients with Chronic Fatigue Syndrome. Brain, behavior, and immunity, 52, 32-39.
3)Fujii, H., Sato, W., Kimura, Y., Matsuda, H., Ota, M., Maikusa, N., … & Sato, N.(2020). Altered Structural Brain Networks Related to Adrenergic/Muscarinic Receptor Autoantibodies in Chronic Fatigue Syndrome. Journal of Neuroimaging, 30(6), 822-827.
上記論文に関するNCNPプレスリリースのURL
https://www.ncnp.go.jp/topics/2020/20200703.html
原著論文情報
- タイトル
- Skewing of the B cell receptor repertoire in myalgic encephalomyelitis/chronic fatigue syndrome
- 著者名
- Wakiro Sato, Hirohiko Ono, Takaji Matsutani, Masakazu Nakamura, Isu Shin, Keiko Amano, Ryuji Suzuki and Takashi Yamamura
- 雑誌
- Brain Behavior and Immunity
- DOI
- 10.1016/j.bbi.2021.03.023
助成金
本研究成果は、以下の事業・研究領域・研究課題によって行われました。
- 日本医療研究開発機構(AMED)障害者対策総合研究開発事業「筋痛性脳脊髄炎/慢性疲労症候群に対する診療・研究ネットワークの構築(研究代表者:山村 隆)」「筋痛性脳脊髄炎/慢性疲労症候群(ME/CFS)の血液診断法の開発(研究代表者:佐藤和貴郎)」
- 国立精神・神経医療研究センター・精神・神経疾患研究開発費
お問い合わせ先
研究に関する問い合わせ
国立研究開発法人国立精神・神経医療研究センター
神経研究所 免疫研究部
部長 山村 隆
室長 佐藤 和貴郎
報道に関するお問い合わせ
国立研究開発法人国立精神・神経医療研究センター
総務課広報係
事業に関するお問い合わせ
国立研究開発法人日本医療研究開発機構(AMED)
ゲノム・データ基盤事業部 医療技術研究開発課