2021-05-21 東京都医学総合研究所,日本医療研究開発機構
公益財団法人東京都医学総合研究所 脳卒中ルネサンスプロジェクトの中村 幸太郎研修生(東京大学大学院新領域創成科学研究科 博士課程1年)、七田 崇 プロジェクトリーダーらの研究グループは、脳梗塞モデルマウス(注1)を用いた実験により、脳梗塞をさらに悪化させる「脳内炎症」の新たなメカニズムを解明しました。
脳梗塞は発症後に後遺症が残る場合も多く、生活の質(クオリティ・オブ・ライフ)を著しく低下させます。超高齢化社会を迎えた日本のみならず世界中で健康寿命を短縮する主原因となることから、治療法の開発が強く望まれてきました。また、脳梗塞の有効な治療法は未だ限られており、特に発症早期に限定されていることから、脳梗塞発症から長時間経っても効果がある治療法の開発が強く望まれていました。
本研究グループは、脳梗塞を悪化させる脳内炎症が引き起こされるメカニズムに着目し、次の3点を明らかにしました(図1)。
①脳の神経細胞に存在するDJ-1タンパク質は、これまでパーキンソン病などで細胞を保護する作用をもつと報告されていましたが、脳梗塞後の脳内では免疫細胞を活性化し、脳内炎症を引き起こす因子(DAMPs(注2))として作用することを明らかにしました。
②DJ-1タンパク質の構造を解析した結果、炎症を引き起こすために必要な、これまでに報告されたDAMPsには見られないアミノ酸配列(αG-αHヘリックス)を同定しました。
③さらに、脳梗塞モデルマウスにDJ-1タンパク質の作用を中和する抗体を投与したところ、脳梗塞症状の改善が認められました。
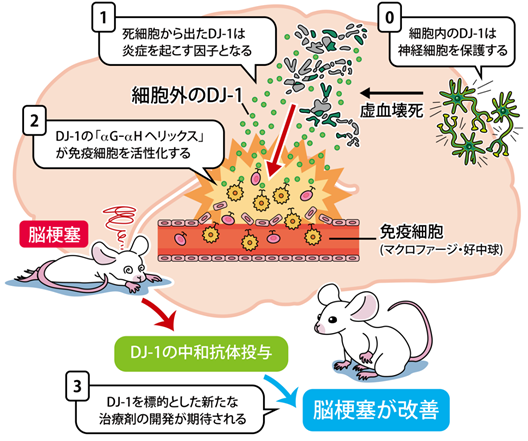
図1 DJ-1タンパク質は脳内炎症を引き起こす因子である
細胞内のDJ-1タンパク質は酸化防止作用により神経細胞を保護する。①脳梗塞により虚血壊死に陥った神経細胞から細胞外に放出されたDJ-1タンパク質は炎症を引き起こす因子として作用する ②DJ-1タンパク質のαG-αHヘリックス配列が脳梗塞後の脳内に浸潤してきた免疫細胞を活性化して炎症を引き起こす ③DJ-1タンパク質の作用を中和する抗体を投与すると脳梗塞の症状(梗塞体積・神経症状)が改善されたことから、DJ-1タンパク質は脳梗塞治療における新たな治療標的になると期待される。
これらの成果は、脳内炎症を引き起こす因子であるDJ-1タンパク質を標的とした新規治療剤の開発に繋がる可能性があり、今後の脳梗塞治療への応用が期待されます。
本研究成果は、2021年5月21日(日本標準時)に米国科学誌『PLOS Biology』のオンライン版に掲載されます。
論文情報
- 論文タイトル
- “Extracellular DJ-1 induces sterile inflammation in the ischemic brain.”
(細胞外のDJ-1は脳梗塞における無菌的な炎症を引き起こす) - DOI
- 10.1371/journal.pbio.3000939
- URL
- https://doi.org/10.1371/journal.pbio.3000939
ポイント
- パーキンソン病で細胞保護作用をもつことが知られていたDJ-1タンパク質が、脳梗塞を悪化させる「脳内炎症」を引き起こすことを発見した。
- DJ-1タンパク質が持つアミノ酸配列に、脳内炎症を引き起こす作用があることを明らかにした。
- 今後、DJ-1タンパク質を治療標的とした脳梗塞治療への応用が期待される。
研究の背景
脳梗塞を含む脳卒中は日本において死因の第3位であり、寝たきりの原因の第1位です。近年、超高齢化社会や糖尿病・高脂血症を始めとした生活習慣病患者の増加も影響し、脳卒中の患者数は2017年には112万人にのぼりました。脳梗塞は脳の血管が詰まることで発症し、脳組織が傷害され、手足のまひや言語障害などの後遺症が長きにわたり続く可能性がある疾患です。これら後遺症は脳梗塞患者の生活の質を著しく低下させ、健康寿命を短縮する主原因となり得るため、世界中で治療法の開発が強く望まれてきました。しかし、既存の治療法である血栓溶解療法や血栓除去術は脳梗塞を発症してから数時間のみしか使えないなどの厳しい制約があり、患者の生活機能を改善できる治療は未だ乏しい状況です。
本研究グループは脳梗塞を発症してから長時間経っても効果がある治療法の開発を目指してきました。そこで、着目したのが脳梗塞の発症後に引き起こされる「脳内炎症」です。脳梗塞発症後の脳内では、脳組織の傷害に伴って生体内の免疫系が活性化されます。免疫系が活性化されると脳内で炎症が引き起こされ数日間持続しますが、この炎症により脳組織はさらに傷害され脳梗塞をさらに悪化させます。つまり、脳内炎症が引き起こされるメカニズムを明らかにできれば、これを標的とした治療可能時間の長い新たな治療法の開発につながると考えています。
私たちの身体は免疫系によって外界から侵入してきた細菌やウイルスなどの病原体から守られています。病原体が体内に侵入すると、細菌の成分やウイルス由来のタンパク質といった病原体の一部を、マクロファージ・好中球(注3)と呼ばれる免疫細胞がいち早く認識し、生体防御のため炎症が引き起こされます。しかし、脳は血液脳関門(注4)とよばれるバリアを介して外部からの異物の侵入を防いでいる極めて無菌的な臓器であり、脳梗塞では通常病原体は存在しません。
では、なぜ脳梗塞でも炎症が起こるのでしょうか?近年、細胞死や組織の損傷など、細胞のダメージに伴って放出される、自己の組織由来のタンパク質、DNAやRNAなどの核酸によっても免疫系が活性化され、炎症が引き起こされることが明らかとなってきました。このような自己の組織由来の炎症(無菌的な炎症)を引き起こす因子は「ダメージ関連分子パターン(DAMPs)」と呼ばれます(図2)。脳梗塞において炎症を引き起こす因子に関するこれまでの解析は不十分であったため、そうした因子を同定できれば、画期的な治療標的となると考えました。
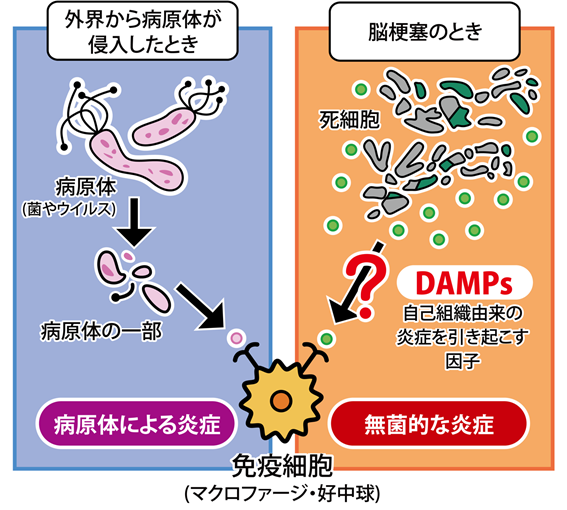
図2 脳梗塞ではDAMPsにより無菌的な炎症が引き起こされる
通常外界から病原体が侵入すると免疫細胞は、受容体を介して病原体の一部を認識して活性化し、炎症を引き起こす。一方で脳梗塞の場合、免疫細胞は組織傷害や細胞死に伴って自己の細胞から放出される自己組織由来の炎症を引き起こす因子によっても活性化し、無菌的な炎症を引き起こす。脳梗塞において炎症を引き起こす因子に関するこれまでの解析は不十分であったため、そうした因子を同定できれば、画期的な治療標的となると考えられる。
研究の内容
本研究グループは、これまでに脳梗塞モデルマウスを用いて脳梗塞における炎症惹起因子を探索し、ペルオキシレドキシンタンパク質(注5)を炎症惹起因子として同定しました。しかし、ペルオキシレドキシンタンパク質だけでは脳内炎症を引き起こす作用が弱く、脳にはさらに重要な炎症惹起因子が存在すると考えられました。そこで、さらなる炎症を引き起こす因子を探索したところ、機能不全によりパーキンソン病の原因にもなるDJ-1タンパク質が、今回脳梗塞後の脳内炎症を引き起こす作用をもつことを明らかにしました。
主な研究成果は以下の3点です(図3)。
- ①DJ-1タンパク質は脳内炎症を引き起こす因子として作用する
- DJ-1タンパク質は細菌から哺乳類まで幅広く生体内に存在し、通常は細胞内にあり、細胞に有害な過酸化水素を無毒化する酸化防止酵素として知られていました。また、これまで神経細胞内に存在するDJ-1タンパク質は酸化防止作用により、脳梗塞による強い酸化ダメージから細胞を保護する作用を持つと報告されてきました。
研究グループは、脳梗塞の発症から12-24時間後にDJ-1タンパク質が虚血壊死に陥った神経細胞から、細胞の外に放出されることを発見しました。細胞外のDJ-1タンパク質は、脳梗塞後の脳内に浸潤してくるマクロファージ・好中球などの免疫細胞の細胞表面に発現しているトル様受容体(Toll like receptor, TLR(注6))のうち、TLR2ならびにTLR4と直接結合することを明らかにしました。DJ-1タンパク質はTLR2ならびにTLR4を介して免疫細胞を活性化し、炎症性サイトカインの産生を促したことから、脳内炎症を引き起こす因子、すなわちDAMPsであることが世界で初めて示されました。 - ②DJ-1タンパク質の特定のアミノ酸配列に炎症を引き起こす作用があることを同定した
- DJ-1タンパク質の構造を解析したところ、αG-αHヘリックスと呼ばれるアミノ酸配列が、免疫細胞を活性化して炎症を引き起こすために必要な配列であることを同定しました。この配列はこれまで報告されたDAMPsには見られず、DJ-1タンパク質に特異的な配列であることを明らかにしました。
- ③DJ-1タンパク質の作用を中和すると、脳梗塞モデルマウスの脳梗塞の症状が改善した
- DJ-1タンパク質の遺伝子を欠損したマウスを用いて脳梗塞モデルを作製したところ、DJ-1タンパク質が存在しないと脳梗塞後の脳内炎症が著しく抑制されたことから、DJ-1タンパク質は脳内炎症に重要な因子であることが示されました。そこでDJ-1タンパク質の作用を中和する抗体を作製し、脳梗塞モデルマウスに投与したところ、脳梗塞後の脳組織における炎症性サイトカインの産生が抑制され、さらに脳梗塞体積の減少や神経症状の顕著な改善が認められました。
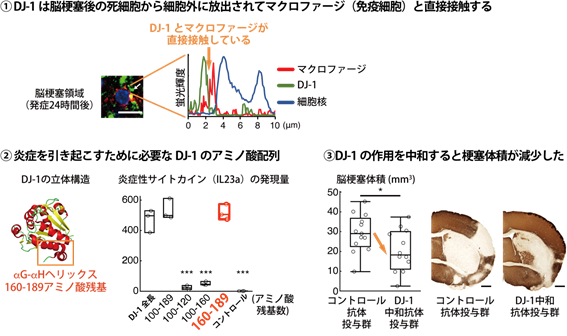
図3 DJ-1タンパク質を標的とした新規治療法の開発に繋がる可能性
①(左)脳梗塞発症から24時間後のマウスの脳梗塞組織を免疫染色した写真。緑はDJ-1タンパク質、赤は免疫細胞であるマクロファージの細胞表面、青はマクロファージの細胞核を示す(スケールバー:10μm)。(右)蛍光輝度を定量すると、DJ-1とマクロファージが直接接触していることがわかる。
②(左)DJ-1タンパク質のうち160-189アミノ酸残基(αG-αHヘリックス)の配列が炎症を引き起こすために必要な配列であることが明らかとなった。(右)DJ-1タンパク質(全長:1-189アミノ酸残基)のうち様々な長さの配列を作製して培養マクロファージを刺激し、炎症性サイトカイン(IL-23a)の産生を定量したところ、160-189アミノ酸残基の配列でDJ-1タンパク質の全長と同程度の活性が認められた。
③DJ-1タンパク質の作用を中和する抗体を脳梗塞モデルマウスに投与した結果、発症から7日後の梗塞体積がコントロール抗体投与群と比較して有意に減少した(*: P<0.05, スケールバー:500μm)。
社会的意義・今後の展望
本研究によって脳梗塞における新しい脳内炎症メカニズムが明らかとなりました。DJ-1タンパク質はヒトの脳内においても発現していることから、DJ-1タンパク質を標的として、脳内炎症を抑制しうる新たな治療法の開発につながる可能性があり、今後の脳梗塞治療への応用が期待されます。
さらにがんや、パーキンソン病などの神経変性疾患患者において、細胞内のDJ-1タンパク質が増加することが報告されています。これらの疾患でも炎症が観察されることから、細胞外に放出されたDJ-1タンパク質が、がんや神経変性疾患にも影響を与えている可能性があり、過剰な炎症や組織傷害を伴う疾患に対する新たな治療標的にもなり得ることが期待されます。
用語解説
- (注1)脳梗塞モデルマウス
- 脳梗塞の動物モデルとして知られている。マウスの脳血管を閉塞させ人為的に脳梗塞をおこしたマウス。本研究では、細い塞栓糸を頚動脈から挿入して脳血管(中大脳動脈)に到達させることにより閉塞させる手技を用いて作製した。
- (注2)ダメージ関連分子パターン(Damage-Associated Molecular Patterns, DAMPs)
- 細胞死や細胞の損傷など、細胞のストレスに伴って細胞から受動的に細胞外に放出され、周囲の組織や免疫細胞などに危険を知らせるアラームのような役割を担う因子のこと。これまでに、HMGB1やHSP(Heat shock protein)などのタンパク質やヒアルロン酸、酸化型LDL、核酸などがDAMPsとして機能することが知られている。
- (注3)マクロファージ・好中球
- 血液や骨髄などに存在する免疫細胞。細菌やウイルスなどの微生物の侵入や臓器の異常の際にいち早く活性化して免疫応答を起こす役割を持つ。細菌・ウイルス由来の物質や、死細胞由来の物質を認識すると活性化して、様々な炎症性サイトカインを産生する。これらは、免疫細胞の臓器への浸潤を促進したり、血管を拡張させて浮腫を起こしたりするなど、他の免疫細胞や臓器の細胞が起こす炎症を促進する効果がある。
- (注4)血液脳関門(Blood-brain barrier, BBB)
- 脳の血管と脳細胞の間での、特定の物質以外の物質交換を制限する機構である。病原体などの血液からの非特異的な脳中枢への侵入や、脳内産生物質の血液への流出を阻止する物理的な障壁として機能する。
- (注5)ペルオキシレドキシンタンパク質(Peroxiredoxin, Prx)
- ペルオキシレドキシンタンパク質は、細胞に対して有毒な過酸化水素(H2O2)などの活性酸素種を無毒化する酸化防止酵素として細菌から哺乳類の細胞内にも存在することが知られていていた。哺乳類ではこれまでに、6種類(Prx1~Prx6)のペルオキシレドキシンファミリータンパク質が同定されている。
- (注6)トル様受容体(Toll like receptor, TLR)
- 自然免疫系の免疫細胞が発現する受容体。主に細菌のリポ多糖や脂質タンパク質、ウイルス由来のDNAやRNAといった核酸を認識し、細胞内にシグナルを伝えることで多様な免疫応答を引き起こす。近年は、組織傷害によって放出されたDAMPsを認識する受容体としても注目されている。それぞれ認識する物質が異なる9種類のトル様受容体(TLR1-9)が報告されている。
本研究の主な助成事業
日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMED-CREST)「生体組織の適応・修復機構の時空間的解析による生命現象の理解と医療技術シーズの創出」研究開発領域における研究開発課題「脳卒中・認知症の完全回復に向けた持続可能な神経回路の再構築を実現する治療開発」(研究開発代表者:七田 崇)(JP20gm121001)、同(PRIME)「画期的医薬品等の創出をめざす脂質の生理活性と機能の解明」研究開発領域における研究開発課題「神経組織の修復過程に関わる機能的脂質の同定と治療応用」(研究開発代表者:七田 崇)(JP20gm5910023)、新学術領域研究「スクラップ&ビルドによる脳機能の動的制御」(JP19H04765)、新学術領域研究「予防を科学する炎症細胞社会学」(JP20H04957)、日本学術振興会(JSPS)科学研究費補助金(JP20J21472、JP17H05096、JP18K14831、JP17K15204)、東レ科学振興会、武田科学振興財団、三菱財団、先進医薬研究振興財団、MSD生命科学財団、千里ライフサイエンス振興財団、小野医学研究財団の支援を受けました。
お問い合わせ先
研究に関すること
東京都医学総合研究所
七田 崇(シチタ タカシ)
東京都医学総合研究所に関すること
東京都医学総合研究所 事務局研究推進課
武仲・大井
AMEDに関すること
国立研究開発法人日本医療研究開発機構(AMED)
シーズ開発・研究基盤事業部 革新的先端研究開発課