2021-05-25 大阪大学,日本医療研究開発機構
研究成果のポイント
- 新型コロナウイルスに感染すると、感染を防ぐ中和抗体ばかりでなく、感染を増強させる抗体(感染増強抗体)が産生されることを発見した。
- 感染増強抗体が新型コロナウイルスのスパイクタンパク質の特定の部位に結合すると、抗体が直接スパイクタンパク質の構造変化を引き起こし、その結果、新型コロナウイルスの感染性が高くなることが判明した。
- 感染増強抗体は中和抗体の感染を防ぐ作用を減弱させることが判明した。
- 新型コロナウイルス感染症(COVID-19)重症患者では、感染増強抗体の高い産生が認められた。また、非感染者においても感染増強抗体を少量持っている場合があることが判明した。
- 感染増強抗体の産生を解析することで、重症化しやすい人を検査できる可能性がある。また、本研究成果は、感染増強抗体の産生を誘導しないワクチン開発に対しても重要である。
概要
大阪大学の荒瀬尚教授を中心とした微生物病研究所・蛋白質研究所・免疫学フロンティア研究センター・感染症総合教育研究拠点・医学系研究科等から成る研究グループは、COVID-19患者由来の抗体を解析することにより、新型コロナウイルスに感染すると感染を防御する中和抗体ばかりでなく、感染性を高める感染増強抗体が産生されていることを初めて発見しました。本研究成果は2021年5月24日(月)に米国科学雑誌Cell誌に掲載されました。
研究の背景
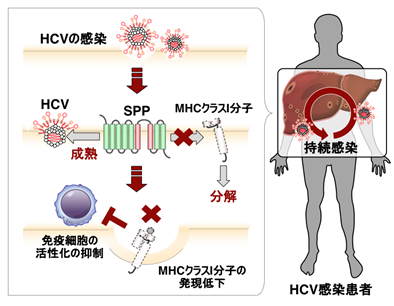
新型コロナウイルスのスパイクタンパク質の受容体結合部位(RBD)*1に対する抗体は、ヒトの受容体であるACE2*2との結合を阻害することにより、新型コロナウイルスの感染を抑える中和抗体として重要な機能を担っている(図1)。実際、最近の様々な変異株が中和抗体の認識部位に変異を獲得したことから、抗体がウイルスの排除に非常に重要な機能を担っているために、ウイルスが中和抗体に認識されない変異を獲得したと考えられる。一方、COVID-19患者においては、中和抗体以外にスパイクタンパク質に対する多くの抗体が産生されるが、これまでそれらの抗体の詳細な機能は明らかでなかった。
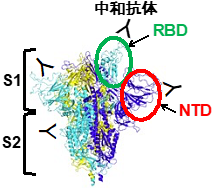
図1スパイクタンパク質の構造 スパイクタンパク質は3量体(青色、水色、黄色)をとり、S1とS2領域から成る。S1領域は、さらにRBDとNTD*3に分けられる。
前述の通り抗体はウイルス感染防御に重要な機能を担う一方で、ウイルスに対する抗体によって感染が増悪する現象が知られており、その現象は抗体依存性感染増強(ADE)*4と言われている。ADEはデングウイルス等で知られており、一度デングウイルスに感染した後、異なる型のデングウイルスに感染すると、最初の感染によって産生された抗体によって重症化する場合がある。また、コロナウイルスの一つである猫伝染性腹膜炎ウイルスにおいても、ウイルスに対する抗体が増悪因子になることが報告されている。これらの抗体による感染増強には、ある種の免疫細胞が発現しているFc受容体が関与していると考えられてきた。すなわち、ウイルス粒子に結合した抗体が細胞のFc受容体に結合すると、Fc受容体を介してウイルス感染が引き起こされる。しかし、これらのFc受容体を介した感染は、Fc受容体を発現した特定の免疫細胞に限定されるため、体の中の多くの細胞の感染にはあまり関与していないと考えられてきた。
そこで、本研究では、COVID-19患者で産生される抗体の機能を解明するために、COVID-19患者の免疫細胞からクローニングされたスパイクタンパク質に対する抗体遺伝子をヒト細胞に発現させて用意した76種類のスパイクタンパク質に対する抗体の機能を詳細に解析した。その結果、今までに知られていたFc受容体*5を介した抗体依存性感染増強とは全く異なり、ウイルス粒子に結合するだけで感染性をFc受容体非依存性に高める抗体が存在することが明らかになった。
本研究の内容
感染増強抗体の解析
スパイクタンパク質はNTD、RBD、S2から構成される(図1)。COVID-19患者の免疫細胞から同定された76種類のスパイクタンパク質に対する抗体を解析したところ、スパイクタンパク質へのACE2の結合を阻害するRBDに対する抗体ばかりでなく、ACE2の結合性を増加させる抗体がNTDに対する抗体の中に存在することが判明した(図2、以下感染増強抗体)。一方、ほとんどの抗体は、スパイクタンパク質に結合しても、ACE2の結合性に影響を与えなかった。
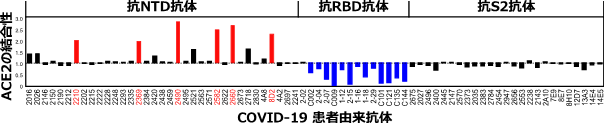
図2スパイクタンパク質へのACE2の結合性を阻害する抗RBD中和抗体(青)ばかりでなく、ACE2の結合性を増加させる抗NTD感染増強抗体(赤)も存在することが明らかになった。
これらの感染増強抗体は濃度依存性にACE2の結合性を増加させたが、それ以外のNTDに対する抗体にはACE2の結合性の増加は認められなかった(図3)。
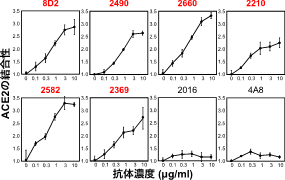
図3抗NTD感染増強抗体(赤字)をスパイクタンパク質発現細胞に加えるとACE2の結合性が濃度依存性に増加した。一方、抗NTD抗体でもACE2の結合性を増加させない抗体も存在した(黒字)。
さらに、これらの感染増強抗体は、中和抗体によるACE2結合阻害能を減弱させることが判明した(図4左)。つまり、感染増強抗体が産生されると、中和抗体の効きが悪くなる可能性が考えられる。また、感染増強抗体は実際に新型コロナウイルスのヒト細胞への感染性を顕著に増加させることが判明した(図4右)。感染増強抗体による感染性の増加は、抗体によるスパイクタンパク質への直接的な影響であり、Fc受容体は関与していない。従って、今までに知られていた抗体依存性感染増強とは全く異なる新たなメカニズムが存在することが判明した。
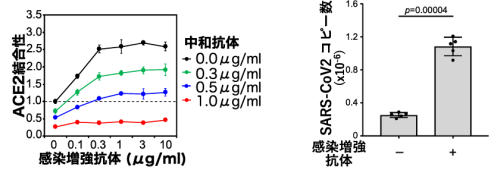
図4感染増強抗体は、中和抗体によるACE2結合性阻害能を減弱させた(左)。感染増強抗体は、新型コロナウイルス(SARS-CoV2)のACE2発現細胞への感染性を増強した。
次に、感染増強抗体の認識部位を明らかにするために、NTDの様々なアミノ酸をアラニンへ置換することによって、感染増強抗体のエピトープの解析を行った。その結果、感染増強抗体はいずれもNTDの特定の部位を認識することが明らかになった(図5左)。さらに、抗体の結合様式を解析するためにクライオ電子顕微鏡法*6にて、抗体とスパイクタンパク質との複合体を解析すると、NTDの下面に結合することが判明した(図5右)。

図5感染増強抗体は、いずれもNTDの特定の部位(W64,H66,K187,V213,R214)を認識し(左)、クライオ電子顕微鏡法によりNTDの下面側に結合することが判明した(右)。
抗NTD感染増強抗体による感染増強のメカニズムについての解析
抗NTD感染増強抗体による感染増強のメカニズムについて解析を行った。ACE2はスパイクタンパク質のRBDが開いた構造をとると結合しやすくなり、感染性が高まることが知られている。そこで、開いたRBDに特異的な抗体を用いて感染増強抗体の影響を解析したところ、抗体がNTDの感染増強部位に結合するとスパイクタンパク質のRBDが開いた構造をとりACE2と結合しやすくなることが明らかになった。さらに、NTD同士が抗体で架橋されることでNTDが引っ張られ、その結果、RBDが開いた構造をとることが明らかになった(図6)。これらのことから、スパイクタンパク質のNTDはRBDの機能を制御する重要な機能領域であることが明らかになった。
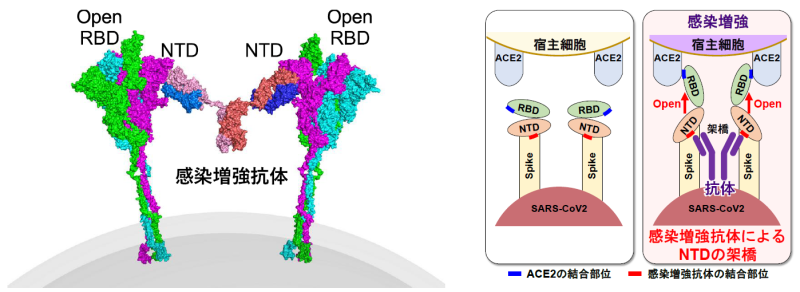 図6感染増強抗体がスパイクタンパク質のNTDに結合すると、抗体によってNTDが牽引された結果、スパイクタンパク質の構造が変化してACE2に結合しやすい開いた構造のRBDが誘導されるとことが判明した。
図6感染増強抗体がスパイクタンパク質のNTDに結合すると、抗体によってNTDが牽引された結果、スパイクタンパク質の構造が変化してACE2に結合しやすい開いた構造のRBDが誘導されるとことが判明した。
COVID-19患者における感染増強抗体の解析
COVID-19患者における感染増強抗体の解析を行った。競合阻害法によって、感染増強抗体が特異的に検出できることが判明した。そこで、COVID-19患者における感染増強抗体と中和抗体を測定し、その差を解析することにより、重症患者では感染増強抗体が高い傾向が認められた。また非感染者においても感染増強抗体を持っている人が存在することが判明した(図7)。従って、感染増強抗体を持っている人の感染やワクチン投与によって、感染増強抗体の産生が高まる可能性が考えられた。
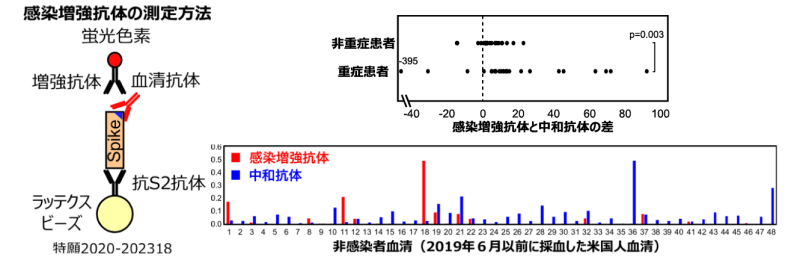 図7感染増強抗体(赤丸、黒Y)の特異的検出法を樹立した(左)。次いで、COVID-19患者の抗体価を解析したところ、重症患者で感染増強抗体価が高い傾向が認められた(右上)。また、非感染者においても、低レベルの新型コロナウイルスに対する感染増強抗体を持っている人がいることが判明した(右下)。
図7感染増強抗体(赤丸、黒Y)の特異的検出法を樹立した(左)。次いで、COVID-19患者の抗体価を解析したところ、重症患者で感染増強抗体価が高い傾向が認められた(右上)。また、非感染者においても、低レベルの新型コロナウイルスに対する感染増強抗体を持っている人がいることが判明した(右下)。
本研究の成果
新型コロナウイルスに感染すると中和抗体ばかりでなく、感染を増強する抗体が産生されることが判明した。さらに、感染増強抗体が産生されると、中和抗体の作用が減弱することが判明した。中和抗体はRBDを認識するのに対して、感染増強抗体はNTDの特定の部位を認識することが明らかとなった。また、感染増強抗体は重症患者で高い産生が認められたほか、非感染者でも感染増強抗体を少量持っている場合があることが判明した。
本研究の考察と意義
- 本研究により、新型コロナウイルスのスパイクタンパク質の特定の部位に感染増強抗体が結合するとスパイクタンパク質の構造が変化して新型コロナウイルスの感染性が高まることが明らかになった。
- 感染増強抗体が産生されると、中和抗体の感染を防ぐ作用が減弱することが判明した。実際、重症患者では感染増強抗体の産生が高い傾向があり、感染増強抗体の産生が重症化に関与している可能性もある。しかし、実際に感染増強抗体が体内で感染増悪に関与しているかはまだ不明であり、今後の詳細な解析が必要である。
- これまで機能が不明であったNTDがスパイクタンパク質の機能を制御している重要な領域であることが明らかになった。実際、最近の多くの変異株にはNTDにも多くの変異が認められるので、RBDの機能に影響を与えている可能性がある。従って、今までは、主にRBDの機能のみが注目されてきたが、NTDを標的にした感染制御法の開発も重要であると考えられる。
- 最近の変異株には、中和抗体の認識部位に変異があり中和抗体が十分作用しない株も存在するため、中和抗体の防御効果より、感染増強抗体の増悪効果が高くなってしまう可能性も考えられる。
- 非感染者において低レベルの感染増強抗体を持っている人が明らかになった。既に感染増強抗体を持っている人では、感染やワクチンの接種で感染増強抗体の産生が高まる可能性が考えられる。
- 感染増強抗体を検査することで、重症化しやすい人を調べることが可能になると期待される。また、重症化がどのように進むのか明らかになる可能性がある。重症患者の治療に対しても新たな検査指標になる可能性がある。
- 感染増強抗体の認識部位は現行のワクチン抗原にも含まれている。従って、感染増強抗体の産生を誘導しないワクチン抗原を開発することが望ましい。本研究で明らかになった感染増強抗体の認識部位を改変することで、感染増強抗体の産生を誘導しないワクチン開発が可能になると期待される。
特記事項
本研究は、日本学術振興会(JSPS)科学研究費補助金、日本医療研究開発機構(AMED)新興・再興感染症に対する革新的医薬品等開発推進研究事業、創薬等ライフサイエンス研究支援基盤事業(BINDS)、新型コロナウイルス感染症(COVID-19)に対するワクチン開発の研究支援を受けて実施されました。
用語解説
- *1:RBD(Receptor Binding Domain)
- Receptor Binding Domain (受容体結合領域)は新型コロナウイルスのスパイクタンパク質(Spike)が細胞の受容体であるACE2と結合する領域。閉じた構造のRBDはACE2に対する結合性が低いが、開いた構造のRBDが増えるとACE2に対する結合性が高くなり、感染性が高くなる。
- *2:ACE2
- 新型コロナウイルスが細胞へ感染するときの細胞表面受容体。
- *3:NTD(N-Terminal Domain)
- N-Terminal Domain(N末領域)はスパイクタンパク質(Spike)のアミノ酸のN末の領域で、機能はよくわかっていない領域。
- *4:抗体依存性感染増強(ADE)
- ウイルス粒子に抗体が結合することで感染が増強する現象。これまでは、ウイルス粒子に抗体が結合すると、抗体の受容体であるFc受容体*5を発現しているある種の免疫細胞にウイルスが感染しやすくなると考えられていた。デングウイルス等で見られる抗体依存性感染増強はFc受容体を介しているが、本研究によりFc受容体非依存性の抗体依存性感染増強機構が初めて明らかになった。
- *5:Fc受容体
- 一部の免疫細胞の表面に発現する受容体で、ウイルス等の病原体に付着した抗体に結合して、免疫細胞の活性化などに関与する。
- *6:クライオ電子顕微鏡法
- 電子顕微鏡を用いて、分子の構造を解明する新たな手法。
掲載論文・雑誌
- タイトル
- “An infectivity-enhancing site on the SARS-CoV-2 spike protein targeted by antibodies”
「新型コロナウイルスのスパイクタンパク質の感染増強部位が抗体の標的になる」 - 著者
- Yafei Liu, Wai Tuck Soh, Jun-ichi Kishikawa, Mika Hirose, Emi E. Nakayama, Songling Li, Miwa Sasai, Tatsuya Suzuki, Asa Tada, Akemi Arakawa, Sumiko Matsuoka, Kanako Akamatsu, Makoto Matsuda, Chikako Ono, Shiho Torii, Kazuki Kishida, Hui Jin, Wataru Nakai, Noriko Arase, Atsushi Nakagawa, Maki Matsumoto, Yukoh Nakazaki, Yasuhiro Shindo, Masako Kohyama, Keisuke Tomii, Koichiro Ohmura, Shiro Ohshima, Toru Okamoto, Masahiro Yamamoto, Hironori Nakagami, Yoshiharu Matsuura Atsushi Nakagawa, Takayuki Kato, Masato Okada, Daron M. Standley, Tatsuo Shioda, Hisashi Arase*
*責任著者:荒瀬 尚 - 雑誌名
- Cell 日本時間2021年5月24日(月)以降オンライン掲載
お問い合わせ先
本件に関する問い合わせ先
大阪大学 微生物病研究所 免疫化学分野
荒瀬 尚(あらせ ひさし)教授
AMED事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構
創薬事業部 創薬企画・評価課