2021-07-05 理化学研究所
理化学研究所(理研)生命機能科学研究センター老化分子生物学研究チームの宇野雅晴研究員、西田栄介チームリーダーらの共同研究チームは、線虫[1]の寿命制御に関わる組織間相互作用が神経と腸の間で形成されるフィードバックループ[2]であることを発見しました。
本研究成果は、神経系による老化速度の制御や、カロリー摂取と寿命制御の関係の解明に貢献すると期待できます。
さまざまな動物種において寿命を制御する重要なシグナル伝達経路[3]として「インスリン/IGF1シグナル伝達経路(IIS経路)[3]」が知られています。IIS経路を阻害すると寿命が延びることが分かっていますが、IIS経路がどの組織を介して個体の寿命を制御しているのかは明らかになっていませんでした。
今回、共同研究チームは、個体の寿命制御に関わる組織間相互作用を、シンプルなモデル動物である線虫C. elegansを用いて明らかにしました。組織ごとにIIS経路を阻害する実験を行った結果、寿命制御においてIIS経路が主に機能する組織として、神経および腸組織を同定しました。さらに、神経と腸組織はIIS経路を介したフィードバックループを形成しており、その組織間相互作用が個体の寿命制御において重要な働きをすることを明らかにしました。
本研究は、科学雑誌『iScience』(7月23日号)の掲載に先立ち、オンライン版(6月10日付)に掲載されました。
背景
ヒトが性成熟後平均50~60年も生きるのに対し、カゲロウの一種の雌成虫は成虫になってから産卵して死に至るまで5分以内といわれています。また、一般的なトウモロコシ(スイートコーン)が発芽から実をつけて枯死するまで4カ月程度なのに対し、屋久島の縄文杉は樹齢数千年以上といわれています。このように生物の寿命はさまざまです。このように多様性があるにもかかわらず、少なくとも昆虫や哺乳類などの動物種間には共通の寿命制御機構が存在することが明らかになってきています。
動物の寿命制御に関わる主要な機構の一つは、「インスリン/IGF1シグナル経路(IIS経路)」です(図1)。IIS経路は老化を積極的に制御し、IIS経路を阻害すると寿命が延びることが分かっています。インスリン/IGF1(インスリン様成長因子1)は分泌タンパク質であり、これを受容した細胞では、細胞内のシグナル伝達を経てさまざまな遺伝子の発現が上昇または低下します。IIS経路は、ストレス応答[4]やオートファジー[4]といったさまざまな生命現象に関連する遺伝子の発現を抑制しており、この抑制が解除されることで、生物の坑老化作用が上昇すると考えられています。
多くの細胞で構成される動物の個体機能は、さまざまな組織間の相互作用で支えられています。神経細胞(ニューロン)やホルモン分泌を介した神経系による臓器制御はその代表例ですが、近年、神経系以外の器官も他組織を制御する働きを持つ可能性が示されてきました。IIS経路は最もよく解析されている経路の一つであり、動物のどの組織における機能が重要かなどについて調べられています。また、寿命制御においても、組織間相互作用が重要な役割を果たしていることが分かってきていましたが、IIS経路による寿命制御に関わる組織間のコミュニケーションについては明らかになっていませんでした。
そこで共同研究チームは、IIS経路による寿命制御に関わる組織の検証、ならびに、それら組織間での組織間相互作用の解明を試みました。
研究手法と成果
本研究では、モデル生物である線虫Caenorhabditis elegansを用いました。線虫は寿命が約3週間と短く、線虫で発見された多くの寿命制御機構がショウジョウバエやマウスといった他のモデル生物でも機能していることが知られています。
線虫では、インスリン/IGF1が結合する受容体はDAF-2ただ一つです。インスリン/IGF1がDAF-2に結合してIIS経路が活性化すると、細胞内の転写因子[5]DAF-16が核外に留め置かれます。一方、DAF-2の機能を抑制することでIIS経路を遮断すると、DAF-16の核内移行が亢進します。その結果、DAF-16は坑老化作用を持った遺伝子群の発現を上昇させ、寿命が延長します(図1)。
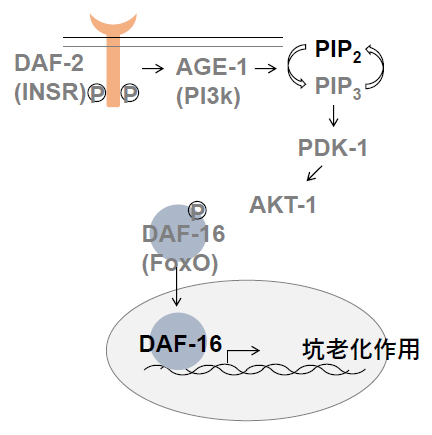
図1 線虫細胞におけるインスリン/IGF1シグナル伝達経路(IIS経路)の模式図
インスリン/IGF1(インスリン様成長因子1)は分泌タンパク質であり、細胞外で受容体DAF-2(INSR)に結合すると、細胞内でDAF-2に結合するAGE-1(PI3k)が活性化され、PIP2をリン酸化してPIP3を生成する。その結果、下流のタンパク質リン酸化酵素(PDK-1、AKT1)は活性化された状態となる。活性化されたAKT1は、細胞質にある転写因子DAF-16をリン酸化することで、DAF-16の核内移行を阻止する。IIS経路が抑制されると、DAF-16の核内移行が亢進し、抗老化作用のある遺伝子群の発現が上昇する。
共同研究チームはまず、寿命制御においてIIS経路が機能する組織を明らかにするために、組織ごとにdaf-2遺伝子とdaf-16遺伝子をノックダウン[6]する実験を行いました。その結果、神経、腸、皮下組織、生殖腺でdaf-2をノックダウンすると寿命が延びる一方、それぞれ同じ組織内でdaf-2に加えてdaf-16も同時にノックダウンすると、寿命延長効果が打ち消されることが分かりました。
このノックダウン実験では、特に神経組織と腸組織におけるIIS経路の抑制が寿命への効果が大きかったことから、これら二つの組織の関係をさらに解析しました。すると、両組織でdaf-2遺伝子を同時にノックアウト[6]しても、単独組織をノックアウトしたとき以上の寿命延長効果はなかったことなどから、神経組織と腸組織のIIS経路が同じメカニズムで寿命を制御している可能性が考えられました。そこで、神経組織のdaf-2遺伝子のノックアウトが腸組織のDAF-16に与える影響、ならびに腸組織のdaf-2遺伝子ノックアウトが神経組織のDAF-16に与える影響について調べました。その結果、神経組織のdaf-2遺伝子をノックアウトすると腸組織のDAF-16の核内移行が大きく亢進し、また、腸組織においてdaf-2遺伝子をノックアウトすると神経組織のDAF-16の核内移行が微弱ながら亢進することが分かりました。
さらに、DAF-16の詳しい転写活性化機能を知るため、DAF-16の標的遺伝子をレポーター遺伝子[7]として用い、DAF-16の活性について解析しました。その結果、神経でdaf-2遺伝子をノックアウトすると、神経の存在する頭部に加えて腸組織においてもレポーター遺伝子の発現が上昇すること、さらに、腸組織においてdaf-2遺伝子をノックアウトしたときも、腸組織に加えて神経の多く存在する頭部においても発現が上昇すること分かりました(図2)。これらの結果から、IIS経路は神経組織と腸組織間でポジティブフィードバックループを形成していることが明らかになりました。
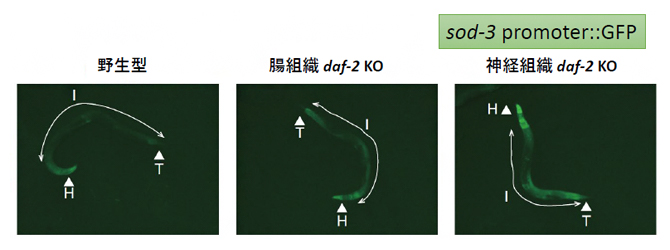
図2 腸組織または神経組織のdaf-2ノックアウトとDAF-16の活性の関係
野生型と比較して、腸組織または神経組織においてdaf-2遺伝子をノックアウトすると、DAF-16の標的遺伝子(sod-3)を用いたレポーター遺伝子の発現が上昇する。ただし、頭部での発現上昇に対しては、神経組織でのノックアウトに比べて腸組織のノックアウトの効果は弱い。各線虫個体の体長は約1mm。Hは頭部を、Iは腸部分を、Tは尾部分を示す。
次に、神経DAF-16と腸DAF-16の間で形成されるポジティブフィードバックループと個体の寿命制御の関係について解析を進めました。神経組織でのdaf-2ノックアウトによる寿命延長に、腸組織のDAF-16が必要か否かを調べるために、神経組織においてdaf-2をノックアウトし、腸組織でdaf-16をノックダウンして寿命を測定しました(図3)。その結果、神経組織のdaf-2ノックアウトによる寿命延長には腸組織のDAF-16が必要であることが分かりました。同様に、腸組織daf-2ノックアウトによる寿命延長に神経組織のDAF-16が必要であることが分かりました。以上のことから、神経‐腸組織間で形成されるDAF-16を中心としたポジティブフィードバックループがIIS経路の寿命制御において重要な役割を果たすことが明らかになりました(図4)。
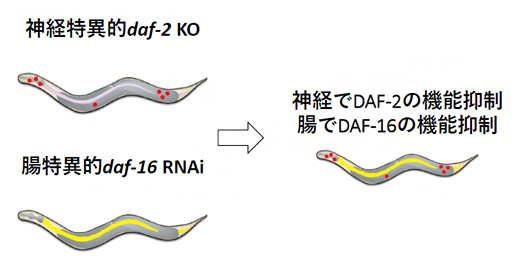
図3 異なる2組織で異なる2遺伝子の操作
組織特異的ノックダウンと組織特異的ノックアウトを組み合わせることにより、二つの異なる組織で二つの異なる遺伝子を同時に操作できる。図は、神経でDAF-2の機能を、腸組織でDAF-16の機能を抑制している。
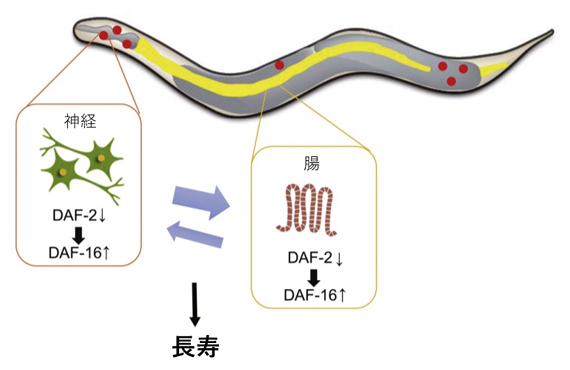
図4 神経と腸組織間のIIS経路を介したフィードバックループによる寿命延長
神経組織と腸組織でのDAF-2の機能抑制による寿命延長効果は、互いの組織でのDAF-16に依存していることから、両組織で機能するIIS経路はDAF-16を中心としたポジティブフィードバックの関係にある。なお、daf-2ノックアウト実験の結果(図2)などから、「腸→神経」への作用は、「神経→腸」よりもやや弱いと考えられる。
今後の期待
本研究から、寿命制御において重要なシグナル伝達経路であるIIS経路による個体寿命制御機構として、転写因子DAF-16を介したポジティブフィードバックループが神経と腸の間で形成され、動物の寿命を制御する組織間コミュニケーションとして機能していることが明らかになりました。
近年、脳による全身性の老化速度制御や、エネルギー経路と寿命制御の関係が注目されています。線虫では、全身性制御の中心は神経組織であり、一方エネルギー代謝の中心は腸組織と考えられています。寿命制御においてこれら2組織の相互作用の重要性を明らかにした本研究成果は、生物の寿命制御機構のさらなる解明に貢献すると期待できます。
補足説明
1.線虫
線形動物門に属する体長1㎜ほどの土壌動物。学名Caeorhabditis elegans。体が無色透明であることから、生きたまま細胞の中を顕微鏡で観察できることや、動物では初めて全ゲノム配列が解読されたこと、発生時の細胞分裂パターン(細胞系譜)が全て分かっていること、遺伝学的な実験手法、遺伝子機能の操作が容易であることなどから、モデル生物として広く利用されている。
2.フィードバックループ
出力が入力に作用することをフィードバックという。複数の要素で構成され、自身の活性化が互いに依存する制御を受ける回路構造となっていることをフィードバックループと呼ぶ。
3.シグナル伝達経路、インスリン/IGF1シグナル伝達経路(IIS経路)
分泌因子が受容体に結合した刺激は、細胞内タンパク質の連鎖的なリン酸化などを介して、最終的に遺伝子の発現制御につながる。この一連の反応をシグナル伝達と呼び、インスリン/インスリン様成長因子(IGF)によるシグナル伝達経路は動物界で進化的に保存されているシグナル伝達の様式の一つである。
4.ストレス応答、オートファジー
ストレス応答とは、熱ショック、活性酸素、高浸透圧、紫外線、放射線、ウイルス感染など、環境からのストレスに対して細胞が示す反応を指す。オートファジーは、細胞が自らの細胞内成分を分解する主要メカニズムで、飢餓や、異常タンパク質の蓄積などのストレスで誘導される。
5.転写因子
遺伝子の発現を調節するタンパク質。DNA上に存在するシス転写調節領域に結合し、DNAを鋳型としてRNAが産生(転写)される時期や量を調節する。
6.ノックダウン、ノックアウト
ノックダウンは、mRNAの分解や翻訳抑制などの操作により、遺伝子機能の発現を大幅に低下させること。本研究では、線虫で一般的に用いられるRNA干渉(RNA interference)と呼ばれる手法を用いた。ノックアウトは、ゲノム上の遺伝子を欠失させることで遺伝子機能を喪失させること。
7.レポーター遺伝子
解析したい遺伝子の発現を簡便に検出、定量する目的で利用される遺伝子のこと。遺伝子組換え技術により、目的の遺伝子のプロモーター下流に連結した融合遺伝子を作り、遺伝子発現を解析する。
共同研究チーム
理化学研究所 生命機能科学研究センター 老化分子生物学研究チーム
チームリーダー 西田 栄介(にしだ えいすけ)
研究員 宇野 雅晴(うの まさはる)
研究員 高橋 知佳(たかはし ちか)
研究員(研究当時) 岸本 沙耶(きしもと さや)
研究員 岡部 恵美子(おかべ えみこ)
研究員 農野 将功(のうの まさのり)
京都大学大学院 生命科学研究科
卒業生 谷 侑利(たに ゆうり)
卒業生 栗原 拓也 (くりはら たくや)
卒業生 安部 亮次 (あべ りょうじ)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究)で実施し、日本医療研究開発機構(AMED)老化機構・制御研究拠点「老化速度制御の基本機構(研究開発分担者:西田栄介)」および革新的先端研究開発支援事業「組織・個体・次世代の恒常性を制御するシグナル伝達システムの解明(研究代表者:西田栄介)」による支援を受けて行われました。
原論文情報
Masaharu Uno, Yuri Tani, Masanori Nono, Emiko Okabe, Saya Kishimoto, Chika Takahashi, Ryoji Abe, Takuya Kurihara, & Eisuke Nishida, “Neuronal DAF-16-to Intestinal DAF-16 communication underlies organismal lifespan extension in C. elegans”, iScience, 10.1016/j.isci.2021.102706
発表者
理化学研究所
生命機能科学研究センター 老化分子生物学研究チーム
研究員 宇野 雅晴(うの まさはる)
チームリーダー 西田 栄介(にしだ えいすけ)
報道担当
理化学研究所 広報室 報道担当