2021-09-02 理化学研究所,大阪大学
理化学研究所(理研)生命機能科学研究センター染色体分配研究チームの森雅志研究員、北島智也チームリーダー、大阪大学微生物病研究所の伊川正人教授らの共同研究グループは、マウスを用いて、受精卵には精子[1]染色体の細胞内局在を制御し、余分な卵子[1]染色体とともに極体[2]へ放出されるのを防止する機構が存在することを明らかにしました。
本研究成果は、哺乳類の受精に関する基礎的知見を提供するとともに、顕微受精(ICSI)法[3]などの不妊治療技術の向上および効率化に貢献するものと期待できます。
哺乳類の受精では、減数分裂[2]の途中で停止している2倍体[4]の卵子と、減数分裂が完了した1倍体[4]の精子が融合することで、一時的に3倍体[4]の受精卵が生じます。卵子側の余分な染色体は、受精の後に起きる減数分裂の完了により極体に放出されますが、このとき精子の染色体がなぜ一緒に放出されないのか、つまり”捨てられない”のかは不明でした。
今回、共同研究グループは、マウスの受精過程における精子と卵子の染色体の詳細な挙動を解析し、精子染色体は常に卵子染色体から距離を置くように局在が制御されることを明らかにしました。また、精子を人為的に卵子染色体近くに局在させると、精子染色体が受精胚から極体に捨てられてしまうことから、この制御機構が正常な発生に必須であることを見いだしました。
本研究は、科学雑誌『Journal of Cell Biology』オンライン版(8月23日付)に掲載されました。
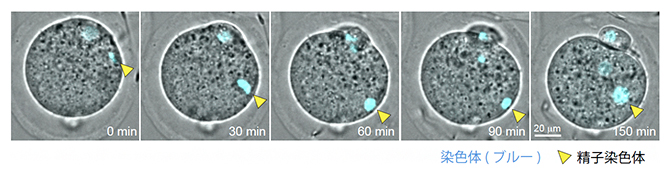
卵子染色体から距離を置くように移動する受精直後の精子染色体(矢頭)
背景
卵子と精子の融合によって生じる受精卵は、母方と父方からゲノム[4]を1セットずつ継承し、計2セットを保持する2倍体です。受精卵が正常に発生するには2倍体を正確に維持することが必須であり、それが破綻すると流産や出生異常につながります。
しかし哺乳類の場合、受精直後の受精卵は一過的にゲノムDNAを3セット保持する3倍体となることが知られています(図1)。これは、精子が減数分裂を完了した1倍体である一方、成熟卵子は減数第二分裂中期で細胞周期を停止した2倍体であり、これらの融合により3倍体となるためです。受精後、卵子の染色体は紡錘体によって分配され、ゲノム1セット分を娘細胞の一方(受精卵側)に継承し、もう1セットを別の娘細胞(極体)へ放出します。この際、精子染色体の1セット分は必ず受精卵側に保持されなければなりません(図1)。
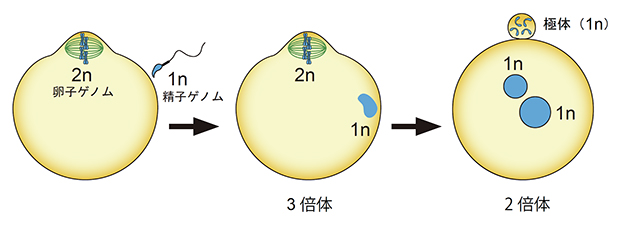
図1 哺乳類の受精と倍数性の変化
哺乳類の受精では、精子ゲノムは1セット(1n)であるが、卵子は減数第二分裂中期で停止し、卵子ゲノムは細胞膜直下で2セット(2n)のまま並んでいる。この状態で受精することによって一過的に3倍体となるが、その後卵子ゲノム1セットのみが極体に放出されて、発生可能な2倍体となる。
これまで哺乳類の受精過程は、主に固定した受精卵を用いて解析されてきました。しかしこの手法では、さまざまな時期の複数の受精卵の様子を比較することはできても、細胞の連続的な変化を正確に捉えることは困難です。そのため、3倍体の受精卵が確実に2倍体へと移行する機構は明らかになっていませんでした。
研究手法と成果
哺乳類の卵子は体内から外界へ放出されることはなく、一般的に光刺激に弱いという性質があります。特に、マウスの精子と卵子の細胞融合は光感受性が高いことから、レーザー光の照射が必要な蛍光マーカーを用いて、受精過程を経時的かつ立体的に解析することが困難でした。
共同研究グループは、検出器側に高感度カメラを用いることで、レーザー出力を抑えたマウス受精過程のライブイメージング法[5]を確立し、卵子および精子染色体の挙動を連続的に解析することに成功しました。この手法を用いて、下記の新しい知見が得られました。
まず、精子と卵子が融合する過程をライブイメージング法で観察したところ、精子は卵子染色体の近くでは受精しないことが分かりました(図2左、中央)。受精は、精子と卵子の細胞膜が接着し、融合することで成立します。精子と卵子の接着には、卵子の細胞膜に存在する2種類の膜タンパク質Juno[6]とCD9[6]が必須であることが分かっています。そこで、Junoタンパク質の局在を観察したところ、卵子の細胞膜上では、強い局在、弱い局在、非局在の三つのパターンを示しました。具体的には、JunoとCD9が集まったドット状の構造体(Juno構造体)が存在するのは、卵子染色体の反対側の半球とその近くに限られ、卵子染色体の近くではJuno構造体は観察されませんでした(図2右)。詳細な解析の結果、卵子染色体の近くでJuno構造体の形成が阻害されることで、精子の融合場所が制御されることが明らかになりました。
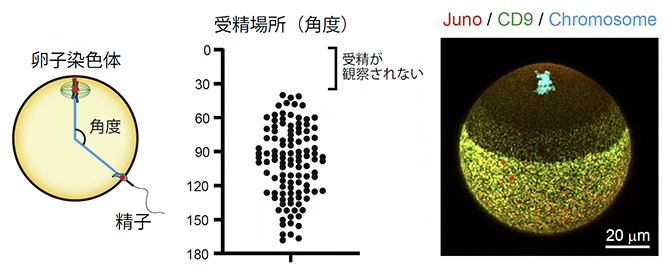
図2 精子の融合場所の制御
左)ライブイメージング法によりマウス卵子染色体の位置と精子の融合領域を観察し、これらの位置関係を卵子中心と卵子染色体を結ぶ直線からの角度として計測した。
中)受精場所の計測データ。点は受精卵を示す。卵子染色体の位置を0度とすると、卵子染色体近くの40度以内で受精した例はなかった。
右)マウス卵子の蛍光顕微鏡観察像。受精に必要な膜タンパク質Juno(赤)とCD9(緑)が形成するドット状の構造体(Juno構造体、黄色)は、卵子染色体の反対側の半球に集中し、卵子染色体側の近くでは形成できない。スケールバーは20マイクロメートル(μm、1μmは1,000分の1mm)。
次に、精子融合後の染色体の挙動を観察しました。その結果、精子染色体は融合した場所から局在を大きく変化させましたが、卵子染色体の近くには移動せず、卵子染色体と精子染色体は近接しないことが分かりました。細胞内の構造物の移動は、細胞骨格の制御を受けることが知られています。そこで、細胞骨格の一種であるアクチン繊維[7]の重合阻害剤で受精卵を処理したところ、卵子および精子染色体が接近し、一塊の染色体グループへと結合することが観察されました。このことから、アクチン構造物[7]が近接の防止に必須であることが明らかになりました。
最後に、ヒトの不妊治療で使用される顕微受精(ICSI)法で人工的に受精させたマウス受精卵において染色体の挙動を観察しました。人為的に精子染色体を卵子染色体の近くに局在させた受精卵を作製したところ、多くの場合で精子染色体が極体へ捨てられてしまうことを見いだしました(図3)。このことから、本研究で見いだした二つの機構による精子染色体の局在制御、すなわち精子の融合場所の制御と精子染色体の細胞内移動の制御が、精子染色体の極体放出防止に必須であることが示されました。
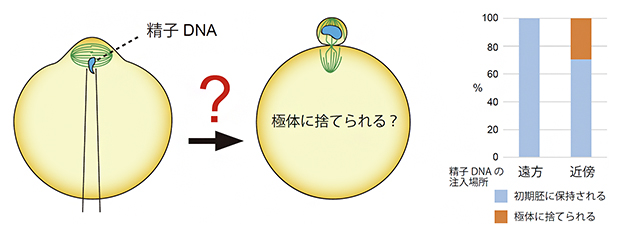
図3 卵子染色体近くに注入された精子染色体の挙動
顕微受精法によりマウス精子を卵子染色体の近くに強制的に注入すると、約30%の受精卵で精子染色体は極体に捨てられた。
今後の期待
本研究から、哺乳類における受精直後の3倍体の受精卵が確実に2倍体へと移行する機構の一端を明らかにすることができました。
今回共同研究グループが確立した受精過程のライブイメージング法は、この分野の研究を推し進めるための有用な研究手法となると期待できます。
一方、精子を強制的に卵子染色体の近くに注入すると、高い確率で極体に”捨てられる”ことが判明しました。このことから、不妊治療で使用される顕微受精法では、精子の注入場所を適切に制御する必要があると推測されます。今後はヒト卵子を用いて同様な研究を行い、精子染色体を確実に卵子染色体から遠方に局在させる手法の開発が必要であると考えられます。
補足説明
1.精子、卵子
受精可能な雌性生殖細胞を卵子と呼ぶ。卵子は減数第二分裂の途中で細胞分裂が停止しており、2セットのゲノムを保持する2倍体である。一方、受精可能な雄性生殖細胞を精子と呼ぶ。精子は既に減数分裂を完了しており、1セットのゲノムを保持する1倍体である。
2.極体、減数分裂
真核生物の生殖器官(精巣や卵巣)にある生殖細胞で見られる、配偶子(精子や卵子)をつくるための特別な様式の細胞分裂を減数分裂と呼ぶ。途中でDNAが複製されることなく、2回の細胞分裂(減数第一分裂、減数第二分裂)が起こる。卵母細胞が減数分裂して成熟した卵子をつくる際、著しい非対称分裂により、卵子にならない小さな娘細胞が生じる。これを極体と呼ぶ。
3.顕微受精(ICSI)法
不妊治療において用いられる体外受精の方法の一つ。ガラス針を用いて精子の頭部を卵子に注入する方法で、精子と卵子の融合過程を省略する手段。ICSI はIntracytoplasmic sperm injectionの略。
4.2倍体、1倍体、3倍体、ゲノム
ゲノムは、生物種ごとに特有の遺伝情報(DNA配列)の総体を指す。ゲノムを2セット保持する細胞を2倍体、1セット保持する細胞を1倍体、3セット保持する細胞を3倍体と呼ぶ。通常の体細胞は父方と母方からゲノムを1セットずつ継承し、計2セットを保持している2倍体である。生殖細胞は減数分裂を経て、最終的には1倍体となる。
5.ライブイメージング法
生きた細胞(卵子や精子)を一定の間隔を空けて撮影し、細胞の変化を経時的に観察する方法。本研究では、蛍光マーカーを用いて染色体を特異的に可視化し、染色体局在の経時的な変化を解析した。
6.Juno、CD9
卵子の細胞膜に存在する、受精に必須な膜タンパク質。Junoは、精子側の膜タンパク質IZUMO1の受容体として働く。CD9は、JunoとIZUMO1の結合を促進すると考えられている。
7.アクチン繊維、アクチン構造物
アクチンタンパク質が多数重合した糸状の重合体をアクチン繊維と呼び、主要な細胞骨格成分の一つである。アクチン繊維が結合タンパク質と相互作用して組織化したものをアクチン構造体と呼ぶ。
共同研究グループ
理化学研究所 生命機能科学研究センター
染色体分配研究チーム
研究員 森 雅志(もり まさし)
チームリーダー 北島 智也(きたじま ともや)
基礎科学特別研究員 三品 達平(みしな たっぺい)
超微形態研究チーム
チームリーダー 米村 重信(よねむら しげのぶ)
テクニカルスタッフ(研究当時) 遠藤 広美(えんどう ひろみ)
大阪大学 微生物病研究所 遺伝情報実験センター 遺伝子機能解析分野
教授 伊川 正人(いかわ まさひと)
近畿大学 生物理工学部
教授 山縣 一夫(やまがた かずお)
大学生 米澤 直央(よねざわ なお)
扶桑薬品工業株式会社 研究開発センター
上席研究員 八尾 竜馬(やお たつま)
国立遺伝学研究所 物理細胞生物学研究室
准教授 島本 勇太(しまもと ゆうた)
博士研究員 田中 真仁(たなか まさひと)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究)で実施し、日本学術振興会(JSPS)科学研究費補助金若手研究(A)「哺乳類の受精における2倍体維持機構(研究代表者:森雅志)」新学術領域研究(研究領域提案型)「受精卵全能性を統御する遺伝子群の単離と機能解析(研究代表者:伊川正人)」、および内藤記念科学振興財団研究助成「受精過程における精子染色体の極体放出抑制機構(研究代表者:森雅志)」などによる助成を受けて行われました。
原論文情報
Masashi Mori*, Tatsuma Yao, Tappei Mishina, Hiromi Endoh, Masahito Tanaka, Nao Yonezawa, Yuta Shimamoto, Shigenobu Yonemura, Kazuo Yamagata, Tomoya S. Kitajima, Masahito Ikawa*, “RanGTP and the actin cytoskeleton keep paternal and maternal chromosomes apart during fertilization”, Journal of Cell Biology, 10.1083/jcb.202012001
*責任著者
発表者
理化学研究所
生命機能科学研究センター 染色体分配研究チーム
研究員 森 雅志(もり まさし)
チームリーダー 北島 智也(きたじま ともや)
大阪大学 微生物病研究所
教授 伊川 正人(いかわ まさひと)
大阪大学微生物病研究所に関する問い合わせ
大阪大学微生物病研究所 企画広報推進室
中込 咲綾(なかごみ さや)
報道担当
理化学研究所 広報室 報道担当


