2021-09-09 京都大学,千葉大学,高輝度光科学研究センター,日本医療研究開発機構
概要
岩田想 京都大学大学院医学研究科教授、野村紀通 同准教授、小笠原諭 千葉大学グローバルプロミネント研究基幹 特任准教授(元 京都大学医学研究科研究員)は、Konstantinos Beis 英国・インペリアルカレッジロンドン グループリーダー、稲葉理美 同日本学術振興会海外特別研究員(高輝度光科学研究センター研究員兼任)、Jonathan Heddle ポーランド・ヤギェウォ大学 教授らと共同で、細菌の膜輸送体タンパク質SbmAの精密立体構造を解明しました。
自然界の生存競争において、ある種の細菌は多種多様な化学構造をもつ抗菌ペプチド類を分泌し、その作用によって競争相手である近縁種の細菌の増殖を抑えて生存競争を有利にする戦略をとっています。SbmAは、近縁種細菌の細胞内に抗菌ペプチド分子が入っていく際に「取り込み口」として働く膜タンパク質です。
本研究では、SbmAが多種多様な抗菌ペプチドを細胞内に輸送するメカニズムを分子レベルで理解するために、SbmAの精密立体構造を可視化しました。今回得られた立体構造情報は「どのような化学構造をもった化合物ならばSbmAによって細菌細胞内に有効に取り込まれるか」という問題を考える重要な手がかりになります。この知見を応用して、病原細菌の増殖抑制に効果がある新しい抗菌ペプチドの研究開発が進むものと期待されます。
本成果は、2021年9月9日(日本時間)に米国の国際学術誌「Science Advances」にオンライン掲載されました。
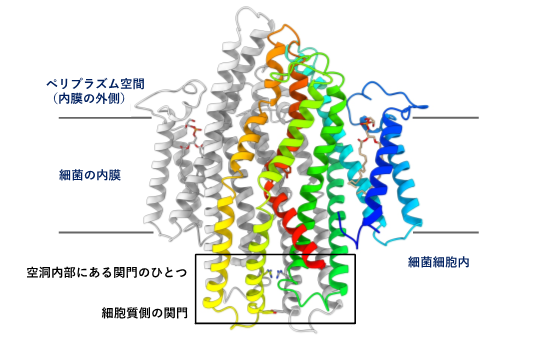
図 本研究の概要(SbmAの立体構造)
背景
自然界における細菌群集のなかでは、栄養分をめぐって互いに生存競争が繰り広げられています。この競争を有利に進めるために、ある種の細菌は競争相手である近縁種細菌の増殖を抑える作用のある抗菌ペプチド注1)を「飛び道具」として分泌します。多くの場合、「飛び道具」の作用標的は競争相手の細菌の増殖を維持するのに重要な細胞内タンパク質(酵素など)であるため、これらが攻撃効果を発揮するためには近縁細菌の細胞膜を介して細胞内に取り込まれる必要があります。抗菌ペプチドは多種多様な分子の大きさや化学構造をもった化合物群ですが、これらが近縁細菌の細胞内に取り込まれる際には、膜輸送体タンパク質(トランスポーター)SbmAの働きが重要であることがわかっています。「どのようなメカニズムによってSbmAが多種多様な抗菌ペプチドを細胞内に輸送するのか」という疑問に答えるために、SbmAの精密な立体構造を解明し、その情報に基づいてメカニズムを分子レベルで検証する必要がありました。
研究手法・成果
タンパク質など生体高分子の立体構造を研究する手法として、近年、クライオ電子顕微鏡単粒子解析法注2)(以下、クライオ電顕法という)がめざましい発展を遂げています。膜タンパク質の立体構造をクライオ電顕法で解明する際には電子顕微鏡画像データの解析が技術的に難しい面がありますが、抗体フラグメント注3)を膜タンパク質に結合させた複合体粒子の画像を撮影し、抗体が結合している部分を目印にして位置合わせを行うという画像解析処理の工夫(図1)が功を奏し、3.2 Å分解能での精密立体構造を決定できました(図2)。
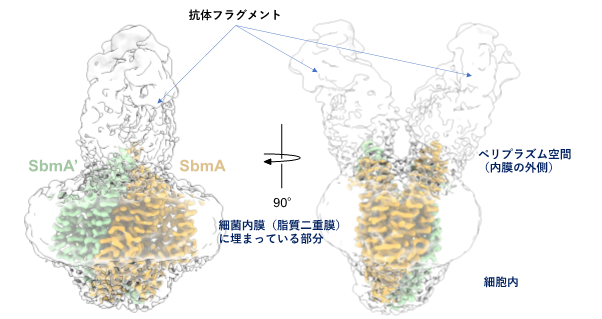
図1 抗体フラグメントを用いたSbmAのクライオ電子顕微鏡単粒子解析SbmA分子はその大部分が細菌内膜に埋まった状態で存在する。精製したSbmA分子の画像をクライオ電子顕微鏡で撮影し、多数の二次元画像におけるSbmA分子の位置や向きを揃えて平均化する解析処理が必要であるが、膜から外にとび出した部分が小さいとこの計算処理が難しい。SbmAに特異的に結合する抗体を作製し、その一部分(抗体フラグメント)をSbmAに結合させた「人工的な」複合体を使えば、図のように「ウサギの耳」のような特徴的な形をもった粒子画像が撮影できるため、構造解析の正確性や成功率が飛躍的に向上する。図中では同じサブユニットが2つ組み合わさってホモ二量体が形成されていることを示すために、一方のサブユニットに「SbmA」、他方に「SbmA´」というラベルを付した。
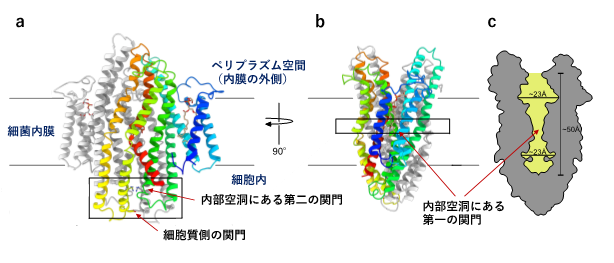
図2 SbmAの立体構造
- 脂質二重膜と平行な視線から見たSbmA。同じサブユニットが二つ組み合わさって会合して、膜輸送体としての機能を発揮する。わかりやすいように一つのサブユニットにのみ彩色を施した。彩色された螺旋状のものはSbmAを構成する膜貫通ヘリックスである。
- aで見たSbmA分子を脂質二重膜と垂直な軸周りに90°回転して観察した様子。
- bと同じ方向から見たSbmA分子の断面図。内部空洞の抗菌ペプチド輸送経路には幅が狭くなっているところが二箇所ある。化合物の構造を選別して通過させる「関門」と考えられる。図中では「内部空洞にある第一の関門」、「内部空洞にある第二の関門」と表記した。
SbmAは同じサブユニットが二つ会合して働くホモ二量体ですが、立体構造をみると二つのサブユニットが組み合わさった内側に大きな空洞が形成されており、これが抗菌ペプチドを細胞内へと誘う輸送経路であることがわかりました。空洞の体積は、さまざまな化学構造をもった抗菌ペプチドを収容するのに十分なだけの大きさがありました。今回明らかにした立体構造では、この空洞は細胞膜の外側に向かって大きく口を開いた状態であり、細胞外側から抗菌ペプチドがこの空洞に進入してくるのを待ち受けている状態だと考えられました。空洞の内部には、抗菌ペプチドの輸送経路で幅が狭くなっている部分が二箇所あり、化合物の構造を選別して通過させる「関門」ではないかと考えられました。また細胞質側の端部分にもさらに一つ「関門」があり、それは閉じている状態でした。立体構造上の特徴から、SbmAは細胞膜(正確にはグラム陰性細菌の内膜)の両側に形成されるプロトン濃度勾配をエネルギー源として使って構造変化を起こし、抗菌ペプチドを細菌細胞内へ取り込ませる(輸送する)タイプの膜輸送体(トランスポーター)であることがわかりました。内部空洞の表面に分布しているアミノ酸残基(グルタミン酸が「はしご状」に位置しているGlu ladder等)がどのような役割をしているか生化学実験により検証して、SbmAが抗菌ペプチドを細胞内に取り込む分子メカニズムを解明しました。
これまで数多くの膜輸送体の立体構造がすでに解明されてきていますが、SbmAの立体構造の特徴は非常にユニークであり、既存の膜輸送体の構造分類のどれにもぴったりとは当てはまらなかったため、「SbmA-like peptide transporters (SLiPT)」と名づけた新しい構造分類を提唱しました。
波及効果、今後の予定
今回得られた立体構造情報は「どのような化学構造をもった化合物ならばSbmAによって細菌細胞内に有効に取り込まれるか」という問題を考える重要な手がかりになります。この知見を応用して、病原細菌の増殖抑制に対して有効性を示す新しい抗菌ペプチドの研究開発が進むものと期待されます。
研究プロジェクトについて
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の創薬等ライフサイエンス研究支援基盤事業(BINDS) JP21am0101079、日本学術振興会海外特別研究員制度の科研費(稲葉)の支援を受けています。
論文タイトルと著者
- タイトル
- Molecular mechanism of SbmA, a promiscuous transporter exploited by antimicrobial peptides
(抗菌ペプチドの細菌細胞内取り込みに関与する膜輸送体SbmAの立体構造の解明) - 著者
- Dmitry Ghilarov*, Satomi Inaba-Inoue*, Piotr Stepien*, Feng Qu, ElizabethMichalczyk, Zuzanna Pakosz, Norimichi Nomura, Satoshi Ogasawara, Graham Walker, Sylvie Rebuffat, So Iwata, Jonathan Gardiner Heddle, Konstantinos Beis(*共同筆頭著者)
- 掲載誌
- Science Advances
用語解説
- 注1)抗菌ペプチド
- 抗生物質の一種で、アミノ酸が約十~数十個連なった構造を分子骨格の一部にもつ。ヒトを含めた哺乳類や植物、昆虫から原核生物まであらゆる生物種が産生・分泌する。抗菌ペプチドの代表例を下の図に示す。化学構造や分子のサイズは多種多様であり、作用機序も細胞膜の破壊、DNA・RNA・タンパク質の合成阻害、細胞内の特定の酵素活性の阻害などさまざまである。
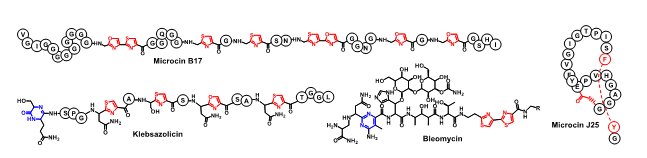
細菌が分泌する抗菌ペプチドの代表例 - 注2)クライオ電子顕微鏡単粒子解析法
- クライオ電子顕微鏡とは、液体窒素温度(-196℃)に冷却した状態で生体試料に対して電子線を照射し、極低温チャンバー内のコールドステージで画像化することができる電子顕微鏡の一種である。電子線による試料損傷を受けやすい生体高分子や細胞を観察するため、生体試料を水溶液中で水和した状態のままで急速凍結・固定し、非晶質の氷に観察対象を包埋した状態を維持しながら観察・画像データ収集を行うことができる。電子を直接検出することができるカメラ(直接電子検出器;2010年台半ばに開発された)をクライオ透過型電子顕微鏡(cryo-TEM)に搭載することによって、従来に比べて分解能が大幅に向上し、生体内のさまざまなタンパク質、核酸、その他の生体分子およびそれらの複合体についても精密立体構造解析が可能となった。
単粒子解析法においては、まずクライオ電子顕微鏡を用いてタンパク質分子など生体高分子の写真(2次元投影像)を数百~数千枚撮影する。次に、取得した画像データのなかから鮮明に写っている分子像だけを抽出して、分子の方位や位置を合わせながら画像分類を行い、同じ分類群に属すると判断されるものについてはそれらの平均化を行って、2次元平均像を計算機上で作る。最終的にいろいろな方角から撮影した分子の2次元平均像から3次元の立体構造を再構築する。2次元での平均化2次元の立体構造再構築での平均化の計算処理を経るので、観察対象の生体高分子の分解能を向上させることが可能である。
これまで生体高分子の構造解析手法の主流として用いられてきたX線結晶構造解析では、まず研究対象の生体高分子を結晶化する必要があり、結晶化が困難なものは立体構造決定ができないという制限があった。それに対し、クライオ電子顕微鏡単粒子解析法は生体高分子を精製した溶液試料を用いるので、その欠点を補うことができる。現在は、X線結晶構造解析法とクライオ電子顕微鏡単粒子解析法はともに生体高分子の立体構造解析手法として相補的に用いられている。 - 注3)抗体フラグメント
- ヒト体内の血液、組織液に存在する最も一般的な抗体の種類である免疫グロブリンG(IgG)分子は、タンパク質分解酵素パパインによる処理でFabフラグメント(断片)2つとFcフラグメント1つに切断して分離することができる。こうして得られるFabフラグメントは抗体フラグメントの一種であり、IgGとその抗原が結合するのに必要な可変領域を含んでいる。ちなみに可変領域の最小単位はFvと呼ばれ、このFvフラグメントは遺伝子工学を用いて作り出すことができる(FvフラグメントはFabフラグメントの一部分である)。本研究で用いたのはSbmAに特異的に結合する抗体のFabフラグメントである。
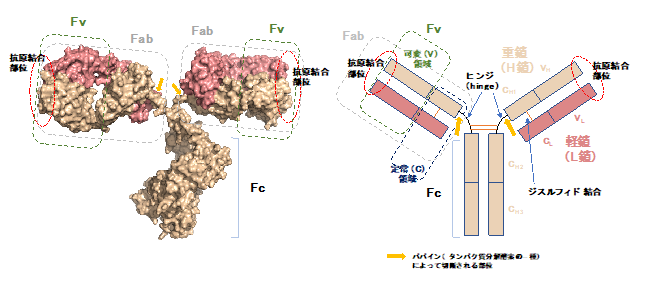
抗体分子(IgG)の構造
お問い合わせ先
岩田 想(いわた そう)
都大学医学研究科・教授
報道・取材に関するお問い合わせ先
京都大学 総務部広報課国際広報室
千葉大学 企画総務部渉外企画課広報室
高輝度光科学研究センター 利用推進部普及情報課
AMED事業に関する問い合わせ先
日本医療研究開発機構(AMED) 創薬事業部 医薬品研究開発課
創薬等ライフサイエンス研究支援基盤事業(BINDS)