2021-11-30 京都大学
概要
現在血液透析患者数は年々増加し、その医療費は1.6兆円を超え医療的にも社会的にも大きな問題になっています。透析導入に至る患者さんの平均年齢は67歳と高齢であり、今後さらなる高齢社会を迎える我が国にとって対策が急務となっております。高齢者の腎臓病は若年者と比べて治りにくく、その原因は不明でした。以前我々は高齢個体では障害後慢性期に「三次リンパ組織 と呼ばれる異所性のリンパ組織が誘導され、これが炎症を持続させることが正常な組織修復を遮る可能性を示しておりました(図1)。しかしながらこの三次リンパ組織形成を促進する細胞や分子はわかっておりませんでした。
今回柳田素子教授(京都大学大学院医学研究科 腎臓内科学講座、京都大学高等研究院 ヒト生物学高等研究拠点(WPI-ASHBi)主任研究者)、佐藤有紀特定助教(同講座・京都大学大学院医学研究科MIC/TMKプロジェクト(現在米国Mayo Clinic留学中))らの研究グループは、加齢に伴い増加する老化関連T細胞(SAT細胞)注1と老化関連B細胞(ABCs)注2という2種類のリンパ球が腎臓の三次リンパ組織内部で相互作用し、その形成を促進することを発見しました。さらに、その相互作用分子としてCD153-CD30経路を同定し、この経路を遮断することで三次リンパ組織が誘導されなくなり、腎臓の組織修復が促進され予後が改善することも明らかにしました。さらにこれらの細胞および分子はヒトの同様の病態でも確認されました。以上よりこのユニークな免疫細胞およびCD153-CD30経路を標的とした治療法は高齢者の腎臓病の回復を促し、透析導入を遅延させる可能性があります。
同研究グループは三次リンパ組織が移植や他の腎臓病でも誘導され、それらが組織障害マーカーとなることも最近明らかにしており、今回の知見と併せることで腎臓病の早期診断や予後予測に有用なバイオマーカー開発にも重要な手掛かりとなる知見と言えます。
本成果は、2021年11月23日に米国の国際学術誌「Journal of Clinical Investigation」にオンラインで掲載されました。
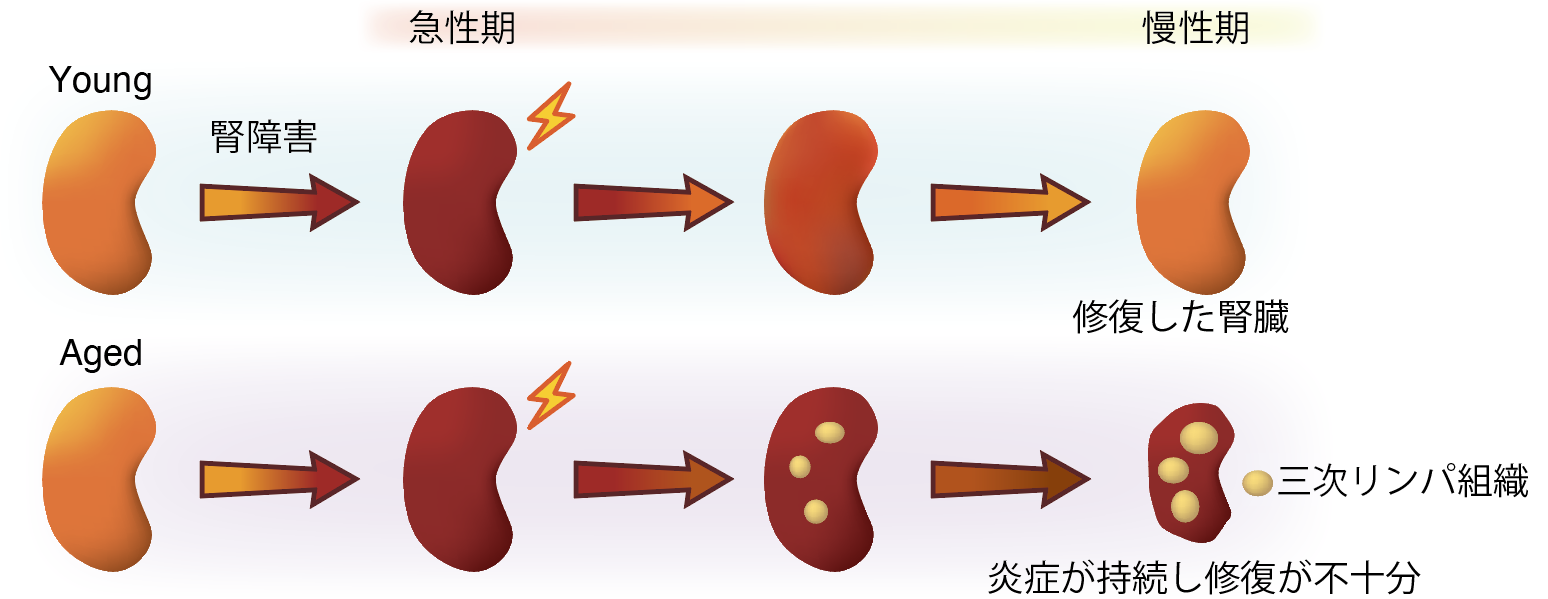
図1:高齢個体では障害後三次リンパ組織が誘導され炎症を遷延させる
1.背景
現在血液透析患者数は年々増加し、医療的にも社会的にも大きな問題になっています。高齢者の腎臓病は若年者と比べて治りにくいことが分かっていますが、そのメカニズムは不明な点が多く、予後を改善させる薬剤も同定されておりません。本研究グループはこの原因解明に取り組み、高齢マウスおよび高齢者の腎臓病では腎臓内に「三次リンパ組織(Tertiary Lymphoid Tissue: 以下TLT)と呼ばれるリンパ節と類似した組織が誘導され、この組織が炎症を遷延させることが腎臓の組織修復が遅延させることを以前に見出しておりました(Sato et al. JCI insight 2016)。しかしながらこのTLTの形成に関与する細胞群や分子は不明であり、これらを標的とした治療薬の開発は困難でした。
2.研究方法・成果
今回本研究グループは、高齢個体において高率にTLTが誘導されることから、加齢に伴い誘導される老化関連T細胞(SAT細胞:Senescence-associated T cells)および老化関連B細胞(ABCs: Age-associated B cells)がTLT形成に寄与するという仮説を立て、障害後徐々にSAT細胞およびABCsが高齢マウスの腎臓に蓄積すること、そしてそれらがTLT内部に限局して蓄積することを見出しました。次にTLTを誘導した腎臓の免疫細胞のシングルセル解析を行い、SAT細胞およびABCsを含めた免疫細胞の多様性を明らかにするとともにそれらの細胞群の遺伝子発現プロファイルを明らかにし、SAT細胞がABCsを活性化するのに必要な遺伝子群を高発現していることも見出しました。これに加えてSAT細胞とABCsは腎障害後時空間的に連動して腎臓に蓄積することから、両者の相互作用がTLT形成に重要な役割を果たしていると考え、両細胞間でのレセプターリガンド解析を行い、SAT細胞とABCsを繋ぐ新規シグナル分子としてCD153-CD30経路を同定しました。さらにこれらの分子が高齢マウス障害腎臓ではそれぞれ主にSAT細胞とABCsに限局して発現していることも見出しました。
次にCD153-CD30シグナル経路のTLT形成における機能を検討する目的で高齢CD153欠損マウスおよび高齢CD30欠損マウスに腎障害を誘導したところ、両マウスともにSAT細胞およびABCsが野生型マウスと比較して有意に減少しTLT形成が損なわれ、それとともに炎症・線維化そして腎機能の改善が認められました。さらにCD153-CD30経路のSAT細胞およびABCsへの直接的な影響を検討する目的で、CD153欠損マウスおよびCD30欠損マウスの障害腎臓からSAT細胞およびABCsを単離し野生型マウスのそれと遺伝子発現を比較検討しました。CD153およびCD30欠損マウスにおけるABCsを特徴づける遺伝子発現は野生型と比較して有意な差が認められなかったのに対して、CD30欠損マウスのSAT細胞はABCsを誘導するのに必要なIL21やIL10などB細胞の活性化に関わる遺伝子発現が著明に低下していました。これらの結果からCD153-CD30経路はSAT細胞がABCを含めたB細胞を活性化する機能を獲得するのに必須なシグナル経路である一方で、ABCsの基本的な性質への寄与は小さく、CD153欠損マウスおよびCD30欠損マウスの障害腎臓におけるABCsの減少は、両マウスにおけるABC誘導に必須なSAT細胞の喪失による二次的な影響と考えられました。
最後にヒトでの解析を行い、ヒト腎臓においてもTLT内部にCD153を発現する細胞が存在することを見出しました。近年幅広いヒト自己免疫疾患において、炎症が起きている臓器においてB細胞を活性化させ病気の進行を促すCD4 T細胞としてT peripheral helper cells (Tph cells)およびIL10産生T細胞(Th10 cells)という2種類の細胞が同定されております。今回研究グループは高齢マウス障害腎臓のシングルセル解析から、SAT細胞はこのTph cellsに類似したTph-like cellとTh10 cellという2種類の細胞に分類されることを新たに見出しました。この知見に基づき研究グループはヒト自己免疫疾患の公共データベースを用いた解析を行い、ヒト関節リウマチの障害滑膜におけるTphおよびABCにおいてもCD153-CD30がそれぞれ発現していることを見出しました。
以上より、研究グループは腎臓におけるTLTは、加齢に伴い誘導されるSAT細胞とABCsという2つのユニークなリンパ球の相互作用により誘導される組織であること、そしてこれらの細胞がCD153-CD30シグナルを介して相互作用することがTLTの成熟に必須であることを明らかにしました(図2)。本知見は高齢者腎臓病の新規治療薬開発を大きく促進するものであり、今後の創薬への応用が期待されます。
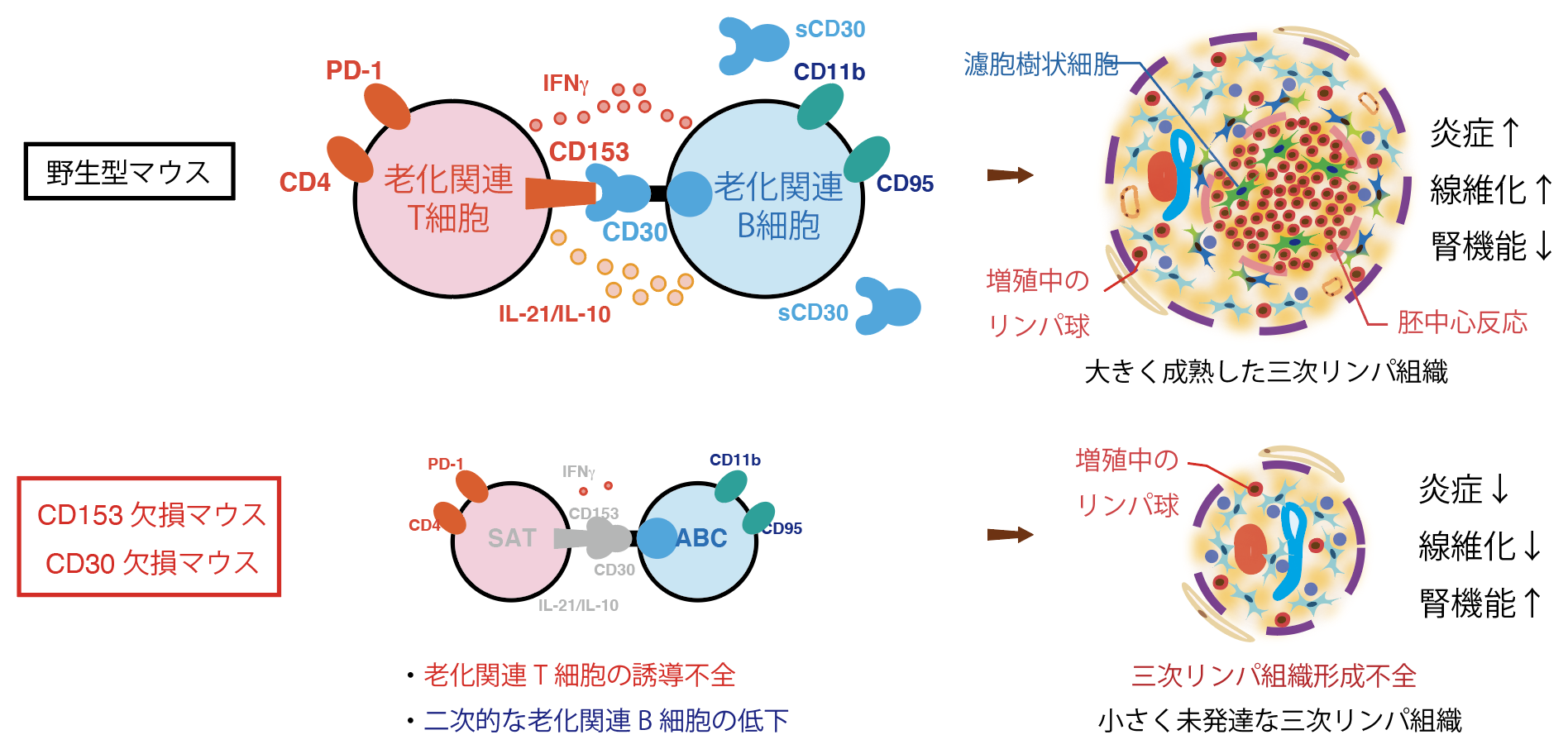
図2:老化関連T細胞と老化関連B細胞の相互作用が三次リンパ組織の成熟を促進する
3.波及効果、今後の予定
SAT細胞およびABCsは高齢個体のみならず、免疫老化が加速している自己免疫疾患や移植の拒絶病変、肥満など幅広い疾患で認められることから、今回の知見が幅広い疾患の治療法開発に貢献することが期待できます。また同研究グループはTLTが腎臓の新規障害マーカーとなりえる可能性も最近報告しており、今回の知見が疾患の早期診断や予後予測などに有用なバイオマーカーの開発を促進することも期待されます。
4.研究プロジェクトについて
本研究は、下記プロジェクトの支援を受けています。
- 国立研究開発法人日本医療研究開発機構(AMED) 革新的先端研究開発支援事業(AMED-CREST)「生体組織の適応・修復機構の時空間的解析による生命現象の理解と医療技術シーズの創出」研究開発領域における研究開発課題「腎臓病において組織障害と修復を制御する微小環境の解明と医学応用」(研究開発代表者:柳田 素子)
- AMED 「老化メカニズムの解明・制御プロジェクト」個体・臓器老化研究拠点「腎臓内微小環境の加齢性変容の分子的定義付けと可視化にもとづく老化制御メカニズムの解明」(研究開発分担者:柳田 素子)
- AMED ムーンショット型研究開発事業「炎症誘発細胞除去による100歳を目指した健康寿命延伸医療の実現 (研究開発分担者:柳田 素子)
- AMED「橋渡し研究戦略的推進プログラム」シーズA 2017年(研究開発代表者:佐藤 有紀)、2020年(研究開発代表者:柳田 素子),科研費 若手研究(B)(研究開発代表者:佐藤有紀)
用語解説
注1 老化関連T細胞(SAT細胞):加齢に伴い誘導されるメモリーCD4 T細胞。炎症を促す液性因子を分泌し部分的に細胞老化形質を有する。自己免疫疾患モデルや肥満マウスなどでも認められる。
注2 老化関連B細胞(ABCs):加齢に伴い誘導されるB細胞。細胞表面にCD11bおよびCD95を発現する。自己免疫疾患モデルや肥満マウスなどでも認められる。
先行研究
- Yuki Sato, Akiko Mii, Yoko Hamazaki, Harumi Fujita, Hirosuke Nakata, Kyoko Masuda, Shingo Nishiyama, Shinsuke Shibuya, Hironori Haga, Osamu Ogawa, Akira Shimizu, Shuh Narumiya, Tsuneyasu Kaisho, Makoto Arita, Masashi Yanagisawa, Masayuki Miyasaka, Kumar Sharma, Nagahiro Minato, Hiroshi Kawamoto and Motoko Yanagita. (2016). “Heterogeneous fibroblasts underlie age-dependent tertiary lymphoid tissues in the kidney”, JCI Insight, 1(11): e87680, DOI: http://dx.doi.org/10.1172/jci.insight.87680
(京都大学ウェブサイト:https://www.kyoto-u.ac.jp/ja/research-news/2016-07-22-0) - Yuki Sato, Peter Boor, Shingo Fukuma, Barbara M. Klinkhammer, Hironori Haga, Osamu Ogawa, Jürgen Floege and Motoko Yanagita. (2020) “Developmental stages of tertiary lymphoid tissue reflect local injury and inflammation in murine and human kidneys”, Kidney International, DOI: https://doi.org/10.1016/j.kint.2020.02.023
(京都大学ウェブサイト:https://ashbi.kyoto-u.ac.jp/ja/news/200528_research-result_yanagita/) - Yu Ho Lee, Yuki Sato, Mitsuru Saito, Shingo Fukuma, Masaya Saito, Shigenori Yamamoto, Atsushi Komatsuda, Nobuhiro Fujiyama, Shigeru Satoh, Sang-Ho Lee, Peter Boor, Tomonori Habuchi, Jürgen Floege, and Motoko Yanagita. (2021) “Advanced tertiary lymphoid tissues in protocol biopsies are associated with progressive graft dysfunction in kidney transplant recipients” J Am Soc Nephrol. DOI: https://doi.org/10.1681/ASN.2021050715 Online ahead of print.
(京都大学ウェブサイト:https://ashbi.kyoto-u.ac.jp/ja/news/20211102_research-result_yanagita/)
研究者のコメント・佐藤有紀(特定助教)
高齢個体において障害後腎臓に異所性のリンパ組織が誘導されるという現象に着目し研究を進める中で、腎臓病の新規治療標的となるシグナル経路を同定することができました。三次リンパ組織が関与するヒトの病態を中心に、今回の知見を元にした新規治療戦略の確立と医薬品の開発を目指して引き続き研究を継続していきたいと思います。
論文書誌情報
タイトル
CD153-CD30 signaling promotes age-dependent tertiary lymphoid tissue expansion and kidney injury(CD153-CD30経路は加齢による三次リンパ組織形成と腎障害を促進する)
著者
Yuki Sato*, Akiko Oguchi, Yuji Fukushima, Kyoko Masuda, Naoya Toriu, Keisuke Taniguchi, Takahisa Yoshikawa, Xiaotong Cui, Makiko Kondo, Takeshi Hosoi, Shota Komidori, Yoko Shimizu, Harumi Fujita, Li Jiang, Yingyi Kong, Takashi Yamanashi, Jun Seita, Takuya Yamamoto, Shinya Toyokuni, Yoko Hamazaki, Masakazu Hattori, Yasunobu Yoshikai, Peter Boor, Jürgen Floege, Hiroshi Kawamoto, Yasuhiro Murakawa, Nagahiro Minato and Motoko Yanagita*
(*Corresponding author)
掲載誌
Journal of Clinical Investigation
DOI
未定