アルツハイマー病などの治療法開発に役立つ可能性がある Could aid efforts to find treatments for Alzheimer’s, other diseases
2022-08-24 ワシントン大学セントルイス
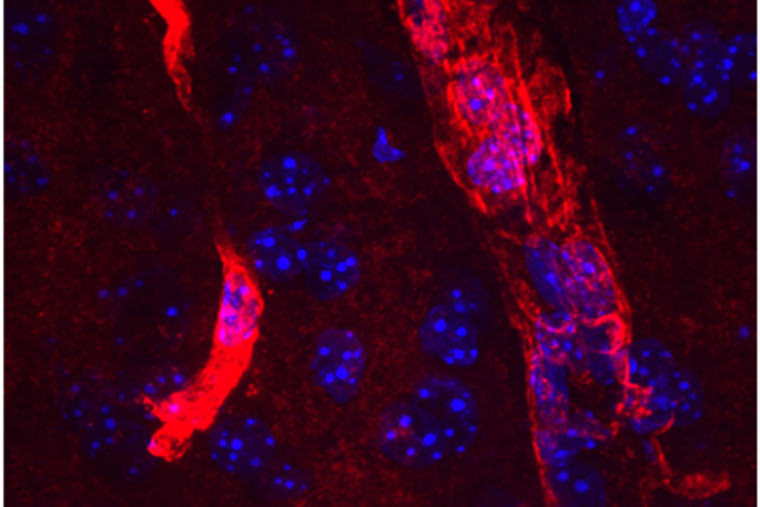
An extended form of the protein aquaporin 4 (red) lines the edges of tiny blood vessels in the brain. Cell nuclei are visible in blue. Researchers at Washington University School of Medicine in St. Louis have found a new druggable pathway that enhances the amount of long aquaporin 4 near blood vessels and increases the clearance of waste from the brain. The findings potentially could lead to new therapies to prevent Alzheimer’s dementia. (Image: Darshan Sapkota/School of Medicine)
研究者らは、リードスルーと呼ばれる遺伝的な特徴を高めることによって、マウスの脳から老廃物を除去する方法を発見した。
この方法は、パーキンソン病など、有毒なタンパク質が蓄積することを特徴とする他の神経変性疾患にも有効である可能性がある。
アクアポリン4の長い形態が、脳内で通常の形態と異なる挙動を示すかどうかを確認するためのツールを作成した。その結果、アストロサイトのエンドフィードと呼ばれる部位に、アクアポリン4の長鎖型が見つかり、短鎖型は見つからなかった。アストロサイトは一種の支持細胞で、脳と体の他の部分の間のバリアーを維持するのに役立っている。アストロサイトの端部は、脳内の細い血管に巻き付き、血流を調節している。アストロサイトの末端は、脳から血液に老廃物を流し、不要なタンパク質を排除するのに最適な場所なのである。
研究者らは、遺伝子操作によって脳内に高濃度のアミロイドを持つようにしたマウスを研究した。このマウスを、アピゲニン、スルファキノキサリン、不活性液体、またはリードスルーに影響を及ぼさないプラセボ化合物で処理した。アピゲニンかスルファキノキサリンを投与したマウスは、不活性な2つの物質のいずれかを投与したマウスよりも、アミロイドβを著しく速く消去した。
<関連情報>
- https://source.wustl.edu/2022/08/study-points-to-new-approach-to-clearing-toxic-waste-from-brain/
- https://academic.oup.com/brain/advance-article-abstract/doi/10.1093/brain/awac199/6671408
Aqp4のストップコドンリードスルーは脳からのアミロイドβのクリアランスを促進する Aqp4 stop codon readthrough facilitates amyloid-β clearance from the brain
Darshan Sapkota, Colin Florian, Brookelyn M Doherty, Kelli M White, Kate M Reardon, Xia Ge, Joel R Garbow, Carla M Yuede, John R Cirrito, Joseph D Dougherty
Brain Published:24 August 2022
DOI:https://doi.org/10.1093/brain/awac199
Abstract
Alzheimer’s disease is initiated by the toxic aggregation of amyloid-β. Immunotherapeutics aimed at reducing amyloid beta are in clinical trials but with very limited success to date. Identification of orthogonal approaches for clearing amyloid beta may complement these approaches for treating Alzheimer’s disease. In the brain, the astrocytic water channel Aquaporin 4 is involved in clearance of amyloid beta, and the fraction of Aquaporin 4 found perivascularly is decreased in Alzheimer’s disease. Further, an unusual stop codon readthrough event generates a conserved C-terminally elongated variant of Aquaporin 4 (AQP4X), which is exclusively perivascular. However, it is unclear whether the AQP4X variant specifically mediates amyloid beta clearance.
Here, using Aquaporin 4 readthrough-specific knockout mice that still express normal Aquaporin 4, we determine that this isoform indeed mediates amyloid beta clearance. Further, with high-throughput screening and counterscreening, we identify small molecule compounds that enhance readthrough of the Aquaporin 4 sequence and validate a subset on endogenous astrocyte Aquaporin 4. Finally, we demonstrate these compounds enhance brain amyloid-β clearance in vivo, which depends on AQP4X.
This suggests derivatives of these compounds may provide a viable pharmaceutical approach to enhance clearance of amyloid beta and potentially other aggregating proteins in neurodegenerative disease.