2023-01-13 韓国基礎科学研究院(IBS)
体内に吸収された薬物は、肝臓などいくつかの臓器で酵素によって代謝され、その結果除去されます。薬物のクリアランスレートは、体内の酵素のレベルを増加させる他の薬物によって増加させることができます。このため、薬物の濃度が劇的に低下し、薬効が低下し、しばしば薬物投与ができなくなることがあります。したがって、薬物-薬物相互作用がある場合のクリアランスレートを正確に予測することは、新薬開発・処方において非常に重要です。
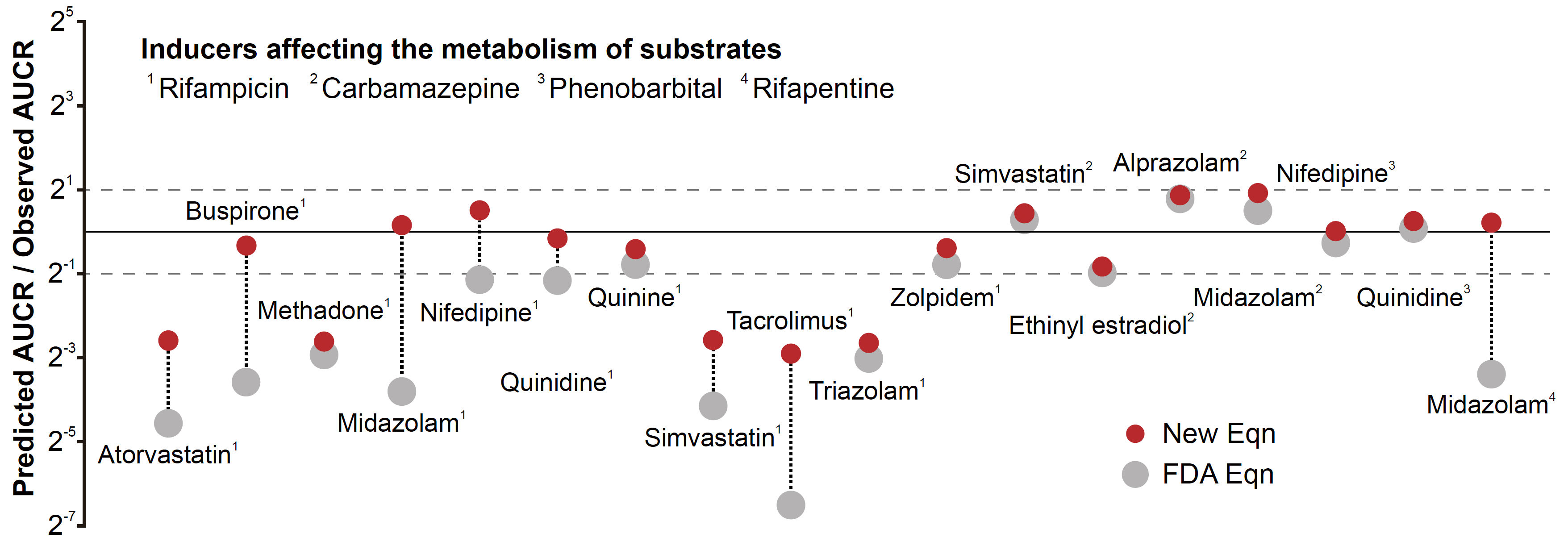
薬物-薬物相互作用を間接的に評価するために、薬学者は110年の歴史を持つミカエリス-メンテン(MM)モデル(酵素の反応速度を記述したもの)に頼ってきた。MM式は生化学の分野で最も広く知られている式の一つであるが、基本的な限界がある。すなわち、MM式が正確なのは、薬物を代謝する酵素の濃度がそのMM定数(Km)よりはるかに低い場合だけである。さらに、薬物-薬物相互作用によって酵素濃度が上昇した場合、MM式の精度は極めて低くなると予想される。
注目すべきは、食品医薬品局が2020年に発表したFDAガイダンスで、このモデルに基づいた薬物クリアランスの変化を予測する式が掲載されていることです。しかし、この式の精度は非常に満足のいくものではなく、予測値のうち2倍以下の誤差はわずか38%にとどまっています。この問題を解決するため、科学的に妥当でない人工的な定数を式に組み込むことで、予測精度の向上を目指している。
基礎科学研究所(IBS)および韓国科学技術院(KAIST)内のバイオメディカル数学グループの数学者と忠南大学の薬学研究者からなる共同研究チームは、FDAが推奨する式の不正確さの主な原因を特定し、解決策を提示したと報告しています。
<関連情報>
- https://www.ibs.re.kr/cop/bbs/BBSMSTR_000000000738/selectBoardArticle.do?nttId=22433&pageIndex=1&searchCnd=&searchWrd=
- https://ascpt.onlinelibrary.wiley.com/doi/full/10.1002/cpt.2824
ミカエリス-メンテンを超えて:シトクロムP450 3A4誘導による薬物相互作用の正確な予測 Beyond the Michaelis-Menten: Accurate Prediction of Drug Interactions through Cytochrome P450 3A4 Induction
Ngoc-Anh Thi Vu, Yun Min Song, Quyen Thi Tran, Hwi-yeol Yun, Sang Kyum Kim, Jung-woo Chae, Jae Kyoung Kim
Clinical Pharmacology & Therapeutics Published: 15 December 2022
DOI:https://doi.org/10.1002/cpt.2824
Abstract
The US Food and Drug Administration (FDA) guidance has recommended several model-based predictions to determine potential drug–drug interactions (DDIs) mediated by cytochrome P450 (CYP) induction. In particular, the ratio of substrate area under the plasma concentration-time curve (AUCR) under and not under the effect of inducers is predicted by the Michaelis–Menten (MM) model, where the MM constant (Km) of a drug is implicitly assumed to be sufficiently higher than the concentration of CYP enzymes that metabolize the drug (ET) in both the liver and small intestine. Furthermore, the fraction absorbed from gut lumen (Fa) is also assumed to be one because Fa is usually unknown. Here, we found that such assumptions lead to serious errors in predictions of AUCR. To resolve this, we propose a new framework to predict AUCR. Specifically, Fa was re-estimated from experimental permeability values rather than assuming it to be one. Importantly, we used the total quasi-steady-state approximation to derive a new equation, which is valid regardless of the relationship between Km and ET, unlike the MM model. Thus, our framework becomes much more accurate than the original FDA equation, especially for drugs with high affinities, such as midazolam or strong inducers, such as rifampicin, so that the ratio between Km and ET becomes low (i.e., the MM model is invalid). Our work greatly improves the prediction of clinical DDIs, which is critical to preventing drug toxicity and failure.

