生体反応をリアルタイムで可視化する新手法を展開 New technique deployed to visualize biological reactions in real time
2023-03-27 アルゴンヌ国立研究所(ANL)
米国エネルギー省のアドバンストフォトンソース(APS)のアップグレードにより、現在よりも500倍明るいX線ビームが生成され、生物系を含むあらゆる反応を研究することができるようになる。
この技術は、抗生物質や酵素などの分子の反応機構を理解することで、新しい医薬品の開発につながる可能性がある。
<関連情報>
- https://www.anl.gov/article/aps-upgrade-to-enhance-molecular-movies-to-understand-certain-types-of-antibiotic-resistance
- https://www.nature.com/articles/s41467-022-35029-3
L1メタロβ-ラクタマーゼによるβ-ラクタム切断の時間分解解析 Time-resolved β-lactam cleavage by L1 metallo-β-lactamase
M. Wilamowski,D. A. Sherrell,Y. Kim,A. Lavens,R. W. Henning,K. Lazarski,A. Shigemoto,M. Endres,N. Maltseva,G. Babnigg,S. C. Burdette,V. Srajer & A. Joachimiak
Nature Communications Published:30 November 2022
DOI:https://doi.org/10.1038/s41467-022-35029-3
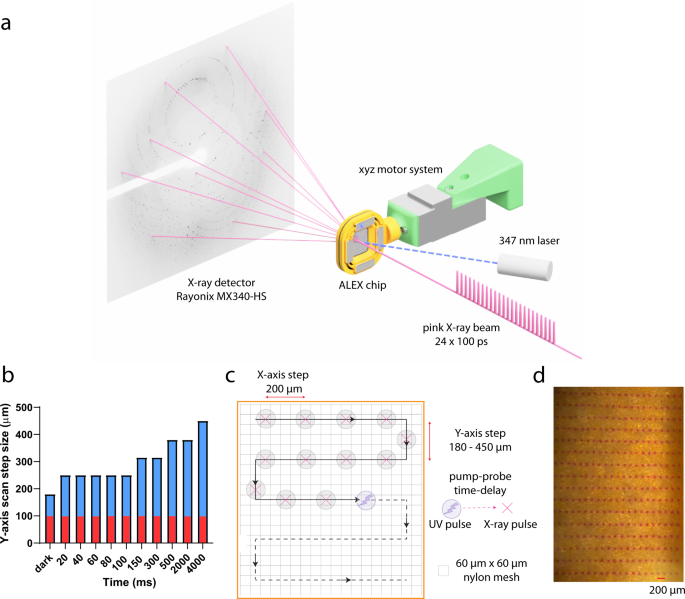
Abstract
Serial x-ray crystallography can uncover binding events, and subsequent chemical conversions occurring during enzymatic reaction. Here, we reveal the structure, binding and cleavage of moxalactam antibiotic bound to L1 metallo-β-lactamase (MBL) from Stenotrophomonas maltophilia. Using time-resolved serial synchrotron crystallography, we show the time course of β-lactam hydrolysis and determine ten snapshots (20, 40, 60, 80, 100, 150, 300, 500, 2000 and 4000 ms) at 2.20 Å resolution. The reaction is initiated by laser pulse releasing Zn2+ ions from a UV-labile photocage. Two metal ions bind to the active site, followed by binding of moxalactam and the intact β-lactam ring is observed for 100 ms after photolysis. Cleavage of β-lactam is detected at 150 ms and the ligand is significantly displaced. The reaction product adjusts its conformation reaching steady state at 2000 ms corresponding to the relaxed state of the enzyme. Only small changes are observed in the positions of Zn2+ ions and the active site residues. Mechanistic details captured here can be generalized to other MBLs.


