2024-07-18 国立遺伝学研究所
単細胞藻類の多くは、その細胞構造やゲノム構成が単純であるため、光合成生物に共通の現象やそのメカニズムを解明するのに適しています。しかしながら、遺伝子改変技術などの実験技法の開発が遅れているという問題があります。
光合成真核生物の進化の初期に分岐したグループである、単細胞紅藻イデユコゴメ類(綱)(Cyanidioschyzon merolae、CyanidiumおよびGaldieriaなど)は、光合成真核生物の中で遺伝子数が最小クラスであり(12-18 Mb、約4,700-8,000遺伝子)、細胞内構造も単純であるため、様々なオミクス解析を効率よく行うことができます。我々はこれまでに、本藻類の培養技術、相同組換えによる遺伝子破壊・導入技術、導入遺伝子の発現誘導系などを開発し、現在、世界各国の研究者等が、光合成、代謝、細胞周期、エピジェネティクス、生活環、タンパク質の構造、進化、産業利用など多様な分野の研究で、本藻類を用い始めています。
一方、イデユコゴメ綱の藻類は、RNA干渉機構(RNAi)を担う遺伝子群を失っているため、その機構を利用した遺伝子ノックダウンの実験を行えず、増殖や生存に必須な遺伝子の機能解析が困難でした。
これまで酵母や動物細胞を用いた研究では、RNA干渉に代わる手法として、目的遺伝子を狙ったタイミングで分解させる、誘導型タンパク質ノックダウン法が開発されてきました。その代表例である、オーキシンデグロン法(鐘巻研により開発)では、植物ホルモンであるオーキシンを細胞に添加することにより、標的タンパク質のユビキチン化が誘導され、その結果、プロテアソームによる迅速な分解が引き起こされます。本手法は、新規のタンパク質合成を阻害するRNAiとは異なり、すでに合成済みで細胞内で機能している標的タンパク質を直接分解できるという利点を有しています、しかしながら、植物ホルモンであるオーキシンは植物の成長や形態形成に影響を与え、またイデユコゴメ類に対して毒性があるため、本手法は適用できませんでした。
そこで我々は、イデユコゴメ類のC. merolae(図A)において、新たに、ラパマイシン誘導タンパク質ノックダウン法を開発しました。本手法は、化学物質ラパマイシンが、FRBタグ(ペプチド)とFKBPタンパク質を結合させる性質を利用しています(図B)。標的タンパク質にFRBを、ユビキチンリガーゼのサブユニット(CUL1)にFKBPを融合した細胞を用意し、これにラパマイシンを与えると、標的タンパク質とユビキチンリガーゼ複合体が結合し、標的タンパク質のユビキチン化とその後の分解が起こります(図B)。本手法を用いると、例えば試験用の標的タンパク質(蛍光タンパク質mVenus-FRB)は、ラパマイシン添加後、2時間以内にほとんど分解されます(図C)。また、論文中では、内在の必須遺伝子であるDRP5B(葉緑体分裂タンパク質)や、核内の細胞周期制御因子E2Fを迅速に分解できることを示しています。
本論文は、光合成生物において、タンパク質二量体誘導化合物を用いたタンパク質ノックダウン法を開発した初めての例となります。ラパマイシンはTORキナーゼの阻害剤であり、一般的には細胞に対して毒性がありますが、イデユコゴメ綱の生物に対しては毒性がありません。また、他生物においても、ラパマイシン類似体を用いることで、無毒性の誘導型タンパク質分解系を構築することができます。特にオーキシンに応答する陸上植物に対しては有用な方法になり得ます。本方法は藻類や陸上植物を含む光合成真核生物における精緻な実験系の構築を可能にし、様々な生物現象の解明に貢献します。
本研究は、科学研究費補助金(22K06396、20H00477)、JST未来社会創造事業(JPMJMI22E1)などの助成のもとに実施されました。
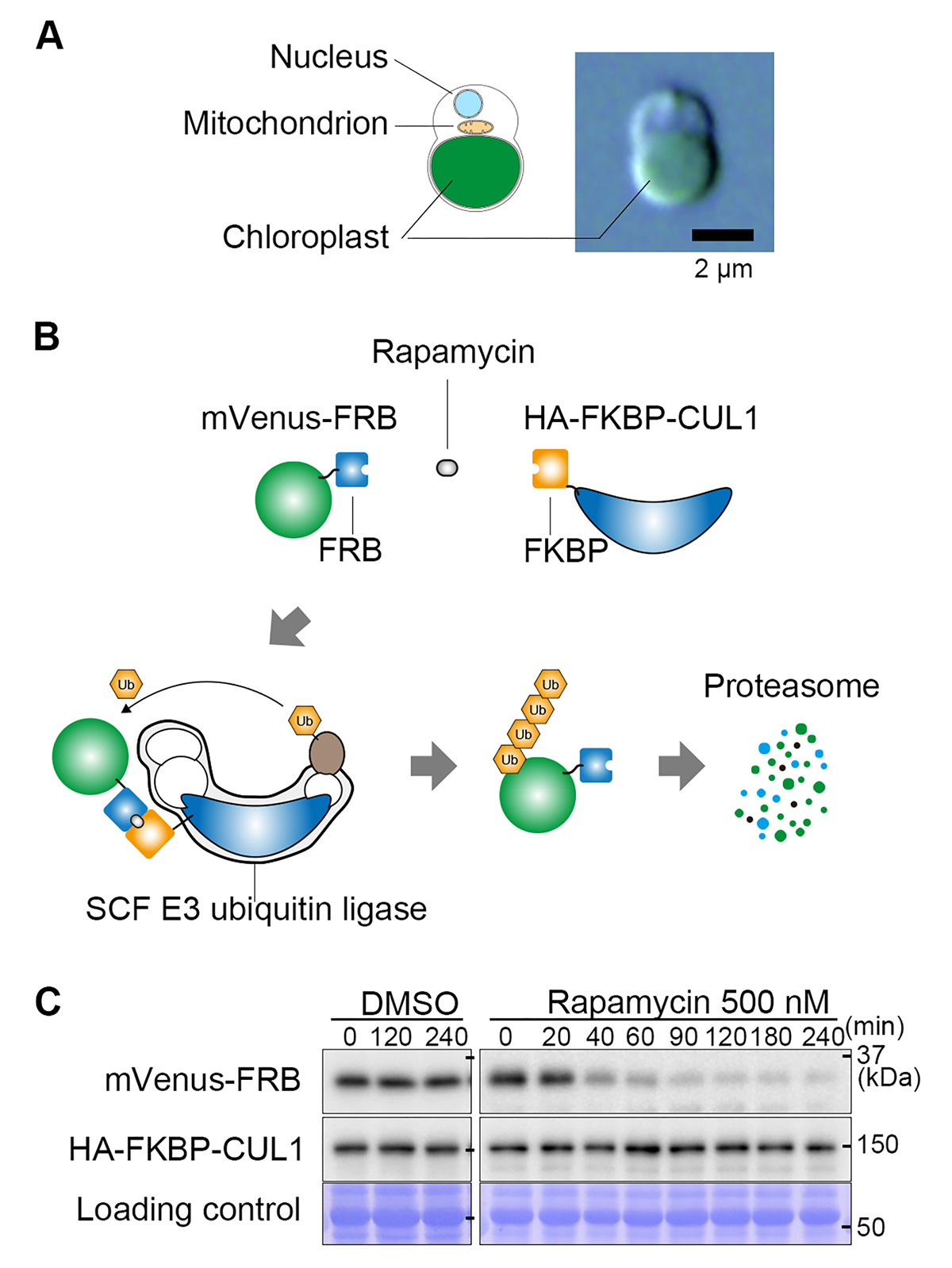
図:ラパマイシン誘導タンパク質ノックダウン法。
(A)単細胞紅藻Cyanidioschyzon merolaeの細胞内構造と微分干渉顕微鏡像。
(B)ラパマイシン誘導タンパク質ノックダウン法の仕組み。FRBタグとFKBPタンパク質はラパマイシン存在下でヘテロ二量体を形成する。FRBタグを融合した標的タンパク質(図では蛍光タンパク質mVenus)と、FKBPを融合させたユビキチンリガーゼのCUL1サブユニットは、ラパマイシン存在下で結合し、FRB-mVenusがユビキチン化される。ユビキチン化されたFRB-mVenusは速やかにプロテアソームにより分解される。
(C)ラパマイシン添加後のmVenus-FRBタンパク質レベルの減少を示すイムノブロット。
Development of a rapamycin-inducible protein-knockdown system in the unicellular red alga Cyanidioschyzon merolae.
Takayuki Fujiwara, Shunsuke Hirooka, Shota Yamashita, Fumi Yagisawa and Shin-ya Miyagishima
Plant Physiology (2024) kiae316 DOI:10.1093/plphys/kiae316