2025-02-27 京都大学iPS細胞研究所
ポイント
- ヒトiPS細胞由来の膵内胚葉細胞を用いて膵外分泌および内分泌系譜を含む膵組織を形成する分化システムを構築した。
- 膵外分泌系譜の分化過程における膵腺房前駆細胞のマーカー候補遺伝子としてREG4を同定した。
- cAMPシグナル経路の活性化因子であるフォルスコリンが、in vitroでのヒトiPS細胞由来膵内胚葉細胞から膵腺房系譜への誘導促進因子であることを示した。
1. 要旨
美馬淳志 研究生(CiRA増殖分化機構研究部門、京都大学大学院医学研究科 消化器内科)、長船健二 教授(CiRA同部門)らの研究グループは、REG4遺伝子を膵臓の腺房前駆細胞注1)のマーカー候補遺伝子として同定し、またcAMPシグナル経路の活性化因子であるフォルスコリンがin vitroにおけるヒトiPS細胞由来膵内胚葉細胞注2)から膵腺房前駆細胞への分化を促進する因子の1つであることを明らかにしました。
多くの膵外分泌疾患注3)の病態メカニズムは未解明で、効果的な治療法も不足しています。そのため、適切なヒト疾患モデルの開発が必要とされています。近年、多能性幹細胞を用いた再生医療研究が発展していますが、膵腺房細胞注1)への分化誘導法はまだ確立されていません。効率的な誘導法の確立が、膵外分泌疾患の病態メカニズムの解明や新しい治療薬の開発に貢献することが期待されています。
本研究では、ヒトiPS細胞由来の膵内胚葉細胞から膵腺房細胞への分化を誘導する上で、膵腺房系譜のマーカー遺伝子を探索し、その分化メカニズムを解明することを目的としました。まず、免疫不全マウスの腎被膜下に移植したヒトiPS細胞由来の膵内胚葉細胞が自発的に膵外分泌および内分泌系譜の両者を含む膵組織に分化することを確認しました。次に、ヒトiPS細胞由来膵組織の単一細胞RNAシーケンス解析(scRNA-seq)注4)により、膵外分泌系譜の分化過程における膵腺房前駆細胞のマーカー候補遺伝子REG4を同定しました。また、cAMP関連のシグナル経路がヒトiPS細胞由来の膵腺房系譜細胞の分化に関与していることを解明し、ヒトiPS細胞由来の膵内胚葉細胞に対してcAMPシグナル経路の活性化因子であるフォルスコリンで処理することで、REG4、および膵腺房細胞マーカー遺伝子であるPRSS1とPTF1Aの発現が有意に上昇することを見出しました。さらに、フォルスコリン処理した膵内胚葉細胞を免疫不全マウスに移植したところ、移植片内の膵腺房細胞の割合が有意に高くなることを確認しました。これらの結果は、フォルスコリン処理がヒトiPS細胞由来の膵内胚葉細胞を膵腺房系譜の細胞に分化させることを示唆しています。以上より、REG4が膵腺房前駆細胞のマーカー候補遺伝子であり、フォルスコリンがヒトiPS細胞から膵腺房系譜細胞への分化を促進する因子であることが示されました。
この研究成果は、2025年2月7日に英科学誌「Scientific Reports」で公開されました。
2. 研究の背景
遺伝性膵炎をはじめとする難治性の膵外分泌疾患の詳細な病態メカニズムは十分に解明されていません。また、適切な疾患モデルが不足しており、有効な治療法もほとんど開発されていません。主に実験動物としてマウスが使用されていますが、種の違いが結果の解釈の妨げとなることがよくあります。一方で、ヒトの体内から分離された膵腺房細胞は培養中に急速に細胞死を起こし、一部の細胞は自発的に間葉系細胞や膵管細胞など他の種類の細胞に分化するため、その利用が制限されています。そのため、膵外分泌疾患の病態メカニズムを再現する適切な疾患モデルの開発が求められています。近年、多能性幹細胞を用いた再生医療研究が発展していますが、膵腺房細胞の確立された分化誘導法は存在しません。したがって、効率的な膵腺房細胞の分化誘導法の確立が、膵外分泌疾患の病態メカニズムの解明や新しい治療薬の開発に貢献することが期待されています。
内胚葉系譜の発生過程において、PDX1を発現する後方前腸の一部がNKX6.1を発現することで膵内胚葉とよばれる組織に分化します。このPDX1およびNKX6.1を共発現する細胞が3つ全ての膵系譜細胞(膵腺房細胞、膵管細胞、膵内分泌細胞)の起源となる膵前駆細胞です。そのため、膵腺房細胞を作製する上で、ヒトiPS細胞由来の膵内胚葉細胞を経た膵腺房細胞への分化誘導は合理的な方法です。これまで膵腺房細胞のマーカー遺伝子としてAMYやPRSS1は知られていますが、その途中の分化段階である膵腺房前駆細胞のマーカー遺伝子は同定されておりません。
今回、研究グループは、ヒトiPS細胞由来の膵内胚葉細胞を用いて、膵外分泌および内分泌系譜の両者を含む膵組織を形成する分化システムを構築しました。
3. 研究結果
1)ヒトiPS細胞由来の膵内胚葉細胞を用いて膵外分泌および内分泌系譜の両者を含む膵組織を形成する分化システムの構築
研究グループはまず、in vitroでヒトiPS細胞由来の膵内胚葉細胞を作製し、それを免疫不全マウスの腎被膜下に移植することで、膵組織への分化促進を試みました。移植後0日、7日、14日、21日、30日の各移植片を免疫染色にて評価したところ、14日目以降に構造的変化を認め、21日目には細胞極性マーカーであるMucin1が管腔構造内により明確に発現していることが示され、膵臓発生における初期の段階の再現を示唆しました。30日後には、膵腺房細胞マーカーであるCPA1やPRSS1を発現する先端部細胞と、NKX6.1を発現する幹部細胞の分枝構造が観察され、移植片が初期胚の膵組織に相当していることがわかりました。これにより、膵腺房細胞の分化過程を調べるための有用な分化システムを構築することができました(図1)。
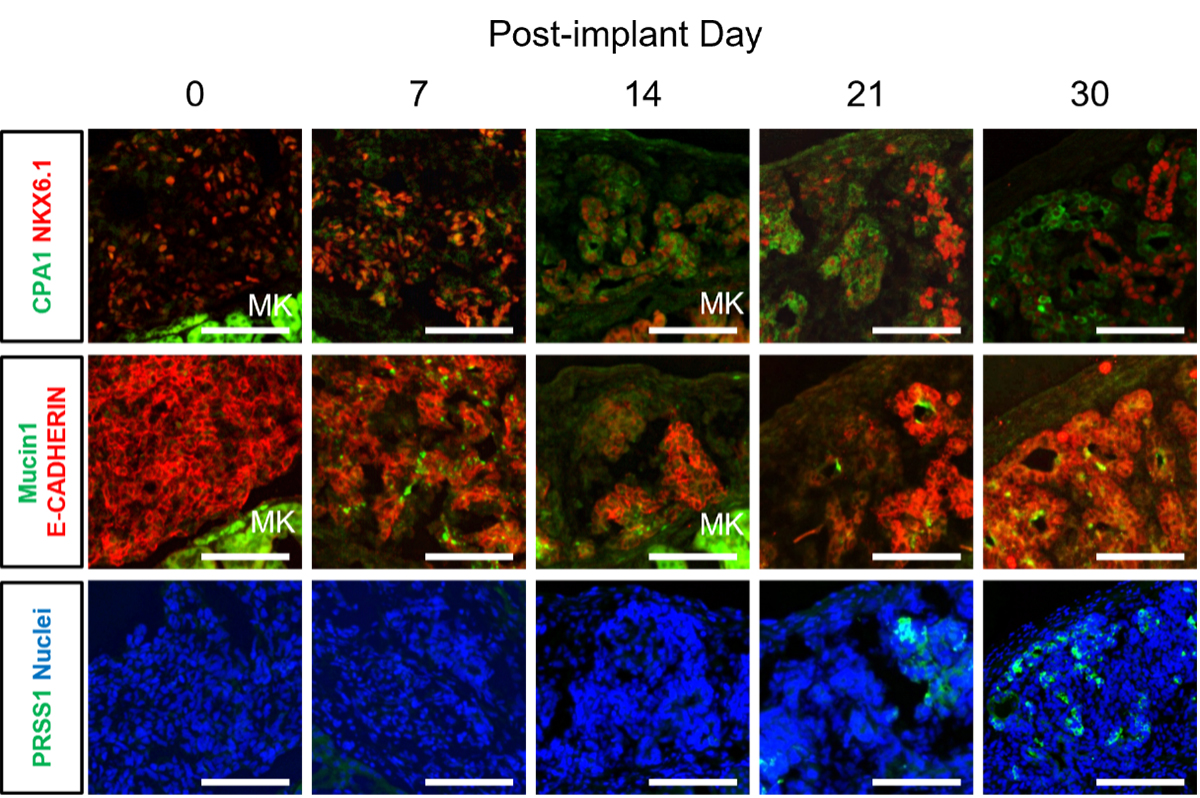
図1 ヒトiPS細胞由来の膵内胚葉細胞のin vivo分化は初期の膵臓発生を模倣する。MK:マウス腎。スケールバー:100 µm。
2)ヒトiPS細胞由来膵組織のscRNA-seqによる膵腺房前駆細胞のマーカー候補遺伝子REG4の同定
移植前の0日目(膵内胚葉細胞)、移植後11日目および25日目の膵組織の3つの検体に対してscRNA-seqを施行し、膵関連の細胞集団(クラスター)を選別して、最終的にtSNE法を用いて17の細胞集団に分類しました。そこから膵内胚葉細胞集団(クラスター12)に比して膵腺房前駆細胞集団(クラスター11)にて有意に発現上昇している遺伝子のうち、膵腺房細胞集団(クラスター5)に比して膵腺房前駆細胞集団(クラスター11)にて有意に発現上昇している遺伝子として、REG4、BGN、COL1A2、HAPLN1の4つが抽出されました(図2)。さらに、ヒト成体膵臓においてはBGN、COL1A2、HAPLN1は膵腺房細胞以外の膵細胞での発現も認めたため、最終的にREG4を膵腺房前駆細胞のマーカー候補遺伝子として選択しました。
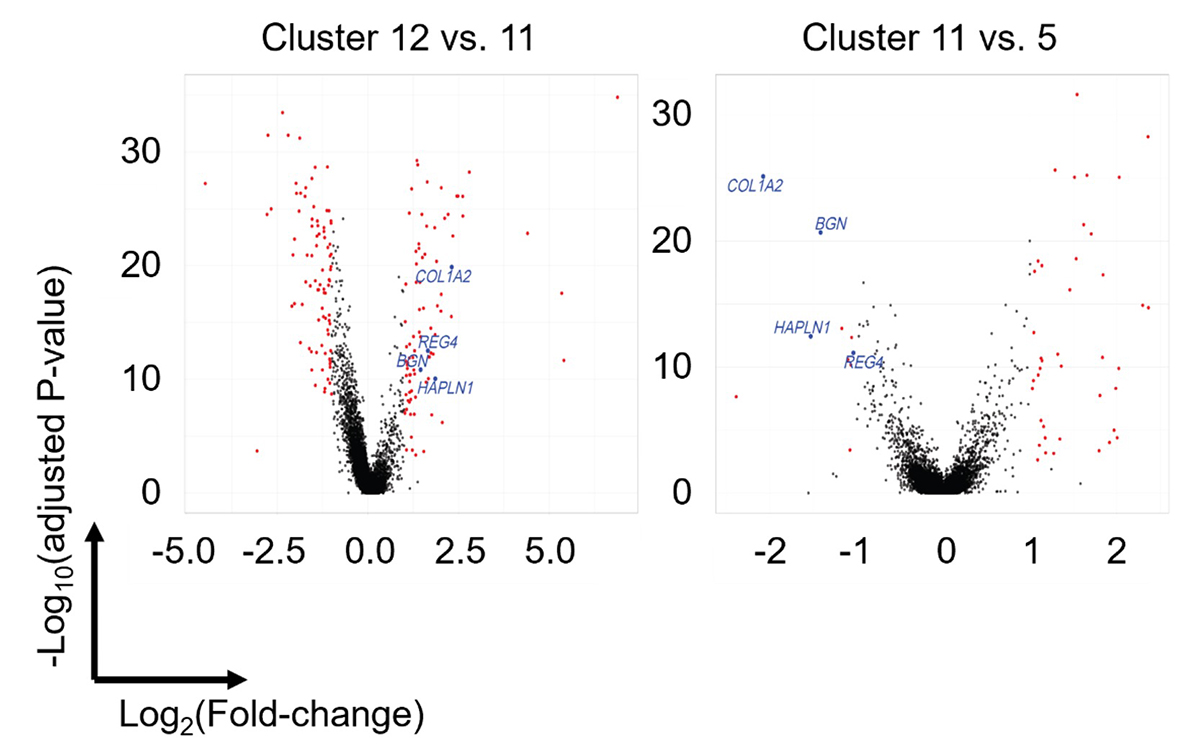 図2 左:膵内胚葉細胞集団(クラスター12)と膵腺房前駆細胞集団(クラスター11)の遺伝子発現を比較した発現差異遺伝子(DEG: Differentially Expressed Gene)のvolcano plot。右:膵腺房前駆細胞集団(クラスター11)と膵腺房細胞集団(クラスター5)のDEGのvolcano plot(|log2FC|> 1、P< 0.01)。
図2 左:膵内胚葉細胞集団(クラスター12)と膵腺房前駆細胞集団(クラスター11)の遺伝子発現を比較した発現差異遺伝子(DEG: Differentially Expressed Gene)のvolcano plot。右:膵腺房前駆細胞集団(クラスター11)と膵腺房細胞集団(クラスター5)のDEGのvolcano plot(|log2FC|> 1、P< 0.01)。
3)ヒトiPS細胞由来の膵内胚葉細胞をin vitroでフォルスコリン処理することにより膵腺房前駆細胞への分化が促進される
膵内胚葉細胞集団(クラスター12)と膵腺房前駆細胞集団(クラスター11)を比較して得られたDEGに基づいてデータを解析して視覚化し、膵腺房前駆細胞への分化に関与する9つの候補因子に注目しました。次に、in vitroでのヒトiPS細胞由来膵内胚葉細胞からの分化誘導実験により、9つの因子の中からcAMPシグナル経路の活性化因子であるフォルスコリンが膵腺房系譜の細胞を選択的に誘導する因子であることが示唆されました。ヒトiPS細胞由来の膵内胚葉細胞をフォルスコリンで処理することで、REG4、PRSS1、PTF1Aの発現が有意に上昇しました。さらに、ヒトiPS細胞由来の膵内胚葉細胞を免疫不全マウスに移植したところ、フォルスコリン処理を施した移植片ではPRSS1+細胞の割合が38.4 ± 5.6 %(n=3)と有意に高く、処理を施していない移植片では6.2 ± 1.4 %でした(p< 0.01; n=3)。また、CPA1+細胞の割合もフォルスコリン処理を施した移植片で8.7 ± 2.9 %と有意に高く、処理を施していない移植片では1.5 ± 0.4 %でした(p< 0.05; n=3)。これらの結果から、フォルスコリン処理がヒトiPS細胞由来膵内胚葉細胞から膵腺房系譜の細胞への分化を促進させることが示されました。
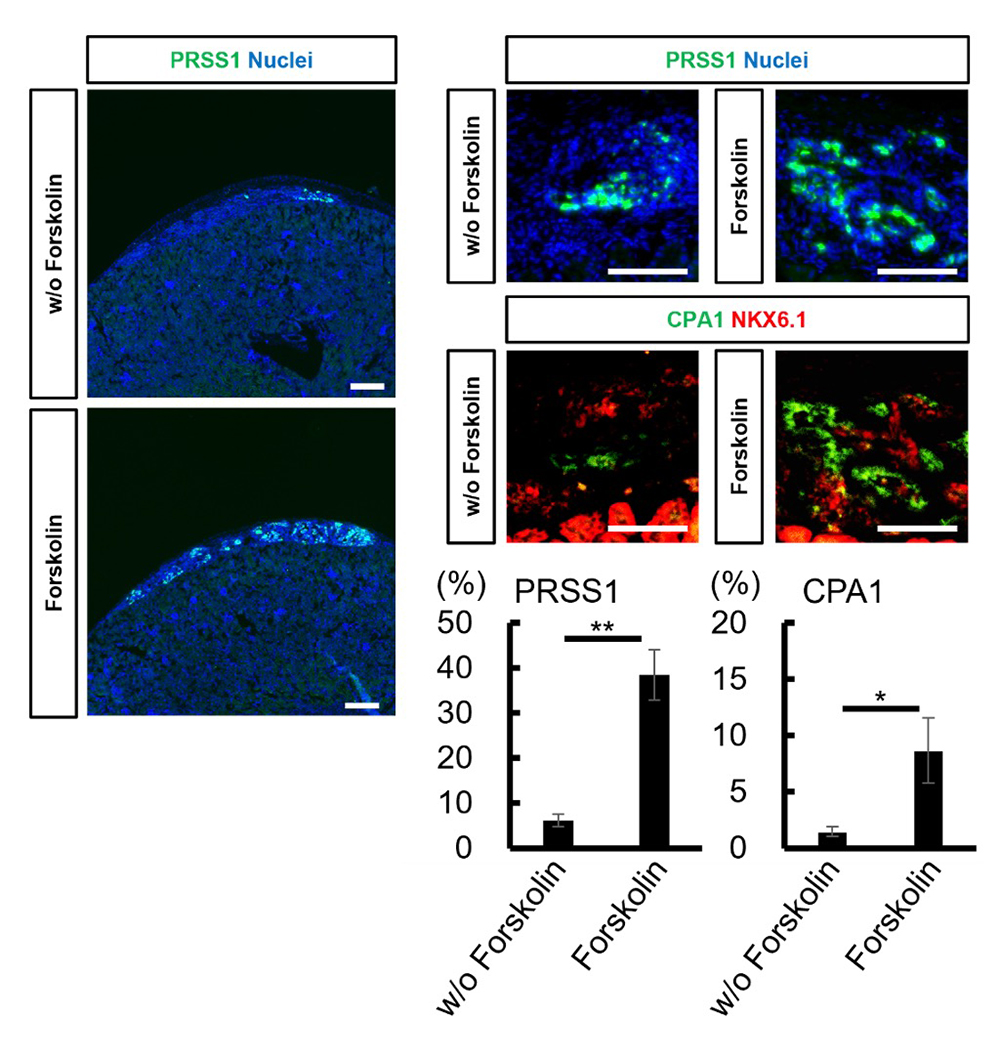 図3 左:ヒトiPS細胞由来膵内胚葉細胞に対してフォルスコリン処理の有無にて作製した移植後30日目の移植片内のPRSS1+細胞の免疫染色像。スケールバー:300 μm。右:移植片内のPRSS1+細胞またはCPA1+細胞の免疫染色像および移植片内の全細胞に対する割合の定量化。スケールバー:100 μm。
図3 左:ヒトiPS細胞由来膵内胚葉細胞に対してフォルスコリン処理の有無にて作製した移植後30日目の移植片内のPRSS1+細胞の免疫染色像。スケールバー:300 μm。右:移植片内のPRSS1+細胞またはCPA1+細胞の免疫染色像および移植片内の全細胞に対する割合の定量化。スケールバー:100 μm。
4. まとめ
研究グループは、ヒトiPS細胞由来の膵内胚葉細胞を用いて膵外分泌および内分泌系譜の両者を含む膵組織を形成する分化システムを構築、scRNA-seqを施行することで膵腺房前駆細胞のマーカー候補遺伝子としてREG4を同定し、cAMPシグナル経路の活性化因子であるフォルスコリンがin vitroでのヒトiPS細胞由来膵内胚葉細胞から膵腺房系譜の細胞を選択的に分化誘導する因子の1つであることを明らかにしました。これらの発見により、今後、より詳細な膵腺房細胞の発生メカニズムが解明され、ヒトiPS細胞から膵腺房細胞への効率的で安定した分化誘導が実現すること、さらには難治性膵外分泌疾患モデルの作製および病態メカニズムの解明や新しい治療薬の開発に貢献することが期待されます。
5. 論文名と著者
- 論文名
Mechanistic elucidation of human pancreatic acinar development using single-cell transcriptome analysis on a human iPSC differentiation model - ジャーナル名
Scientific Reports - 著者
Atsushi Mima1,2*, Azuma Kimura1,3, Ryo Ito1, Yu Hatano1, Hiraku Tsujimoto1,3, Shin-Ichi Mae1, Junko Yamane1, Wataru Fujibuchi1, Norimitsu Uza2, Taro Toyoda1**, Hiroshi Seno2, Kenji Osafune1**
* 筆頭著者
** 責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- 京都大学大学院医学研究科 消化器内科
- リジェネフロ株式会社
6. 本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- 国立研究開発法人日本医療研究開発機構(AMED)
[JP23bm1123002、JP24bm1123002、JP23bm1323001、JP24bm1323001] - iPS細胞研究基金
7. 用語説明
注1)腺房細胞/腺房前駆細胞
腺房細胞は膵臓の大部分を占めており、膵管を通じて十二指腸に消化酵素を含む膵液を分泌することによって外分泌機能を担っている。腺房細胞は、炭水化物、タンパク質、脂肪をそれぞれ消化するためのアミラーゼ、トリプシン、リパーゼなどのさまざまな消化酵素を合成する。腺房細胞に分化する細胞が腺房前駆細胞。
注2)膵内胚葉細胞
胚発生における内胚葉においてPDX1を発現する後方前腸の一部から発生し、膵内分泌、腺房、膵管の3つの全ての膵系譜細胞の起源となる膵前駆細胞である。膵内胚葉細胞は転写因子NKX6.1を発現しているため、PDX1、NKX6.1の共発現を目印とすることができる。
注3)膵外分泌疾患
膵臓から外分泌される消化酵素が欠乏し、必要な栄養素を食べ物から吸収できなくなる疾患。
注4)scRNA-seq
個々の細胞に対して次世代シーケンサーを用いてRNA の特定の配列や順序を決定し、その細胞において発現している全てのRNA分子の情報を調べる技術。