2024-01-24 京都大学iPS細胞研究所
ポイント
- マイクロ流体デバイス内に気管支上皮細胞からなるオルガノイドと血管内皮細胞からなる血管網を共培養する三次元培養系を構築しました。
- 新型コロナウイルスが気管支上皮細胞に感染しやすく、血管内皮細胞には感染しにくいことを実証しました。また、感染によって気管支上皮細胞からI型インターフェロンをはじめとした自然免疫応答により血管網構造が損傷を受けることを明らかにしました。
- 血管網構造の損傷は、インターフェロン阻害剤であるトファシチニブやバリシチニブを与えると抑制されることがわかりました。
1. 要旨
高山和雄 講師(CiRA増殖分化機構研究部門)らの研究グループは、横川隆司 教授、藤本和也 助教(共に京都大学大学院工学研究科)、長尾美紀 教授(京都大学大学院医学研究科)らと共同で、三次元的な構造をもった気管支と血管の組織を再現できる生体模倣システム(Microphysiological systems (MPS) )を開発し、新型コロナウイルスへの感染によって放出されるインターフェロン分子が血管の構造に影響を与えることを見出しました。
COVID-19では新型コロナウイルス(SARS-CoV-2)がヒト呼吸器系臓器に感染することがよく知られていますが、心臓や血管など呼吸器以外の臓器にも影響を与え、さまざまな症状を引き起こすこともわかっています。生体内では複数の臓器におけるさまざまな症状が同時多発的に起こるため、それぞれの臓器への感染やその感染機序を詳しく理解するためには、生体外でそれらを調べる方法が必要です。しかし、これまではヒト体内で起こる複雑な反応を再現する方法は限られていました。特に、ウイルス感染により細胞から放出されるサイトカインが他の細胞に与える影響や、血管構造・機能への影響を調べることは困難でした。
本研究では、生体内の環境を再現するためにマイクロ流体デバイスを用いた生体模倣システムを活用し、ヒト気管支上皮細胞からなるオルガノイドと三次元的な血管網を共培養する技術を開発しました。これにより、気管支上皮細胞あるいは血管網に選択的に新型コロナウイルスを感染させることが可能になりました(図1)。その結果、ウイルスは気管支上皮細胞に感染するものの血管内皮細胞には感染しにくいこと、そして感染した気管支上皮細胞からのI型インターフェロンが血管構造を壊し、その機能を低下させることがわかりました。
このモデルを使うことで、新型コロナウイルスが血管に影響を与える過程をさらに理解することや、将来出現する可能性のある新しい感染症にこの技術を応用し、そのメカニズムを解明するために役立つことが期待できます。
この研究成果は、2024年1月9日に国際学術誌「Lab on a Chip」のオンライン版に掲載されました。
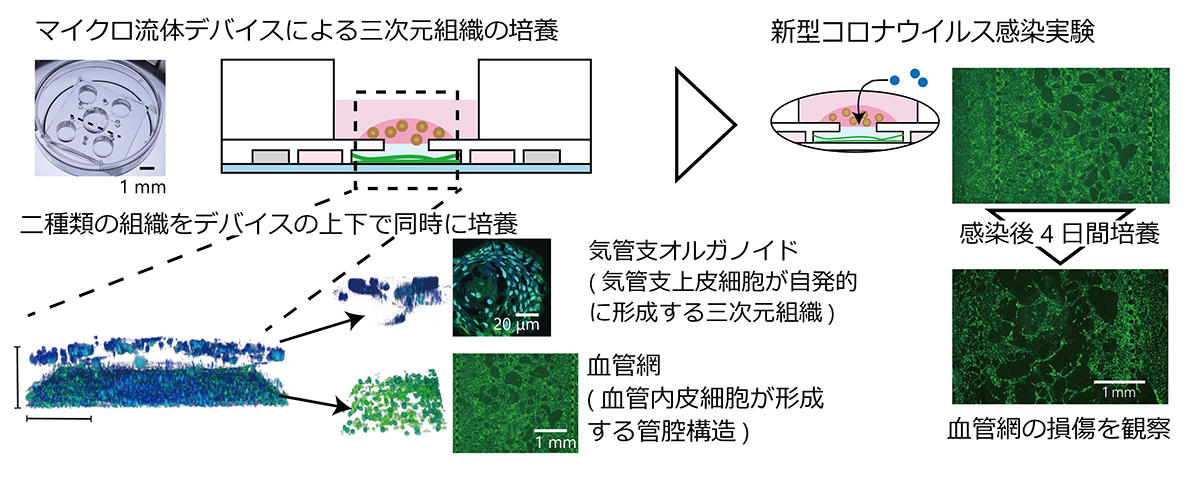
図1
MPSを用いて三次元構造をもつ気管支と血管網組織を共培養した。新型コロナウイルスをこのMPSに加えて感染実験を行ったところ、血管網の構造が感染の影響を受けることを確認した。
2. 研究の背景
COVID19はコロナウイルスの一種である新型コロナウイルス(SARS-CoV-2)が感染することで起こり、呼吸器での症状をはじめとして多様な症状を引き起こします。特に、血管での炎症など血管に関連した症状が多く報告されており、血管の構造や機能の障害が重症化と相関するという研究結果も報告されています。血管が傷害される原因として、ウイルスが血管内皮細胞に直接感染することや、ウイルス感染に対する免疫反応が過剰にはたらくことなどが想定されていますが、このような複数の器官どうしの相互作用を生体外で再現することは困難でした。
近年、マイクロ流体デバイスを利用して生体機能を再現する、生体模倣システム(Microphysiological systems (MPS) )の研究開発が目覚しい発展を遂げています。新型コロナウイルスの感染が呼吸器・血管に与える影響についてもMPSを用いた研究が報告されていますが、多孔質膜の上下で呼吸器細胞と血管内皮細胞を共培養する二次元的な細胞配置であり、三次元的な構造が実現できていません。
3. 研究結果
本研究では、多層構造のマイクロ流体デバイス内で血管床を作製し、その上で気管支オルガノイドを培養する手法を確立しました(図1)。この細胞配置により、気管支上皮細胞と血管内皮細胞に選択的にSARS-CoV-2を導入することができ、それぞれの器官における感染ともう一方の器官への影響を評価することができるようになりました。その結果、気管支上皮細胞からはウイルスが検出されたのに対して、血管内皮細胞への感染は低いレベルにとどまりました(図2a)。また、ウイルスを加えてから3日目まで血管網の培養液からは検出されなかったウイルスのmRNAが、4日目から検出されるようになりました(図2b)。これは、4日目に血管の構造が損傷し、気管支上皮細胞で増殖したウイルスが血管網の培地まで拡散して移動したためと考えられます。また,感染した細胞での遺伝子発現を網羅的に計測した結果から、感染細胞で自然免疫応答に関連する遺伝子の発現量増加を多く確認しました。感染実験後、血管網の構造が縮み血管どうしの接続が失われていることがわかりました。さらに、血管網を構成する内皮細胞が失われ、正常な血管では揃っている細胞骨格の秩序も乱れていることがわかりました(図2c)。
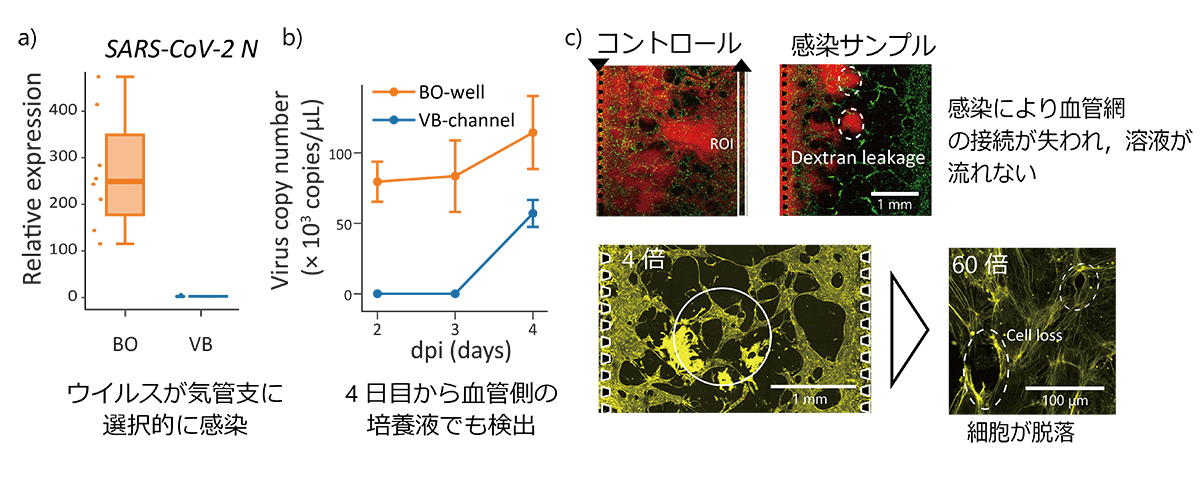
図2
a)気管支上皮細胞(BO:橙)でウイルスRNAが検出されたが、血管内皮細胞(VB:青)では検出されなかった。
b)培養液に放出されたウイルスRNAも感染後3日目までは気管支側でのみ検出されたが、4日目には血管網側でも検出された。
c)蛍光デキストラン溶液および蛍光染色した細胞骨格を観察し、血管網の損傷を確認した。
得られた実験結果から、感染した気管支上皮細胞からのI型インターフェロンに関連する分子の分泌が血管網の損傷を引き起こしていると考え、その阻害剤を加えて感染実験を行いました。その結果、気管支上皮細胞への感染は依然として見られたものの、血管網構造への影響は抑制されることがわかりました。また、CRISPR-Cas9を用いてゲノム編集を行い、I型インターフェロンのひとつであるIFNB1遺伝子を欠損させた気管支上皮細胞と、インターフェロンの受容体であるIFNRA2遺伝子を欠損させた血管内皮細胞を用いて同様の実験を行ったところ、同様に血管への影響が抑制されました。これらのことから、自然免疫応答において重要な役割を果たすI型インターフェロンが三次元的な血管構造の健全性に影響していることが示されました。
4. まとめと展望
ウイルス感染症が人体におよぼす影響を一種類の培養細胞への感染実験で再現することは困難であり、生体外で複数の細胞からなる組織を共存させ、相互の影響を評価することが不可欠です。本研究で確立した三次元組織の共培養とウイルス感染実験およびその評価手法は、COVID-19の病態のさらなる理解や今後想定される新興再興感染症の研究に向けて有効なアプローチの一つとなることが期待できます。今後は、免疫細胞も含んだモデルや、気管支以外の組織と血管系の三次元共培養モデルの開発を進める予定です。
5. 論文名と著者
- 論文名
SARS-CoV-2-induced disruption of a vascular bed in a microphysiological system caused by type-I interferon from bronchial organoids - ジャーナル名
Lab on a Chip - 著者
Kazuya Fujimoto1, Yoshikazu Kameda1, Yuta Nagano1, Sayaka Deguchi2, Takuya Yamamoto2,3,4, Rafal P. Krol5, Peter Gee6, Yasufumi Matsumura7, Toru Okamoto8, Miki Nagao7, Kazuo Takayama2,*, Ryuji Yokokawa1,*
* : 共同責任著者 - 著者の所属機関
- 京都大学大学院工学研究科
- 京都大学iPS細胞研究所(CiRA)
- 京都大学高等研究院 ヒト生物学高等研究拠点(WPI-ASHBi)
- 理化学研究所革新知能統合研究センター(AIP)iPS細胞連携医学的リスク回避チーム
- 京都大学iPS細胞研究財団 研究開発センター
- MaxCyte社
- 京都大学大学院医学研究科
- 順天堂大学大学院医学研究科
6. 本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- 日本医療研究開発機構(AMED)(JP21gm1610005, JP22bm0104001)
- iPS細胞研究基金
- 京都大学iPS細胞研究所山中伸弥研究室への新型コロナウイルス特別研究助成