2024-01-31 理化学研究所,神戸大学,科学技術振興機構
理化学研究所(理研)生命機能科学研究センター 構成的細胞生物学研究チームの山崎 陽祐 リサーチアソシエイト、宮﨑 牧人 チームリーダー、神戸大学大学院 農学研究科 修士課程2年の宮田 優里 大学院生、同バイオシグナル総合研究センターの森垣 憲一 教授(同大学院 農学研究科 教授)らの共同研究グループは、生体分子アクチン[1]による自発的な細胞骨格[1]形成を空間的に制御できる技術を開発しました。
本研究成果は、アクチンが担う細胞の運動や変形など基本的な生命機能の理解だけではなく、がん細胞の浸潤や転移など、アクチンが関わるさまざまな病気の原因の解明や治療法の開発への貢献が期待されます。
共同研究グループは、細胞膜上でナノメートルサイズのアクチン分子が、細胞骨格と呼ばれる、自身の千倍以上大きなマイクロメートルサイズのネットワーク構造[1]を自ら組み上げる仕組みに着目しました。そこで、半導体製造に使われる光リソグラフィー技術[2]によりアクチンネットワーク形成を誘導する領域の形やサイズなどのパターンを自在に制御できる人工生体膜を作製し、この膜上でさまざまな形状のアクチンネットワークを形成させることに成功しました。この技術を使うことで、細胞膜上でアクチン分子が骨格構造を組み上げ、細胞の動きや形を制御する仕組みを、膜領域の物理的条件としての”形”と”サイズ”という新しい観点から理解することが可能となります。
本研究は、科学雑誌『Nano Letters』オンライン版(1月31日付:日本時間1月31日)に掲載されました。

人工生体膜(青)上のアクチンネットワーク形成区画(マゼンタ)とネットワーク構造(緑)
背景
私たちの体を作る細胞は脂質[3]でできた膜(細胞膜)で包まれていて、この細胞膜はアクチンというタンパク質でできた裏打ち構造(細胞骨格)によって支えられています(図1)。アクチン1分子はナノメートル(nm、1nmは10億分の1メートル)サイズの球状ですが、たくさんの分子が連なることでひも状のアクチンフィラメントになります。さらにフィラメントが集合して、細胞の状態や外部環境に応じてマイクロメートル(μm、1μmは100万分の1メートル)サイズのさまざまな構造が組み上がります。例えば細胞が動くときには、静止した細胞では見られないメッシュ状や束状のネットワークが作られます。細胞は、このネットワークの形を状況に応じて変えることで力を発生し、細胞をうまく変形させて動きます。
これらのネットワーク構造は、免疫細胞が病原体に向かう動作や、がん細胞の浸潤や転移を駆動していると考えられているため、その構造形成の仕組みの解明は医学的にも重要です。これまでの研究から、形成に関わるさまざまなタンパク質が解明されてきました。しかし、これらのタンパク質を細胞から取り出して試験管内で混ぜ合わせても、細胞内と同じようなネットワーク構造はできません。何か足りない要素があるはずです。
アクチンネットワーク形成の最初のステップは、アクチンフィラメントが伸びる際の起点となる「核(アクチン分子が三つ結合した複合体)」の形成です。今回共同研究グループは、細胞内でネットワーク構造が作られる際の二つの特徴に着目しました。
特徴1:アクチンフィラメントの核形成を促進する要素(NPF[4]やフォルミン[5]と呼ばれるタンパク質など)が、細胞膜上の限定された区画に集積する(以降、この区画を核形成領域と呼ぶ)。
特徴2:核形成領域は、ネットワーク構造の種類ごとに特徴的なサイズと形がある。
これらから、核形成領域の形やサイズが、アクチンが組み上がってできるネットワーク構造を制御していると仮説を立てました。本研究では、細胞膜上の核形成領域を人工的に再現し、この仮説を検証するための新しい実験技術を開発しました。
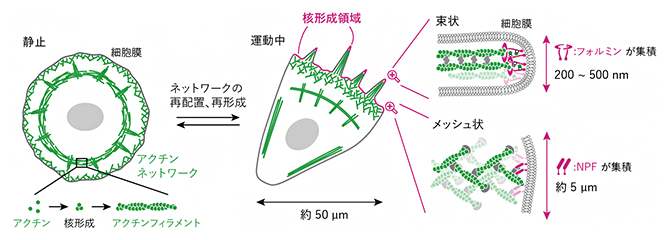
図1 アクチンネットワークと核形成領域
球状のアクチン分子が三つ集まることで重合核を形成し、たくさんのアクチン分子が連なることで繊維(アクチンフィラメント、緑色)となる(左下)。多数のアクチンフィラメントがさらにネットワークを形成することで細胞骨格と呼ばれる細胞膜(灰色)の裏打ち構造を作る(左)。このネットワークは細胞の状態によって構造を変え、運動中の細胞ではアクチンフィラメントが束状やメッシュ状に集合したネットワークが形成される(中央)。これらのネットワークは、細胞膜上の核形成領域(マゼンタ)から伸長する。核形成領域にはネットワークの種類ごとに特徴的なサイズや形があり、ネットワークの伸長起点には核形成を促進するタンパク質であるフォルミンやNPF(右、マゼンタ)が集積する。
研究手法と成果
細胞膜の特徴の一つに、膜を構成する脂質分子の流動性(膜中で分子が動く)があります。共同研究グループは、細胞膜のような流動性を持つ膜に核形成領域を人工的に形成するために、半導体製造に使われる光リソグラフィー技術を応用して作製したパターン化人工生体膜を用いました(図2a)。この膜は、(i)脂質分子同士が横方向に架橋されて動かない脂質膜(重合膜)と、(ii)膜中で分子が動く脂質膜(流動膜)の2種類の脂質膜で構成されます。最初に、光リソグラフィー技術によって細胞よりも小さい一辺が10μmの正方形の穴が格子状に空いた重合膜を作り、この枠の中に流動膜を埋め込みました。さらにこのパターン化された流動膜に、細胞の核形成領域で見られるタンパク質NPF(図1)を吸着させることで、上述の特徴1を人工的に再現しました。ここに、NPFと協同してネットワークを組み上げるArp2/3[4]というタンパク質を含む反応溶液を添加すると、NPFが集積した区画上でのみアクチンネットワークが形成され、柱状に伸びました(図2b)。こうして、細胞膜上の制御されたネットワークの組み上げ(図1)を再現できました。
なお、本研究のように核形成領域を人工的に作る方法は以前に2種類報告されていました(図2c)注1、2)。いずれの方法も、本研究の方法の重合膜の代わりに高分子のポリエチレングリコール(PEG)[6]を使います。これらの方法では、核形成領域がPEG分子の高い壁に囲まれてしまうなど、核形成領域と外側との境界が細胞内と大きく異なる可能性があります。一方、本研究の方法は、核形成領域と外側は平坦につながり領域の外側も脂質膜であるため、細胞内環境により近づけられます。さらに従来法よりも小さく複雑な形の核形成領域を作成できるため、細胞内に近い環境で核形成領域の形やサイズの効果(特徴2)を検証できます。
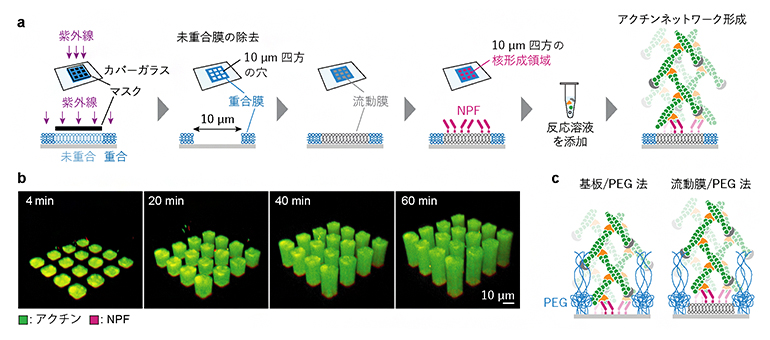
図2 本研究で開発した実験系
(a)本研究で開発した実験系の概略図。10μm四方の穴の空いた重合膜をカバーガラス上に作成し、この穴に流動膜を埋め込み、さらにNPFを流動膜上だけに吸着することで核形成領域を人工的に形成した。この脂質膜にアクチン(緑)とArp2/3(オレンジ)などを含む反応溶液を添加した。
(b)パターン化人工生体膜上に吸着されたNPF(マゼンタ)によって形成されたアクチンネットワーク(緑)。NPF領域と同じ形の断面を持つ柱のようなネットワークが形成された。
(c)先行研究で報告された高分子PEGでパターンの枠(青色)を作る方法。NPFをガラスに直接吸着する方法(基板/PEG法)と、PEGの枠に埋め込んだ流動膜に吸着する方法(流動膜/PEG法)の二通りがある。PEGの枠が高い障壁として作用する可能性があり、さらに基板/PEG法ではNPFが細胞膜と異なる硬い基板に結合し動けないという問題点がある。
この技術を用いて、さまざまな形やサイズの核形成領域を1枚の人工生体膜上にパターン化しました(図3a、b)。その結果、それぞれの核形成領域と同じ形・サイズの断面を持つ柱状のアクチンネットワークが形成されました(図3c、d)。また、同じ溶液条件で同じ膜上でも、核形成領域のサイズが大きいほどアクチンの柱が長く伸びました(図3e)。これらの結果から、タンパク質の種類や濃度などの化学的条件のみならず、核形成領域の形やサイズなどの物理的条件も、ネットワーク構造や伸び方を制御していると考えられます。
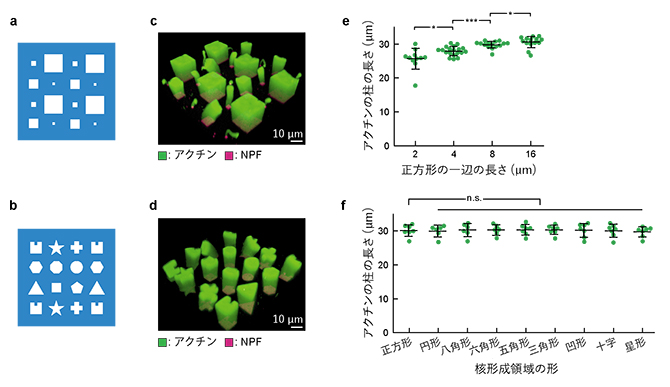
図3 核形成領域のサイズと形の効果
(a)サイズの異なる正方形パターンの重合膜のイラスト。一辺が2μm、4μm、8μm、16μmの正方形から成る。
(b)さまざまな形から成るパターンの重合膜のイラスト。面積はいずれも100μm2。
(c)(a)のサイズの核形成領域上で形成されたアクチンネットワーク(緑)。
(d)(b)のパターンの核形成領域上で形成されたアクチンネットワーク(緑)。
(e)反応開始後60分のアクチンネットワークの長さと核形成領域のサイズの関係。核形成領域のサイズが大きいほど、アクチンの柱が長く伸びた。
(f)反応開始後60分のアクチンネットワークの長さと核形成領域の形の関係。核形成領域の形が異なってもサイズが同じであれば、アクチンの柱は同じ長さとなった。
次に、パターン化人工生体膜に吸着するタンパク質をフォルミンに替えました(図4a)。フォルミンも運動中の細胞の核形成領域で見られますが、NPF-Arp2/3の組み合わせと異なり、アクチンフィラメントの一本一本を長く伸ばす働きがあります(図1)。フォルミン吸着膜とアクチン、さらにアクチンフィラメントを架橋するタンパク質ファシンを含む溶液を反応させると、長いアクチンフィラメントの束がフォルミン吸着領域の縁(重合膜と流動膜の境界)の形に沿って平面的に伸長し、渦状のネットワーク構造が形成されました(図4b)。このことから、核形成を促進するタンパク質の違いに加えて、核形成領域の形も何らかの仕組みでネットワークの伸び方に影響を及ぼすと考えられます。
以上のアクチンネットワーク形成実験では、核形成に関わるタンパク質をあらかじめ膜に吸着させた状態で行いましたが、一方、運動中の細胞では、これらのタンパク質は特定の脂質分子(PI(4,5)P2[3])に富む細胞膜に集積し、そこから束状のアクチンネットワークが形成されると考えられています(図1)。そこで、このような脂質分子に依存したアクチンネットワーク形成を人工膜上で再現することを試みました。そのために、アクチンネットワーク形成に必要なタンパク質を含め、卵の成長に必要なあらゆるタンパク質が含まれているカエル卵[7]の抽出液を用いました(図4c)。この卵抽出液をPI(4,5)P2を含むパターン化脂質膜と反応させたところ、PI(4,5)P2膜上だけでネットワーク形成反応が進み、数マイクロメートル程度のフィラメントが束化し、膜から突き出した指のようなネットワークが形成されました(図4d)。
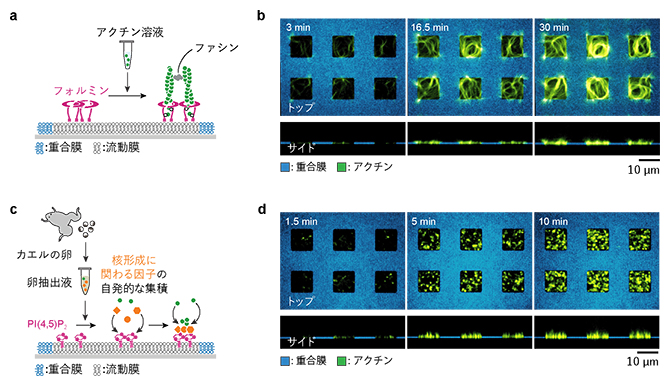
図4 パターン化人工生体膜を用いた二つの応用実験
(a)フォルミン(マゼンタ)をパターン化した流動膜に吸着させた実験の概念図。フィラメントを架橋するファシン(グレー)を添加した。
(b)フォルミン領域上で平面的に形成されたアクチンネットワーク(緑)。フォルミン領域の縁(重合膜と流動膜の境界)の形に沿って渦状に伸長した。上段:カバーガラス上面から見た図、下段:横から見た図。
(c)PI(4,5)P2(マゼンタ)を含む流動膜をパターン化した実験の概念図。パターン化PI(4,5)P2膜にカエルの卵抽出液を添加した。抽出液に含まれる核形成領域の形成に必要なタンパク質(オレンジ)が流動膜中のPI(4,5)P2に集積し、アクチンネットワーク形成を誘発する。
(d)PI(4,5)P2領域上で形成されたアクチンネットワーク(緑)。針状の細長いネットワークが流動膜上だけで多数形成され、膜から突き出した指のように見える。
注1)Reymann, A.-C.; Martiel, J.-L.; Cambier, T.; Blanchoin, L.; Boujemaa-Paterski, R.; Théry, M. Nucleation Geometry Governs Ordered Actin Networks Structures. Nat. Mater. 2010, 9 (10), 827- 832.
注2)Colin, A.; Orhant-Prioux, M.; Guérin, C.; Savinov, M.; Cao, W.; Vianay, B.; Scarfone, I.; Roux, A.; De La Cruz, E. M.; Mogilner, A.; Théry, M.; Blanchoin, L. Friction Patterns Guide Actin Network Contraction. Proc. Natl. Acad. Sci. U. S. A. 2023, 120 (39), No. e2300416120.
今後の期待
アクチン細胞骨格の制御異常はがん細胞の浸潤や転移、神経細胞の成長異常などに関わるため、アクチンネットワーク形成の仕組みの解明は基礎科学のみならず医学的にも重要です。今回開発したパターン化人工生体膜を用いる細胞骨格形成技術は、従来の方法では難しかった、細胞内で見られる核形成領域と同じくらい小さい、数マイクロメートル程度の大きさや複雑な形のパターンを、流動的な脂質膜上に形成できます。
アクチンネットワークの分解と再形成には、細胞膜に集積したタンパク質が膜上を動き回ることが重要であると指摘されています。本方法では流動膜の脂質組成を変えることで膜上のタンパク質の動きやすさを制御し、その効果を検証することも可能です。
よって、本実験系は、核形成領域の形やサイズ、膜上のタンパク質の動きやすさなどの物理的条件という新たな観点から、アクチンのネットワーク形成の仕組みを理解することに貢献すると期待されます。また、卵抽出液を用いることで、実際の細胞では観察が難しい核形成領域の形成過程の研究にも応用可能です。さらに、本実験系を細胞内のアクチンに関与する部分を”切り出した”モデルとして用いることで、アクチンが関わるさまざまな病気の原因の解明や、創薬におけるスクリーニングへの応用が期待されます。
補足説明
1.アクチン、細胞骨格、ネットワーク構造
アクチン1分子は直径約5nmの球状タンパク質。アクチンが集合してひも状になったアクチンフィラメントは、細胞の形や運動、細胞小器官の輸送などに関わる細胞骨格として機能する。一般的な真核細胞の大きさは約50μmで、アクチンの作るネットワーク構造の大きさは図1のように数百ナノメートルから数マイクロメートルで、アクチン1分子のおよそ1,000倍大きい。アクチン分子を人のサイズ(1m)とすると、アクチンネットワークのサイズは1km程度になる。これだけ大きく、しかも機能的な構造を、頭脳を持たない分子が作り上げる仕組みはまだ分かっていないことが多い。
2.光リソグラフィー技術
感光性の材料に光を当てて、微細加工する技術。本研究では、紫外線で重合する性質を持つ脂質でまず膜を作り、その上にさまざまな大きさや形のフォトマスクをかぶせて紫外線を当てることで、紫外線が当たった部分の脂質だけを重合させた。その後、未重合の脂質膜を除去して空いた穴に流動膜を埋め込むことで、細胞膜を模倣した脂質膜を任意の形とサイズでパターン化した。
3.脂質、PI(4,5)P2
脂質は糖質、タンパク質と並ぶ3大栄養素の一つ。特にリン脂質という脂質は細胞膜の主成分で、生命機能にとって重要である。リン脂質分子は水になじむ(親水性)部分となじまない(疎水性)部分の両方を持つ。細胞膜は、脂質分子が親水/疎水の向きをそろえて並んでできた膜が疎水部分で合わさって二枚重ねになった構造になっている。PI(4,5)P2は細胞膜に含まれる脂質の一種。アクチンネットワークの形成に関わるタンパク質には、PI(4,5)P2と結合するものが多い。PI(4,5)P2の分布や密度が細胞内外の状態に応じて変化し、これによりこれらのタンパク質の細胞膜上の分布が制御され、細胞内外の状態とアクチン細胞骨格の形成を調節している。
4.NPF、Arp2/3
いずれもアクチンの核形成に関わるタンパク質。NPFは総称で、N-WASPやWAVE1などいくつかの種類がある。Arp2/3は七つのタンパク質が集まった複合体である。NPFは分子内にPI(4,5)P2と結合する部分を持つ。運動中の細胞の前端部分の細胞膜にはPI(4,5)P2が豊富な区画が形成され、NPFはここに集積する。集積したNPFがアクチンやArp2/3と結合し、さらにこの複合体が既存のアクチンフィラメントの側面と結合するとArp2/3で核が形成され、新しいアクチンフィラメントがy字型に枝分かれしたように伸びる。新しい枝が伸び始めるとNPFはArp2/3やアクチンから外れ、新しいArp2/3、アクチンと結合して枝を増やし、メッシュ状のアクチンネットワーク(ラメリポディア)が形成される。核を形成するArp2/3のようなタンパク質を核形成因子という。NPFはNucleation Promoting Factorの略で、核形成を促進する因子、という意味。
5.フォルミン
アクチンの核形成因子(補足説明[4])の一種。細胞内ではフォルミン2分子が結合していて、ドーナツ状の円環構造とドーナツから生えたひも状の構造を持つ(図1、4a)。ひも部分で重合していないアクチンを捉えてドーナツの穴近くに運ぶ(正確には、細胞内でアクチンはプロフィリンというタンパク質と結合していて、フォルミンのひもはこのプロフィリンを捉える)。ドーナツの穴に運ばれたアクチン同士が結合して、アクチンの核が形成される。同様にして核にアクチン分子を次々と結合し、アクチンフィラメントを長く伸ばす。アクチンフィラメントは図1のように二重らせん構造で、フォルミンはこのらせんに沿って回転することが知られている。また、フォルミンもNPFと同様にPI(4,5)P2と結合し、運動中の細胞の前端部分に集積する。
6.ポリエチレングリコール(PEG)
エチレングリコールHO-CH2-CH2-OHが両端のOH基で重合した高分子。生体内で安定であり化学反応を起こさないため、医薬品の添加物や化粧品などバイオマテリアルとして広く使われている。長い鎖状の分子だが、水溶液中では不規則に折り畳まれた団子状になることが多い。
7.カエル卵
卵細胞は一般的な細胞よりも大きく、その後の発生に必要なタンパク質などの生体分子を多量に含んでいるため、細胞質成分を得るのに適している。本研究では、アフリカツメガエルの卵細胞を用いた。
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究)で実施し、科学技術振興機構(JST)戦略的創造研究推進事業さきがけ「アクチン細胞骨格動態の構成的理解と制御(研究代表者:宮﨑牧人、課題番号:JPMJPR20ED)」、日本学術振興会(JSPS)科学研究費助成事業挑戦的研究(萌芽)「アクチン細胞骨格を直接操作できるオプトジェネティクスツールの開発(研究代表者:宮﨑牧人)」、京都大学白眉プロジェクトによる助成を受けて行われました。
原論文情報
Yosuke Yamazaki, Yuuri Miyata, Kenichi Morigaki and Makito Miyazaki, “Controlling physical and biochemical parameters of actin nucleation using a patterned model lipid membrane”, Nano Letters, 10.1021/acs.nanolett.3c02742
発表者
理化学研究所
生命機能科学研究センター 構成的細胞生物学研究チーム
リサーチアソシエイト 山崎 陽祐(ヤマザキ・ヨウスケ)
チームリーダー 宮﨑 牧人(ミヤザキ・マキト)
神戸大学
バイオシグナル総合研究センター
教授 森垣 憲一(モリガキ・ケンイチ)
(神戸大学 大学院農学研究科 教授)
大学院農学研究科
修士課程2年 宮田 優里(ミヤタ・ユウリ)
報道担当
理化学研究所 広報室 報道担当
神戸大学 総務部 広報課
科学技術振興機構 広報課
JSTの事業に関すること
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
保田 睦子(ヤスダ・ムツコ)


