2024-09-04 理化学研究所
理化学研究所(理研)生命医科学研究センター 免疫シグナル研究チーム(研究当時)の齊藤 隆 チームリーダー(研究当時、現 免疫器官形成研究チーム 客員主管研究員、現 創薬抗体基盤ユニット 客員主管研究員)らの国際共同研究グループは、免疫チェックポイント分子[1]LAG-3が免疫を抑制するメカニズムを解明しました。
本研究成果は、がん免疫療法の新たな薬剤開発に貢献することが期待できます。
LAG-3分子は、PD-1[2]、CTLA-4に続く免疫チェックポイント分子で、LAG-3阻害抗体を用いたがん免疫療法の開発が進められていますが、LAG-3による免疫機能の抑制メカニズムはいまだに明らかになっていませんでした。
今回、国際共同研究グループは、分子イメージングの手法を用いて、LAG-3分子の動態を解析し、抑制機構の一端を明らかにしました。T細胞[3]の活性化に伴って、T細胞受容体(TCR)[4]はTCRミクロクラスター(TCR-MC)[5]を形成して活性化シグナルを伝えますが、LAG-3もクラスターを形成してTCR-MCに会合して、T細胞活性化を抑制することが分かりました。LAG-3抗体は、TCR-MCとLAG-3クラスターの共局在を阻害し、LAG-3によるT細胞活性化の抑制を解除させ、活性化を誘導することが判明しました。TCR-MCとLAG-3クラスターとの会合が、T細胞活性化抑制を阻害するための標的であることが明らかになりました。
本研究は、科学雑誌『Frontiers in Immunology』オンライン版(8月21日付)に掲載されました。
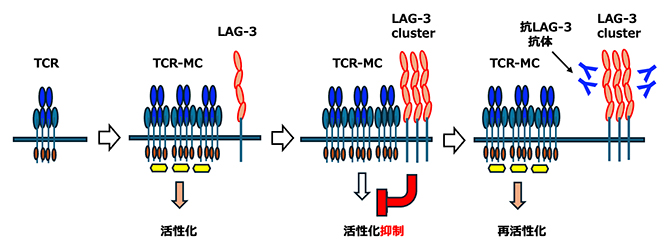
免疫チェックポイント分子LAG-3による免疫抑制とLAG-3抗体による抑制解除のメカニズム
背景
免疫系は、病原体やがん細胞から体を守り、その中心的役割をT細胞が担っています。T細胞は、それぞれが独自の抗原受容体(T細胞受容体、TCR)を持ち、抗原提示細胞上でMHC-Ⅱ[6]分子に提示された抗原を認識して活性化されます。T細胞が抗原を認識すると、TCRがTCR-MCを形成し、そこに活性化に重要な種々のキナーゼ(リン酸化酵素)などが集結してT細胞の活性化を誘導します。T細胞にはTCR以外にも免疫補助受容体[7]が複数発現し、T細胞活性化を正・負(活性・抑制)に制御しています。このうち負に制御するのがPD-1やCTLA-4に代表される抑制性免疫補助受容体で、過剰な刺激や自己に対する反応を抑制する機能を果たしています。この負の制御が適切に働かないとT細胞が自己組織を攻撃して、自己免疫疾患を発症します。がん細胞に対する反応も抑制性免疫補助受容体によって抑制されており、その抑制機能を阻害することでがんに対する免疫細胞の攻撃を強くできることから、免疫チェックポイント阻害薬[1]が開発されてきました。
しかし、PD-1やCTLA4による免疫チェックポイント阻害薬は一部のがんには高い治療効果を示しますが、この他の多くのがんに対しては治療効果が3割程度であり、より効果的な療法が求められています。これらに加え、別の抑制性免疫補助受容体に対する阻害薬の併用療法が世界中で進められています。LAG-3は、PD-1、CTLA-4に次ぐ第三の免疫チェックポイント分子として注目され、PD-1との併用では悪性黒色腫での生存率の向上が確認されており、期待がさらに高まっています。
しかし、LAG-3の免疫抑制のメカニズムについては、基礎的な解析はあまり進んでいませんでした。国際共同研究グループは、これまでT細胞が活性化する際に形成されるTCR-MCの制御を分子イメージングの手法を用いて解析してきましたが注1)、本研究ではLAG-3の動態の解析に挑みました。
注1)Yokosuka T. et al. Newly generated T cell receotpr microclusters initiate and sustain T cell activation by recruitment of Zap70 and SLP76. Nat. Immunol. 6:1253-62, 2005.
研究手法と成果
国際共同研究グループではまず、T細胞活性化に伴うLAG-3のT細胞上での動態を分子イメージングで調べました。MHC-ⅡおよびICAM-1[8]を組み込んだ脂質二重膜を作製しました。LAG-3-GFPを発現させたT細胞(TCRトランスジェニック、LAG-3欠損マウス由来)を作製した脂質二重膜に載せて反応させることで、抗原特異的なT細胞活性化を起こして、TCR-MCの形成とLAG-3分子の動態を解析しました(図1)。LAG-3は活性化に伴ってクラスターを形成し、TCR-MCと共局在していました。LAG-3の細胞内領域、細胞外領域などの欠損分子を作製して解析した結果、LAG-3クラスターとTCR-MCとの共局在にはLAG-3細胞外領域が、T細胞活性化(IL-2産生)の抑制には細胞内領域が必要なことが分かりました。種々のLAG-3抗体による阻害実験を行ったところ、LAG-3抗体は、LAG-3とTCR-MCとの共局在を阻害してT細胞活性化を増強しますが、LAG-3自体のクラスターは阻害しませんでした。
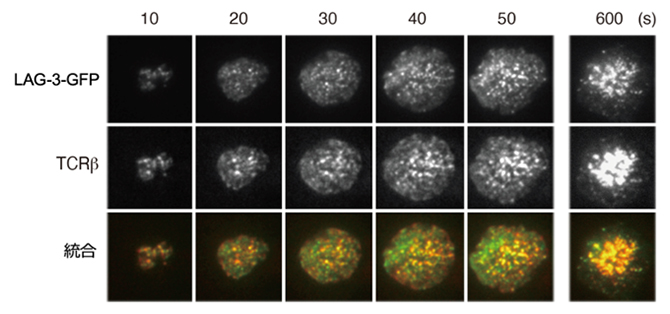
図1 T細胞活性化に伴うLAG-3クラスターとTCR-MCの共局在
上)LAG-3は活性化に伴ってクラスター(白色ドット)を作り(LAG-3クラスター)、時間とともに数が多くなった。
中)TCRβ抗体でTCR-MCの形成を確認した。時間とともにTCR-MC(白色ドット)数が増加した。
下)LAG-3クラスターとTCR-MCを重ね合わせて統合したもの。両者は共局在する。重なり合った部分は黄色に見える。
また、LAG-3抗体の多くはLAG-3とMHC-Ⅱの結合を阻止します。しかし、いくつかのLAG-3抗体(例えば図2のC9B7Wや17D8)は、MHC-Ⅱとの結合を阻害しないにもかかわらず、TCR-MCとLAG-3クラスターの共局在を阻害して、結果としてT細胞活性化を増強させました。このことから、TCR-MCとLAG-3クラスターの共局在、およびT細胞活性化増強は、LAG-3とMHC-Ⅱの結合と関係ないことが分かりました(図2)。MHC-Ⅱ結合能によらないことは、別の二つの事実からも証明されました。一つは、MHCクラスⅠに依存するCD8+キラーT細胞[3]の活性化においても、LAG-3抗体はT細胞活性化を増強させることです。もう一つは、抗CD3抗体でT細胞を活性化させる際にLAG-3抗体によってT細胞活性化の増強が起こることです。これらもMHC-Ⅱには関係ない系であることから、MHC-Ⅱ結合に関係なくLAG-3抗体がT細胞活性化を増強することが分かります。
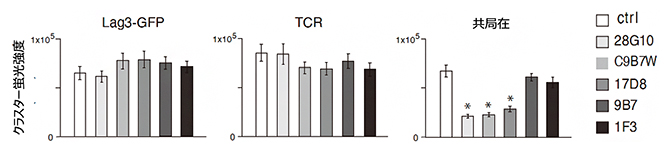
図2 LAG-3抗体によるLAG-3クラスターとTCR-MCの共局在の阻害
C9B7W、17D8は、LAG-3とMHC-Ⅱとの結合を阻害しないにもかかわらず、TCR-MCとLAG-3クラスターの共局在を阻害し、T細胞活性化を増強する。
私たちは以前、PD-1によるT細胞活性化抑制とPD-1抗体による抑制の解除を解析しました。LAG-3と同様にPD-1はクラスターを形成してTCR-MCと共局在し、PD-1抗体はPD-1クラスターの共局在活性化の抑制を阻害してT細胞活性化の増強を誘導しました注2)。
そこで、LAG-3抗体とPD-1抗体の両方およびバイスペシフィック抗体[9]の阻害活性を解析しました(図3)。LAG-3抗体とPD-1抗体はLAG-3、PD-1のぞれぞれのクラスターの共局在を阻害し、両者の抗体があるとTCR-MCとの共局在はなくなり、それぞれの抗体だけよりもより強くT細胞の活性化が増強されることが分かりました。
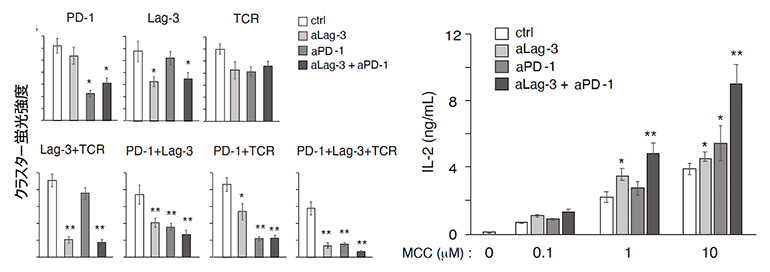
図3 LAG-3抗体とPD-1抗体によるT細胞抑制の再活性化
LAG-3抗体とPD-1抗体の両者によってクラスター共局在が阻害され(左)、T細胞活性化がより強く誘導された(右)
LAG-3とPD-1の抗体を共に有するバイスペシフィック抗体およびバイスペシフィックVHH抗体[10]を作り、抑制活性を調べると、二つの抗体を加えた場合と同様に、TCR-MCとLAG-3クラスターの共局在は阻害され、T細胞活性化は増強されました。また、生体内で治療する場合と同様に、T細胞が活性化されてから90秒のタイミングで、免疫チェックポイント阻害剤であるこれらの抗体を加えると、クラスターの共局在が阻害され、T細胞の活性化を増強させました。これらの結果から、バイスペシフィック抗体やVHH抗体などの新しい製剤を用いることで、T細胞の活性化をさらに増強させることができることを示しました。
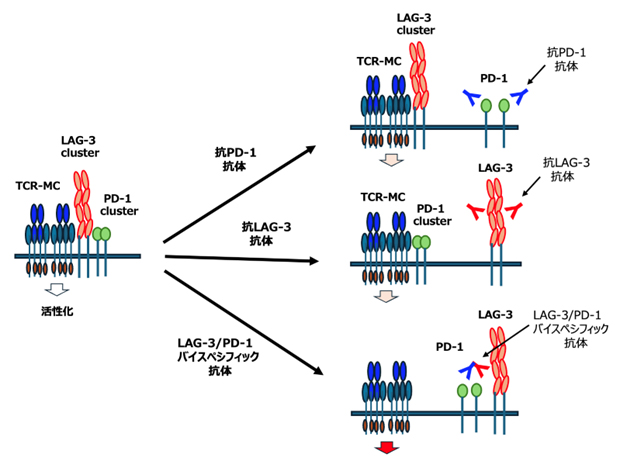
図4 TCR-MCに会合するPD-1・LAG-3クラスター
T細胞活性化に伴って、TCR-MCが形成され活性化シグナルの伝達を担うが、そこにPD-1クラスターもLAG-3クラスターも集まり抑制機能を果たす。免疫チェックポイント阻害剤(抗PD-1抗体、抗LAG-3抗体)を加えると、それぞれの対応するクラスターはTCR-MCから離れて、抑制機能を失う。PD-1+LAG-3抗体、あるいはバイスペシフィック抗体を加えると、両者をTCR-MCから切り離し、より強い活性化を誘導する。
注2)Yokosuka T. et al. Programmed cell death 1 forms negative costimulatory microclusters that directly inhibit T cell receptor signaling by recruiting phosphatase SHP2. J.Exp.Med.,209:1201-17, 2012
今後の期待
本研究では、LAG-3分子の動態を詳細に解析することによって、TCR-MCとLAG-3による活性化抑制との関係を解明し、TCR-MCとLAG-3クラスターとの会合こそが制御の鍵を担う標的であることを突き止めました。
つまり、免疫チェックポイント阻害の標的が、LAG-3などの分子そのものやMHC-Ⅱなどではなく、TCR-MCとLAG-3クラスターとの会合の阻害であることが明白になりました。今後の免疫チェックポイント製剤の開発も、この会合を阻止する活性に着目して進めれば、さらに第四、第五の免疫チェックポイント分子の発見・適用についても発展させることができ、がん免疫療法の発展につながると期待されます。
補足説明
1.免疫チェックポイント分子、免疫チェックポイント阻害薬
免疫チェックポイント分子とは免疫応答を制御する免疫補助受容体分子。PD-1([2]参照)、CTLA-4、LAG-3などが知られ、自己を攻撃しないため、また過剰に活性化しないためにT細胞を抑制する。このブレーキ(抑制)を解除する薬剤を新たに作り、がんを攻撃する新たな免疫療法が開発されている。免疫チェックポイント阻害薬とは、自己を攻撃しない、過剰に活性化しないためにT細胞を抑制する機構を解除する薬剤で、免疫チェックポイント阻害薬を用いた免疫療法とはがんを攻撃する新たな治療法。
2.PD-1
免疫を負に制御する抑制性補助受容体の一つで、T細胞が活性化すると発現し、リガンドであるPD-Lと会合して、T細胞活性化を抑制する。がん細胞にPD-Lが発現して、キラーT細胞のPD-1と反応して活性化を抑制して、がん免疫を抑えている。PD-1老化T細胞や慢性感染などで消耗したT細胞にも発現し、免疫不全のマーカーでもある。PD-1はProgrammed cell Death-1の略。
3.T細胞、CD8+キラーT細胞
T細胞は免疫を担うリンパ球の一種。細胞表面に発現するT細胞抗原受容体(TCR)を介して、樹状細胞などの抗原提示細胞が提示する抗原を認識し、活性化する。活性化したT細胞は、サイトカイン(細胞同士の情報伝達を行うタンパク質の総称)を分泌するヘルパー細胞(CD4を発現するCD4+ヘルパーT細胞)や、がんや感染細胞を殺すキラー細胞(CD8を発現するCD8+キラーT細胞)などのエフェクター細胞に分化する。
4.T細胞受容体(TCR)
T細胞が抗原を認識する受容体で、α鎖とβ鎖の2本鎖から成る。細胞ごとに異なるαβ鎖を発現し、αβ鎖は遺伝子再構成によって膨大な多様性を作る。T細胞表面上でCD3分子群と複合体を作って、抗原認識シグナルを伝達する。
5.TCRミクロクラスター(TCR-MC)
T細胞が抗原認識に伴ってTCR/CD3複合体が100ほど集積して、クラスターを作る。ここにシグナル伝達に重要なキナーゼやアダプター分子(タンパク質の一種)も集積して、大きなTCR-MCを形成する。
6.MHC-Ⅱ
樹状細胞などの抗原提示細胞のみに発現する主要組織適合遺伝子複合体(MHC)分子のクラスのこと。細胞内で処理された抗原ペプチドを分子内の溝に結合させて、T細胞が認識をするように提示し、免疫応答を開始する上で重要な役割を果たす。MHC-ⅡはMajor Histocompatibility Complex Class Ⅱの略。
7.免疫補助受容体
TCRが抗原・MHCを認識して活性化シグナルを伝えるが、そのT細胞活性化シグナルを正・負に制御する分子群。正の受容体にはCD28、ICOSなど、負の受容体には、CTLA-4、PD-1、LAG-3などがある。
8.ICAM-1
免疫グロブリンスーパーファミリーに属する接着分子。CD54とも呼ばれる。リンパ球、内皮細胞など多くの細胞に恒常的に発現している。ICAM-1は、リンパ球に発現する細胞接着分子LFA-1(リンパ球機能関連抗原1)と結合し、炎症や免疫応答での細胞間相互作用に重要な役割を果たす。ICAM-1はInterCellular Adhesion Molecule 1の略。
9.バイスペシフィック抗体
2種類の異なる抗原特異性を持つ二つの抗体の可変領域を一つの定常領域に結合させた抗体。例えば、一方のアームががん抗原に結合し、もう一方のアームがT細胞表面のCD3抗原に結合して、キラーT細胞を活性化させてT細胞をがん細胞に引き寄せて傷害させることができる。
10.VHH抗体
アルパカなどのラクダ科動物の血中に見られる特殊な重鎖の可変領域を利用した低分子量の天然のシングルドメイン抗体。VHHはVariable domain of Heavy chain of Heavy chainの略。
国際共同研究グループ
理化学研究所 生命医科学研究センター
免疫シグナル研究チーム(研究当時)
チームリーダー(研究当時)齊藤 隆(サイトウ・タカシ)
(現 免疫器官形成研究チーム 客員主管研究員、現 創薬抗体基盤ユニット 客員主管研究員)
上級研究員(研究当時)多根 彰子(タネ・アキコ)
テクニカルスタッフ(研究当時)佐久間 待恵(サクマ・マチエ)
(現 感染免疫研究チーム テクニカルスタッフ)
テクニカルスタッフ(研究当時)米田 奈津美(ヨネダ・ナツミ)
(現 創薬抗体基盤ユニット テクニカルスタッフ)
統合細胞システム研究チーム
チームリーダー 柚木 克之(ユギ・カツユキ)
メルク・アンド・カンパニー(米国)
エドワード バウマン(Edward P. Bowman)
ルネ ワール・マレフィット(Rene de Waal Malefyt)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費助成事業基盤研究(B)「抑制性レセプターによるT細胞機能の抑制メカニズムの解明(研究代表者:齊藤隆、18H02672)」およびメルク・アンド・カンパニーとの共同研究費による助成を受けて行われました。
原論文情報
Akiko Hashimoto-Tane, Edward P. Bowman, Machie Sakuma, Natsumi Yoneda, Katsuyuki Yugi, Rene de Waal Malefyt, Takashi Saito, “Dissociation of LAG-3 inhibitory cluster from TCR microcluster by immune checkpoint blockade”, Frontiers in Immunology, 10.3389/fimmu.2024.1444424
発表者
理化学研究所
生命医科学研究センター 免疫シグナル研究チーム(研究当時)
チームリーダー(研究当時)齊藤 隆(サイトウ・タカシ)
(現 免疫器官形成研究チーム 客員主管研究員、現 創薬抗体基盤ユニット 客員主管研究員)
報道担当
理化学研究所 広報室 報道担当