2024-11-20 東京科学大学
ポイント
- ホタルルシフェラーゼを改変し、小胞体におけるタンパク質の生合成過程の異常を感知する新しいツールを開発。
- タンパク質の輸送と折り畳みの過程での異常を鋭敏かつ簡便に検知。
- ウイルス感染を抑制する化合物の探索への応用に期待。
概要
東京科学大学(Science Tokyo)※ 総合研究院 細胞制御工学研究センターの門倉広特任准教授、田口英樹教授、大阪大学の柳谷耕太准教授、兵庫県立大学の河野憲二特任教授、九州大学の天貝佑太助教、稲葉謙次教授らのグループは、ヒト分泌タンパク質が作られる過程の異常を鋭敏かつ簡便に検出することができる新しいツールを開発することに成功しました。
分泌タンパク質は細胞の表面や細胞外に存在し、健康維持に重要な働きをしています。細胞の全タンパク質の約30%を占める分泌タンパク質が正しい立体構造に折り畳まれるためには、タンパク質が小胞体へと運ばれた後、正しい位置にジスルフィド結合が導入される必要があります。これらの過程に問題があると、分泌タンパク質は正しい立体構造に折り畳まれず、糖尿病や高脂血症などさまざまな疾患の原因になるため、この過程を理解することは重要です。
本研究では、ルシフェラーゼというホタルの酵素を利用して、そうした分泌タンパク質の生合成過程での異常を検出する鋭敏で簡便なツールの開発に成功しました。このツールでは、分泌タンパク質が小胞体へと輸送される過程と、小胞体内で分泌タンパク質にジスルフィド結合が導入される過程のいずれかに生じた異常を、ホタルルシフェラーゼの活性の変化として検出できます。
本ツールを利用することで、ヒトタンパク質が小胞体で作られる過程に関わる因子の解析や、ウイルス感染を抑制する薬の創薬の効率化が期待されます。
本研究成果は、米国Cell Pressが発行するオンライン総合誌「iScience」に11月15日付(現地時間)で正式版が掲載されました。
※ 2024年10月1日に東京医科歯科大学と東京工業大学が統合し、東京科学大学(Science Tokyo)となりました。
背景
私たちの体を形作っているタンパク質は、細胞の中だけではなく、細胞の表面や細胞の外にも存在し、私たちの生命活動を支えています。例えば、病原体の不活化に重要な抗体は、細胞の外に存在する分泌タンパク質です。一方、悪玉コレステロールを細胞内に取り込んで分解する過程に必要なLDL受容体は、細胞の表面に存在する膜タンパク質です。このような私たちの健康維持に重要な分泌タンパク質や膜タンパク質(以後、分泌タンパク質と呼ぶ)が正しい立体構造に折り畳まれ、働くためには、細胞内で作られる際に、小胞体と呼ばれる細胞内小器官に輸送された後、正しい位置にジスルフィド結合が導入されることが必要です。
ジスルフィド結合とは、タンパク質の2つのシステイン残基が酸化されて形成される分子内架橋であり、正しいシステイン間にこの結合が形成されることが分泌タンパク質の立体構造形成(機能発現)に必須です。分泌タンパク質の小胞体への輸送(局在化)や、その後のジスルフィド結合の導入がうまくいかないと、糖尿病や高脂血症などを含むさまざまな病気の原因になります。そのため、そうしたプロセスを解明することは極めて重要です。
レポーター[用語1]は、直接測定するのが困難な細胞内のさまざまな状態変化を、測定が容易な酵素などの活性変化に置き換えるツールです。このレポーターを、分泌タンパク質生合成過程の異常を迅速に検出できる簡便なツールとして利用すれば、そうした過程に関わる因子の同定や、その構造と機能の関連の解明に大きく貢献するはずです。既にそうしたレポーターは開発されていますが、それは鋭敏さや簡便さの面で十分とは言い難いものでした。
そこで本研究では、分泌タンパク質の生合成過程において重要な2つのステップ(小胞体への局在化と、その後のジスルフィド結合の導入)のいずれかに異常が生じると、それを鋭敏かつ簡便に検出できるレポーターの開発を目指しました。
研究成果
(1)レポーターの作製
ホタルルシフェラーゼはホタルの発光現象を担う酵素です。酵素活性を鋭敏かつ正確に測定するためのアッセイ系が確立しているため、さまざまなレポーターがこの酵素を基に作製されています。そこで本研究では、ホタルルシフェラーゼを改変することによって、分泌タンパク質の生合成過程(小胞体への局在化とジスルフィド結合の導入)の異常を検出するためのレポーターを作製しました(図1)。
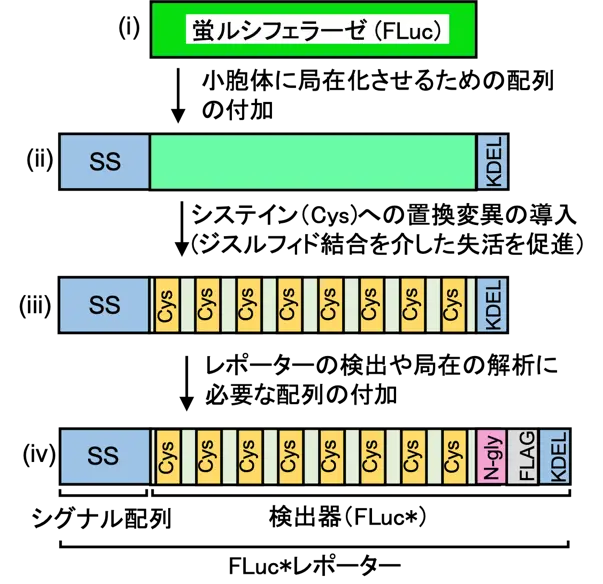 図1. レポーターの構造とその作製過程
図1. レポーターの構造とその作製過程
本レポーターは2つの部分(シグナル配列と検出器)から構成されます(図1iv)。周囲の状態変化を捉える検出器(FLuc*)では、ホタルルシフェラーゼ(FLuc)のアミノ酸配列に多数のシステイン置換(システイン以外のアミノ酸をシステインに置き換えたもの)を導入しています。ここにシステイン置換を導入するのは、ジスルフィド結合の形成によるルシフェラーゼの失活を促進するためです(研究成果(2)に詳述)。なお、検出器部分をタンパク質合成の場であるサイトゾルに作らせた場合には、ルシフェラーゼの活性に影響がない位置に変異を導入しています(図2B)。さらに、この検出器を小胞体へと移動させるために、検出器にシグナル配列(SS)を連結しています(図1iv)。
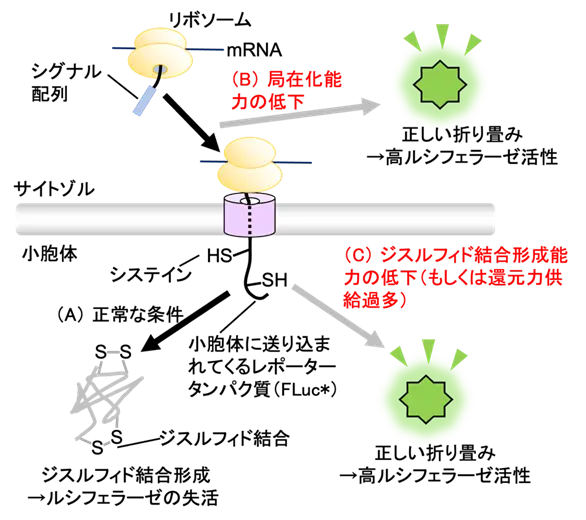 図2. 本レポーターの作動原理
図2. 本レポーターの作動原理
(2)レポーターの作動原理
次に、この最終的に得られたレポーター(FLuc*レポーター)の作動原理を説明します。検出器に付与したシグナル配列は、タンパク質の輸送先を決める配列の一種であり、この配列を付与されたタンパク質は小胞体内へ送り込まれます。よって、正常細胞で本レポーターを発現させると、シグナル配列の働きによって検出器(FLuc*)が小胞体内へと移動します(図2)。サイトゾルが還元的であるのとは対照的に、小胞体内は酸化的であり、分泌タンパク質中の2つのシステイン残基を酸化して、ジスルフィド結合へと変える酵素が多数存在しています。
正常な条件下では、そうした酵素の働きによって、検出器上に導入したシステイン間にジスルフィド結合が導入されるため、ルシフェラーゼは天然型の立体構造を形成できずに失活すると予想されます(図2A)。一方、小胞体への分泌タンパク質の局在化が阻害される条件下(図2B)や、小胞体内におけるジスルフィド結合形成能力が低下する条件下(図2C)では、検出器にジスルフィド結合が導入されないため、ルシフェラーゼは正しく折り畳まれ、活性型の酵素の量が上昇すると期待されます。
実際に実験で、FLuc*レポーターを発現するヒト由来の培養細胞株で、分泌タンパク質の小胞体へ局在化や、ジスルフィド結合形成に関わる既知の因子の働きを抑制したところ、活性型のルシフェラーゼの量が顕著に上昇しました。このような解析結果から、本レポーターは分泌タンパク質の生合成過程の異常を極めて鋭敏に検出できることが分かりました。
(3)小胞体膜タンパク質の機能解析
次にこのレポーターを、まだ十分に解明されていない小胞体膜タンパク質の機能の解析に利用しました。小胞体内で、間違った組み合わせのシステイン間に形成されたジスルフィド結合を正しい組み合わせに修復するには、ジスルフィド結合をいったん切断しなければならず、そのための還元力が必要になります。最近の研究で、間違った組み合わせのジスルフィド結合が形成されやすい分泌タンパク質が存在することが明らかになり、その立体構造形成に関与するLMF1には、間違ったジスルフィド結合の切断・修復に必要な電子を小胞体に輸送する機能があると考えられています。
実験では、 FLuc*レポーターを発現する細胞において、このLMF1の発現量を増大させたところ、活性型ルシフェラーゼの量が10倍以上に上昇しました。これは、LMF1が小胞体内に輸送した電子をFLuc*が受け取ったことで、ジスルフィド結合がその電子によって切断され、FLuc*が正しく折り畳まれたためと考えられます。一方で、LMF1の発現量を抑制すると、活性型ルシフェラーゼの量が半減しました。この実験から、LMF1が小胞体内へ還元力のある電子を供給することで、小胞体内の酸化還元状態の制御に重要な役割を果たすことが確認できました。
(4)ヒト免疫不全ウイルス増殖阻害剤の作用の検出
さらに本研究では、創薬を念頭に、薬剤作用の検出にFLuc*レポーターが利用できるかどうかを検討する実験を行いました。ヒト白血球の表面で発現している膜タンパク質CD4は、ヒト免疫不全ウイルスが白血球に感染する際のレセプターとして利用されています。ヒト免疫不全ウイルス増殖阻害剤CADAは、このCD4のシグナル配列に特異的に結合し、CD4の小胞体への局在化を阻害する(つまり白血球上のウイルスレセプターの生合成を阻害する)ことにより、感染を抑制します。
実験では、CD4のシグナル配列の下流にFLuc*を連結したレポーターを作製し、ヒト由来の培養細胞中で発現させました。その結果、CADAの投与によって、FLuc*の小胞体へ局在化が阻害されるとともに、活性型ルシフェラーゼの量が有意に上昇しました。この結果から、本レポーターは、ヒト免疫不全ウイルス増殖阻害剤の作用を検出するための鋭敏なツールとして機能することが判明しました。
社会的インパクト
本レポーターは基礎研究だけでなく、がんの治療薬などの創薬にも貢献する可能性があります。ヒト細胞の表面に存在するタンパク質の中には、Prx4(肺がん)、IL6R(自己免疫疾患)、PD-1(がんに対する免疫寛容)のような、疾患の原因になるものが存在します。これらのタンパク質も、自身のシグナル配列に依存して小胞体へ輸送され、そこで正しく折り畳まれることで機能を発揮します。この過程に関与するシグナル配列はタンパク質ごとに異なるため、その配列に特異的な阻害剤は、標的タンパク質の生合成を抑制する治療薬となりえます。そうしたシグナル配列をFLuc*に連結したタンパク質を作製すれば、疾患の原因となるタンパク質の生合成を阻害する低分子化合物を効率よく探索でき、治療薬の創薬につながると期待されます。
今後の展開
分子内にジスルフィド結合を持つ分泌タンパク質は、ヒト全タンパク質の30%を占めることから、その小胞体での生合成の過程を知ることは重要です。しかし、本研究で扱ったLMF1の分子機能も含めて、分泌タンパク質の生合成の具体的な仕組みには不明な点が多くあります。本研究によって、FLuc*レポーターは、分泌タンパク質生合成の2つの重要なステップ(小胞体への局在化とジスルフィド結合の導入)における異常を鋭敏に検出できることが判明しました。今後は本レポーターを有用なツールとして利用して、ヒト分泌タンパク質の生合成過程の詳細な解析を進めていく予定です。
付記
本研究は、文部科学省科学研究費助成事業(門倉広:JP22H02253、JP20K21262、河野憲二:17H01468)、日本応用酵素協会 酵素研究助成金(門倉広)、武田財団(河野憲二)、大隅基礎科学創成財団(河野憲二)、革新的先端研究開発支援事業(田口英樹: JP21gm1410008、稲葉謙次:21gm1410006h0001)などの支援を受けて行われました。
用語説明
[用語1] レポーター:生物学におけるレポーターとは、特定の遺伝子発現や細胞内の状態変化(その多くは直接測定するのが困難)を測定が容易な酵素など(βガラクトシダーゼ、ルシフェラーゼ、GFPなど)の活性変化に置き換える。よって、レポーターを利用すると細胞の中の特定の遺伝子発現や状態変化を迅速かつ簡便に知ることができる。
論文情報
掲載誌:iScience
論文タイトル:Development of luciferase-based highly sensitive reporters that detect ER-associated protein biogenesis abnormalities
(和訳:小胞体におけるタンパク質の生合成異常を鋭敏かつ簡便に検出するための、ルシフェラーゼ型レポーターの創出)
著者:Hiroshi Kadokura, Nanshi Harada, Satoshi Yamaki, Naoya Hirai, Ryusuke Tsukuda, Kota Azuma, Yuta Amagai, Daisuke Nakamura, Kota Yanagitani, Hideki Taguchi, Kenji Kohno, and Kenji Inaba
DOI:10.1016/j.isci.2024.111189
お問い合わせ
東京科学大学 総合研究院 細胞制御工学研究センター
特任准教授 門倉 広
東京科学大学 総合研究院 細胞制御工学研究センター
教授 田口 英樹