2024-12-24 理化学研究所
理化学研究所(理研)脳神経科学研究センター 神経老化制御研究チームの綿村 直人 研究員(研究当時、現 客員研究員)、西道 隆臣 チームリーダーらの国際共同研究グループは、神経変性疾患であるアルツハイマー病(AD)[1]や前頭側頭型認知症(FTD)[2]患者の脳の神経細胞やグリア細胞で観察される「タウ病理[3]」を、従来のモデルマウスのようにタウタンパク質を過剰発現[4]せずに症状を再現できる、次世代型「タウ病理」モデルマウスの開発に成功しました。
本研究成果は、ADやFTDの基礎・応用研究のための新たな世界標準のツールになり、予防・治療薬の開発に貢献することが期待されます。
今回、国際共同研究グループは、これまでに神経老化制御研究チームで開発されたヒト化タウノックインマウスにゲノム編集を行い、FTDで同定されているタウの発現パターンに影響を及ぼす病原性変異[5](S305NおよびIntron 10+3 G>A)を導入することで、新しいタウ病理モデルマウスの開発に成功しました。作製したモデルマウスは、タウの過剰リン酸化[6]が観察され、シナプス[7]の消失や行動異常が起こることを明らかにしました。興味深いことに、毒性が強いと考えられている凝集したタウは検出できないことから、タウの発現パターン異常に基づくFTDの初期病態の一つは、タウの過剰リン酸化が関与していることが明らかとなりました。
本研究は、科学雑誌『Nature Neuroscience』オンライン版(12月24日付:日本時間12月24日)に掲載されました。
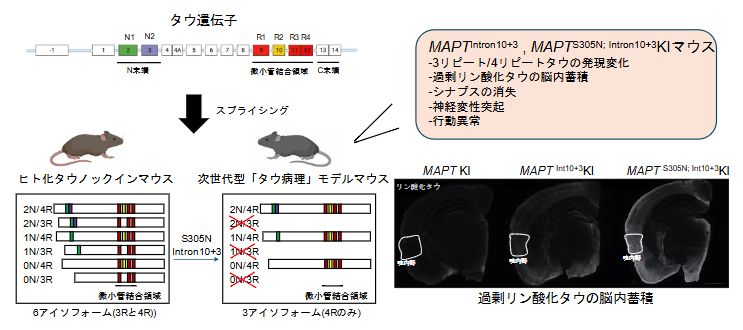
次世代型タウ病理モデルマウスの作製および解析
背景
アルツハイマー病(AD)や前頭側頭型認知症(FTD)などのいくつかの神経変性疾患では、タウタンパク質の凝集体が神経細胞およびグリア細胞に蓄積します。疾患研究において、細胞および個体(実験動物)がどれほど、その患者に近い症状を示すかが、その研究成果の解釈に直結します。そのため、疾患モデルの開発は各研究分野でも非常に重要な要素であり、確立されたモデル系は疾患の発症メカニズム解明から創薬研究まで多岐にわたり使用されます。
これまでのタウ病理の研究では、家族性FTDで同定された病原性変異を含むタウ遺伝子を過剰発現させたモデルマウスが、幅広く使用されてきました。しかしながら、これらのマウスは過剰発現によるアーティファクト[8]を含む可能性があり、病態を正確に把握することは困難でした。そこで、国際共同研究グループはまず、相同的組換え(塩基配列の相同性に依存して行われるDNAの組換え反応)を用いてマウスタウ遺伝子をヒトタウ遺伝子に置換した、ヒトタウノックイン(MAPT KI)マウスを作製しました。このマウスはヒトで見られる六つのアイソフォーム(アミノ酸配列が異なる類似したタンパク質)のタウが発現し、その局在はマウスのタウと同等であることが確かめられました。また、認知機能や不安様行動は野生型マウスとほぼ同等であることから、タウ遺伝子のヒト化は脳高次機能に影響を与えないことが示唆されました注1、2)。本研究では、このMAPT KIマウスを基に、FTDで同定された病原性変異をMAPT遺伝子上に導入することで、次世代型タウ病理モデルマウスの作製を目指しました。
注1)2019年6月4日プレスリリース「アルツハイマー病の悪性化に関わるタンパク質の発見」
注2)Saito et al., Humanization of the entire murine Mapt gene provides a murine model of pathological human tau propagation. J Biol Chem(2019)
研究手法と成果
研究手法は、CRISPR/Cas9[9]の改変型であり、より容易に点変異導入を可能にした”塩基編集技術(BE)[9]“を利用しました。次に、標的となるDNAまでの案内役となるガイドRNA(single guide RNA:sgRNA)の探索を行い、MAPT KIマウスから得られた受精卵にBEツールと設計したsgRNAを注入しました。その結果、単一および複数種類の病原性変異がMAPT遺伝子上に導入された変異MAPT KIマウス(次世代型タウ病理モデルマウス)を獲得しました。
本研究では、タウの発現パターンに影響を与える変異を持つマウス(MAPTInt10+3 KIとMAPTS305N; Int10+3 KIマウス)の表現型を調べました。これらの病原性変異の効果としては、翻訳される配列の一つ「exon 10」のスプライシング(ゲノム上の遺伝子をmRNAに転写する過程の一つ)に影響を与え、3リピート(R)タウ[10]と4Rタウ[10]の比率3R/4Rを変化させることが細胞を用いた実験で明らかにされていました。従って、作製したMAPTInt10+3 KIとMAPTS305N; Int10+3 KIマウスにおいて3R/4Rタウの発現比率をリアルタイムPCR(ポリメラーゼ連鎖反応検査)やウエスタンブロット(タンパク質解析法)を用いて調べました。その結果、作製したマウスにおいて、4Rタウの発現がコントロールのマウスに比べ上昇し、3Rタウの発現が低下しました(図1A)。
次に、病理学的特徴の一つであるリン酸化を調べるために、ウエスタンブロットやリン酸化プロテオーム解析(タンパク質の種類と量の網羅的な解析)を行った結果、MAPTInt10+3 KIとMAPTS305N; Int10+3 KIマウスはタウのリン酸化レベルの有意な上昇が明らかになりました。リン酸化タウ特異的抗体(AT8)を用いた免疫染色では、脳内で認知機構をつかさどる嗅内野(きゅうないや)の神経細胞において、特に強い陽性シグナルが観察されました(図1B)。リン酸化タウの毒性を調べるために、シナプスの密度を観測したところ、MAPTS305N; Int10+3 KIマウスにおいて有意に減少していることが分かりました(図1C)。
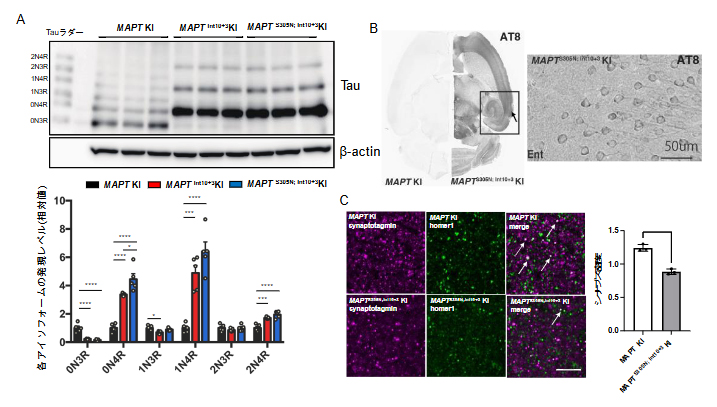
図1 次世代型タウ病理モデルマウスの表現型
A:ウエスタンブロット法によるタウアイソフォームの発現パターンの比較。次世代型タウ病理モデルマウスでは、タウの発現パターンが異なる。
B:次世代型タウ病理モデルマウスのリン酸化タウ抗体(AT8)を用いた免疫染色。リン酸化タウの脳内蓄積が観察される。右図は黒矢印部位(嗅内野)の拡大図。
C:次世代型タウ病理モデルマウスのシナプスマーカー(Synaptotagmin、Homer1)を用いた免疫染色。次世代型タウ病理モデルマウスでは、シナプスの密度(共局在のシグナル(白矢印))が減少している。スケールバーは5マイクロメートル(μm、1μmは100万分の1メートル)を示す。
続いて、脳高次機能を調べるために、古典的手法およびインテリケージ[11]を用いて、行動解析を行いました。その結果、次世代型タウ病理モデルマウスに記憶障害が観察されました(図2)。また、異常な常同行動(同じことを繰り返す行動)やモチベーションの低下も観察され、これらの結果はFTD患者で見られる臨床的特徴と部分的に一致していることが分かりました。
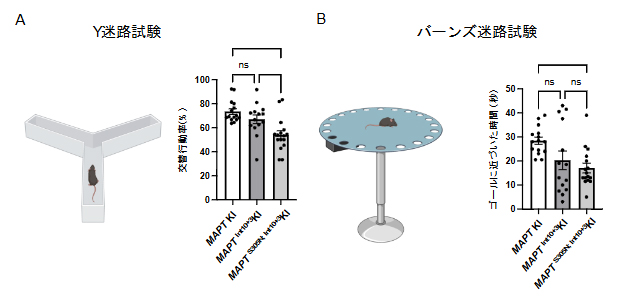
図2 次世代型タウ病理モデルマウスの行動学的特徴
A:次世代型タウ病理モデルマウスを用いた、Y迷路試験。作製したマウスでは短期記憶(ワーキングメモリー)の障害が認められる。nsはnot significant(有意差なし)を示す。
B:次世代型タウ病理モデルマウスを用いた、バーンズ迷路試験(空間学習と記憶を評価するための手法)。作製したマウスでは長期記憶の障害が認められる。
今後の期待
これまでに、過剰発現でタウ病理を再現するモデルマウスは、タウ病理の研究を着実に発展させてきましたが、過剰発現特有の問題があり、新しいモデル動物の開発が望まれていました。本研究成果である次世代型のタウ病理モデルマウスは、それらの問題点を克服し、既存のモデルマウスに替わる世界標準となる可能性があります。これまでに未解明であったタウ病理の発症メカニズムの解明から、予防および治療のための創薬や診断法の開発など臨床分野でも幅広く使用される研究ツールやリソース基盤になることが期待されます。
今後は、作製したモデル動物を基軸に、タウ病理の病態解明を目指すとともに、アミロイド病理[12]との関連についても研究を進めていきます。また、タウの遺伝子上には、複数の病原性変異が同定されているため、今回着目した病原性変異(S305NおよびIntron 10+3 G>A)以外の変異を含むモデル動物の開発にも取り組んでいきます。
補足説明
1.アルツハイマー病(AD)
ドイツの精神科医、アルツハイマー博士により1905年に報告された進行性の記憶障害を伴う認知症。主に中高年で発症し、徐々に進行して生活に支障を来すようになり、最終的には意思疎通ができなくなる。日本を含む先進国では、高齢期発症の認知症のうちで最も多いタイプの疾患となっている。ADはAlzheimer’s Diseaseの略。
2.前頭側頭型認知症(FTD)
認知症の一つ。脳の一部である、前頭葉と側頭葉前方の萎縮が見られる。前頭葉は「人格・社会性・言語」、側頭葉は「記憶」をつかさどっているため、発症すると、同じことを繰り返す行動(常同行動)や抑制が効かなくなる症状が現れることがある。FTDはFrontotemporal Dementiaの略。
3.タウ病理
アルツハイマー病や前頭側頭型認知症の病理学的特徴の一つで、タウタンパク質が脳内の神経細胞やグリア細胞内で凝集し、蓄積する。タウ病理が観察される疾患をタウオパチーという。
4.過剰発現
従来のタウ病理モデルマウスを作製する際に、使用されてきた方法。遺伝子やタンパク質を通常より多く発現させ、その機能を調べる。今回はこの手法とは異なり、過剰発現せずにタウ病理モデルマウス(次世代型)を作製している。
5.病原性変異
通常無害な遺伝子やタンパク質がある特有の変異を持つことで、毒性を発揮すること。
6.リン酸化
タンパク質が生成された後に、そのタンパク質へ付加される翻訳後修飾の一つ。タウの過剰リン酸化は、特にアルツハイマー病や前頭側頭型認知症の患者脳で顕著に観察され、病理学的特徴の一つと捉えられている。
7.シナプス
神経細胞の一部位で、神経細胞同士が連絡を取り合うために発達した構造。
8.アーティファクト
人工的に得られた結果。今回の場合は、タウを過剰発現することで、非生理的条件下で得られた産物。
9.CRISPR/Cas9、塩基編集技術(BE)
CRISPR/Cas9はゲノム編集技術の一つで、標的ゲノム領域を認識する配列とCas9と複合体を形成する配列から成るガイドRNA(gRNA)およびヌクレアーゼ活性によりDNAを切断するCas9タンパク質から成る。これらを細胞や受精卵に導入すると、複合体を形成して標的ゲノムを切断する。細胞がこれを修復する際の複製エラーにより、ゲノムに欠失や挿入が起きる。また、切断部位に相同組換えなどにより外来遺伝子をノックインできる。塩基編集技術(BE)はCRISPR/Cas9が基になっており、ゲノムDNAを異なる塩基に置換することができる。BEはBase Editorの略。
10.3リピート(R)タウ、4Rタウ
タウの微小管結合部位が三つのものを3リピートタウ、四つのものを4リピートタウと呼ぶ。
11.インテリケージ
集団型全自動行動解析装置。自然環境下でマウスの行動を詳細に解析できるため、近年注目されている。
12.アミロイド病理
アルツハイマー病患者の脳に出現するアミロイドβペプチドの凝集体であり、アルツハイマー病発症に関与する重要な病理学的特徴の一つと考えられている。
国際共同研究グループ
理化学研究所 脳神経科学研究センター
神経老化制御研究チーム
研究員(研究当時)綿村 直人(ワタムラ・ナオト)
(現 客員研究員、ユニバーシティ・カレッジ・ロンドン(英国)認知症研究所 研究員)
テクニカルスタッフⅠ 釜野 直子(カマノ・ナオコ)
テクニカルスタッフⅠ(研究当時)髙橋 美華(タカハシ・ミカ)
(現 脳発達病態研究チーム テクニカルスタッフⅠ)
チームリーダー 西道 隆臣(サイドウ・タカオミ)
認知症病態連携研究ユニット
ユニットリーダー 笹栗 弘貴(ササグリ・ヒロキ)
ユニバーシティ・カレッジ・ロンドン(英国)
認知症研究所
教授 ダフ・カレン(Duff Karen)
研究員 フォイアニ・マーサ(Foiani Martha)
研究員 ボルデンクス・マチュー(Bourdenx Mathieu)
研究員 ハビアー・ルエダ-カラスコ(Javier Rueda-Carrasco)
研究員 カツオウリ・ルキア(Katsouri Loukia)
研究員 フォウラー・ステファニー(Fowler Stephanie)
博士研究生 ベッツ・スミ(Bez Sumi)
博士研究生 パテル・サイシャ(Patel Saisha)
博士研究生 タルケス・エミル(Turkes Emir)
クイーンスクエアー神経病理研究所
准教授 サイフル・イスラム(AFM Saiful Islam)
ケンブリッジ大学(英国)
教授 ベンデルスコロ・マイケル(Vendruscolo Michele)
博士研究生 サンタンブロギオ・アレシア(Santambrogio Alessia)
ヨーテボリ大学(スウェーデン)
教授 ゼッターバーグ・ヘンリク(Zetterberg Henrik)
研究員 カンポレシ・エレナ(Camporesi Elena)
研究員 ブリンクマ・グナー(Brinkmalm Gunnar)
滋賀医科大学 創発的研究センター
特任准教授 橋本 翔子(ハシモト・ショウコ)
名古屋市立大学 大学院医学研究科
教授 齊藤 貴志(サイトウ・タカシ)
国立環境研究所 環境リスク・健康領域
主任研究員 ベナー 聖子(ベナー・セイコ)
フェノバンス合同会社
代表 遠藤 俊裕(エンドウ・トシヒロ)
粟津神経サナトリウム
医師 小林 克治(コバヤシ・カツジ)
医王病院
病院長 石田 千穂(イシダ・チホ)
東京科学大学 脳神経病態学分野
特命教授 山田 正仁(ヤマダ・マサヒト)
(金沢大学 名誉教授、九段坂病院 院長)
研究支援
本研究は、理化学研究所Agingプロジェクト、日本医療研究開発機構(AMED)「革新的技術による脳機能ネットワークの全容解明プロジェクト(プロジェクトリーダー:宮脇敦史、岡野栄之)」、日本学術振興会(JSPS)海外特別研究員制度「次世代型マウスモデルを用いた時空間的一細胞解析によるタウオパチー発症機構の解明(綿村直人)」による助成を受けて行われました。
原論文情報
Naoto Watamura, Martha S. Foiani, Sumi Bez, Mathieu Bourdenx, Alessia Santambrogio, Claire Frodsham, Elena Camporesi, Gunnar Brinkmalm, Henrik Zetterberg, Saisha Patel, Naoko Kamano, Mika Takahashi, Javier Rueda-Carrasco, Loukia Katsouri, Stephanie Fowler, Emir Turkes, Shoko Hashimoto, Hiroki Sasaguri, Takashi Saito, AFM Saiful Islam, Seico Benner, Toshihiro Endo, Katsuji Kobayashi, Chiho Ishida, Michele Vendruscolo, Masahito Yamada, Karen E. Duff and Takaomi C. Saido., “In vivo hyperphosphorylation of tau is associated with synaptic loss and behavioral abnormalities in the absence of tau seeds”, Nature Neuroscience, 10.1038/s41593-024-01829-7
発表者
理化学研究所
脳神経科学研究センター 神経老化制御研究チーム
研究員(研究当時)綿村 直人(ワタムラ・ナオト)
(現 客員研究員)
チームリーダー 西道 隆臣(サイドウ・タカオミ)
報道担当
理化学研究所 広報室 報道担当

