筋萎縮性側索硬化症などの神経変性疾患におけるタンパク質凝集の従来のモデルを覆す研究成果 Study challenges conventional model of protein aggregation in neurodegenerative disease such as amyotrophic lateral sclerosis
2022-06-01 ペンシルベニア州立大学(PennState)
 Penn State College of Medicine researchers studied whether toxic trimers of the protein SOD1 are an intermediate step in the formation of large insoluble aggregates, or whether the trimers form separately off pathway. Their latest study shows toxic trimers form off pathway from large insoluble aggregates formation. Credit: Penn State College of Medicine. All Rights Reserved.
Penn State College of Medicine researchers studied whether toxic trimers of the protein SOD1 are an intermediate step in the formation of large insoluble aggregates, or whether the trimers form separately off pathway. Their latest study shows toxic trimers form off pathway from large insoluble aggregates formation. Credit: Penn State College of Medicine. All Rights Reserved.
・ペンシルベニア州立大学の研究者らによる新しい研究で、ALSの病態に関与するタンパク質の「変異型」複合体が別々の経路で形成されることが明らかになった。この発見により、薬剤開発者がより有害な変異型を標的とする治療法を設計することが容易になるかもしれない。
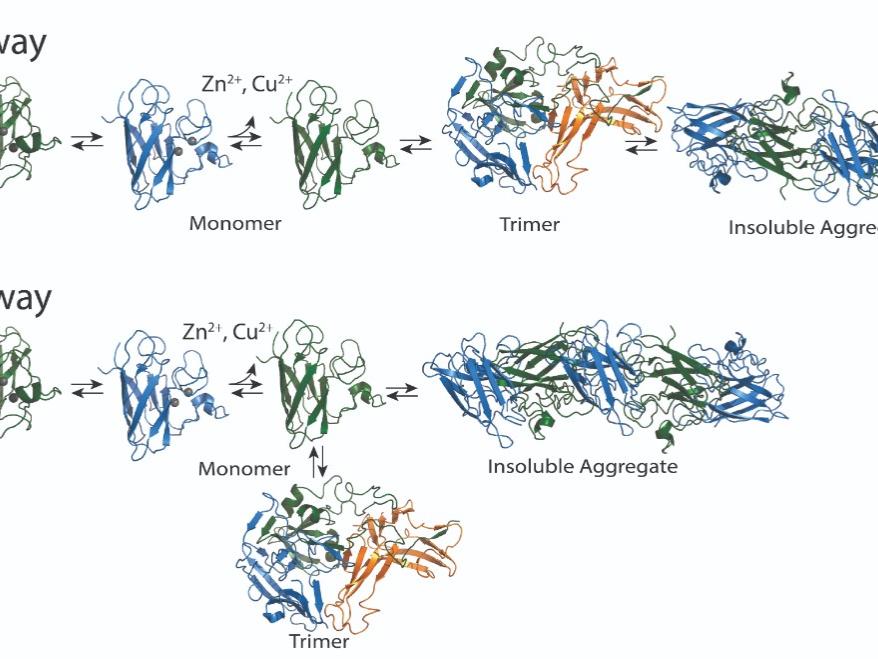
・スーパーオキシドジスムターゼ(SOD1)は、ALSの発症や進行に関与する凝集性タンパク質であるが、どのような生物学的メカニズムでこの凝集が起こるのかは不明である。このタンパク質の変異は、家族性ALSの15~30%、自然発症のALSの1~2%に関与していると言われています。通常、SOD1は2つの部分からなる二量体を形成しているが、銅や亜鉛のイオンが失われると、2つの単量体(ユニット)に分離されることがある。単量体は3つの部分からなる3量体を形成したり、多くのSOD1単量体からなる大きなフィブリルに凝集したりすることがある。
・ペンシルベニア州立大学医学部薬学科のニコライ・ドホリアン教授と同大学院医工学研究科のブリアンナ・ホナート教授は、今回の研究により、3量体がより大きな凝集体とは別の、競合する経路で発達することを突き止めました。
<関連情報>
- https://www.psu.edu/news/research/story/toxic-protein-variant-may-be-next-target-als-therapies/
- https://www.sciencedirect.com/science/article/abs/pii/S0006349522003654
ALSのアミロイド様線維形成において、毒性SOD1三量体がオフパスウェイであること Toxic SOD1 trimers are off-pathway in the formation of amyloid-like fibrils in ALS
Brianna Hnath,Nikolay V.Dokholyan
Biophysical Journal Published:3 May 2022.
DOI:https://doi.org/10.1016/j.bpj.2022.04.037
Abstract
Accumulation of insoluble amyloid fibrils is widely studied as a critical factor in the pathology of multiple neurodegenerative diseases, including amyotrophic lateral sclerosis (ALS), a fatal neurodegenerative disease. Misfolded Cu, Zn superoxide dismutase (SOD1) was the first protein linked to ALS, and non-native SOD1 trimeric oligomers were recently linked to cytotoxicity, while larger oligomers were protective to cells. The balance between trimers and larger aggregates in the process of SOD1 aggregation is, thus, a critical determinant of potential therapeutic approaches to treat ALS. However, it is unknown whether these trimeric oligomers are a necessary intermediate for larger aggregate formation or a distinct off-pathway species competing with fibril formation. Depending on the on- or off-pathway scenario of trimer formation, we expect drastically different therapeutic approaches. Here, we show that the toxic SOD1 trimer is an off-pathway intermediate competing with protective fibril formation. We design mutant SOD1 constructs that remain in a trimeric state (super-stable trimers) and show that stabilizing the trimeric SOD1 prevents formation of fibrils in vitro and in a motor neuron-like cell model (NSC-34). Using size exclusion chromatography, we track the aggregation kinetics of purified SOD1 and show direct competition of trimeric SOD1 with larger oligomer and fibril formation. Finally, we show the trimer is structurally independent of both larger soluble oligomers and insoluble fibrils using circular dichroism spectroscopy and limited proteolysis.


