がんが広がる仕組みを解明し、新しい治療法を開発するためのツールを提供する研究 Study gives insight into how cancer spreads and provides a tool for developing new treatments
2022-07-12 ミネソタ大学
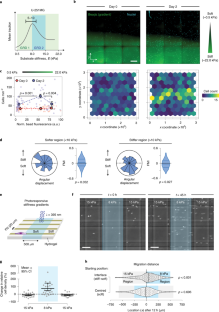
研究チームは、以前の研究で、細胞には環境の硬さ(硬いもの(骨組織)から柔らかいもの(脂肪組織)、中程度の硬さ(筋肉組織)まである)を感知する能力があり、細胞が動く能力はその環境に依存していることを発見している。この研究により、細胞には硬すぎず柔らかすぎない「スイートスポット」と呼ばれる硬さがあり、そこではより優れた牽引力を発揮し、より速く動くことができることが明らかになりました。
今回の研究では、環境の硬さが細胞の移動速度に影響を与えるだけでなく、細胞の移動方向にも影響を与えることを発見しました。
<関連情報>
- https://cse.umn.edu/college/news/research-finds-cancer-cells-can-migrate-toward-certain-sweet-spot-environments
- https://www.nature.com/articles/s41563-022-01294-2
よりソフトな環境に向けた細胞の誘導移動 Directed cell migration towards softer environments
Aleksi Isomursu,Keun-Young Park,Jay Hou,Bo Cheng,Mathilde Mathieu,Ghaidan A. Shamsan,Benjamin Fuller,Jesse Kasim,M. Mohsen Mahmoodi,Tian Jian Lu,Guy M. Genin,Feng Xu,Min Lin,Mark D. Distefano,Johanna Ivaska & David J. Odde
Nature Materials Published:11 July 2022
DOI:https://doi.org/10.1038/s41563-022-01294-2
Abstract
How cells sense tissue stiffness to guide cell migration is a fundamental question in development, fibrosis and cancer. Although durotaxis—cell migration towards increasing substrate stiffness—is well established, it remains unknown whether individual cells can migrate towards softer environments. Here, using microfabricated stiffness gradients, we describe the directed migration of U-251MG glioma cells towards less stiff regions. This ‘negative durotaxis’ does not coincide with changes in canonical mechanosensitive signalling or actomyosin contractility. Instead, as predicted by the motor–clutch-based model, migration occurs towards areas of ‘optimal stiffness’, where cells can generate maximal traction. In agreement with this model, negative durotaxis is selectively disrupted and even reversed by the partial inhibition of actomyosin contractility. Conversely, positive durotaxis can be switched to negative by lowering the optimal stiffness by the downregulation of talin—a key clutch component. Our results identify the molecular mechanism driving context-dependent positive or negative durotaxis, determined by a cell’s contractile and adhesive machinery.