病気の原因となるタンパク質プラークは、想像以上に粘着性が高いことが判明 Research reveals protein plaques associated with disease are stickier than thought
2023-01-25 ライス大学
◆Angel Martí教授の研究チームは、時間分解分光法と計算化学を用いた新しいアプローチにより、アミロイドベータ凝集体に別の結合部位があることを実験的に証明し、アルツハイマー病やアミロイド沈着を伴うその他の疾患に対する新しい治療法開発への道を開いたのです。この研究は、『Chemical Science』誌に掲載されました。
◆脳内のアミロイド斑の沈着は、アルツハイマーの主な特徴である。「と、化学、生物工学、材料科学、ナノ工学の教授であり、ライス・エマージング・スカラーズ・プログラムの教授ディレクターであるマルティ氏は言いました。「このフィブリルは、十分に成長すると、沈殿して、我々がアミロイド斑と呼ぶものを形成します。
◆マルティ研究員は、金属色素分子がアミロイド線維に形成されたポケットに結合する方法を解明し、アミロイドベータ沈着物の最初の結合部位を同定していた。この分子が蛍光を発すること、すなわち分光器で励起すると発光することが、結合部位の存在を示していたのである。
◆この2つ目の結合部位に加えて、研究室とマイアミ大学の共同研究者らは、アミロイド線維に結合しないと考えられていた複数の蛍光色素が、実際には結合することを明らかにした。
◆時間分解分光法は、色素分子の周囲の環境に敏感であるため、2つ目の結合部位の存在を推測することができたのだ。「分子が溶液中で自由であるとき、その蛍光は、この環境に起因する特定の寿命をもちます。しかし、分子がアミロイド線維に結合すると、微小環境が変化し、その結果、蛍光の寿命も変化するのです」と、彼は説明する。「アミロイド線維に結合した分子では、2つの異なる蛍光寿命が観察されました。
<関連情報>
- https://news.rice.edu/news/2023/rice-scientists-discovery-could-lead-new-alzheimers-therapies
- https://pubs.rsc.org/en/content/articlelanding/2023/SC/D2SC05418C
時間分解分光法によるアミロイドナノフィブリルの結合部位の解明 Deconvoluting binding sites in amyloid nanofibrils using time-resolved spectroscopy
Bo Jiang, Utana Umezaki, Andrea Augustine, Vindi M. Jayasinghe-Arachchige, Leonardo F. Serafim, Zhi Mei Sonia He, Kevin M. Wyss, Rajeev Prabhakar and Angel A. Martí
Chemical Science Published:19 Jan 2023
DOI:https://doi.org/10.1039/D2SC05418C
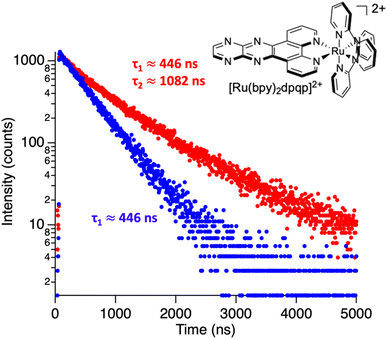
Abstract
Steady-state fluorescence spectroscopy has a central role not only for sensing applications, but also in biophysics and imaging. Light switching probes, such as ruthenium dipyridophenazine complexes, have been used to study complex systems such as DNA, RNA, and amyloid fibrils. Nonetheless, steady-state spectroscopy is limited in the kind of information it can provide. In this paper, we use time-resolved spectroscopy for studying binding interactions between amyloid-β fibrillar structures and photoluminescent ligands. Using time-resolved spectroscopy, we demonstrate that ruthenium complexes with a pyrazino phenanthroline derivative can bind to two distinct binding sites on the surface of fibrillar amyloid-β, in contrast with previous studies using steady-state photoluminescence spectroscopy, which only identified one binding site for similar compounds. The second elusive binding site is revealed when deconvoluting the signals from the time-resolved decay traces, allowing the determination of dissociation constants of 3 and 2.2 μM. Molecular dynamic simulations agree with two binding sites on the surface of amyloid-β fibrils. Time-resolved spectroscopy was also used to monitor the aggregation of amyloid-β in real-time. In addition, we show that common polypyridine complexes can bind to amyloid-β also at two different binding sites. Information on how molecules bind to amyloid proteins is important to understand their toxicity and to design potential drugs that bind and quench their deleterious effects. The additional information contained in time-resolved spectroscopy provides a powerful tool not only for studying excited state dynamics but also for sensing and revealing important information about the system including hidden binding sites.