2023-07-07 分子科学研究所
発表のポイント
• タンパク質複合体の機能を制御するメカニズムであるアロステリー(図1)を設計する新手法「進化の過程で失った機能を復活させる」を考案し、回転型分子モーターV1を対象として実証した。
• 計算機を用いたタンパク質設計により、回転型分子モーターV1が失ったATP(1)結合能を復活させて新規なアロステリーを人工的に付与し、回転速度を速くすることに世界で初めて成功した。
• アロステリーの分子機構の理解を進展させるだけでなく、工業・農業・医療分野で役立つタンパク質の創出への貢献も期待される。
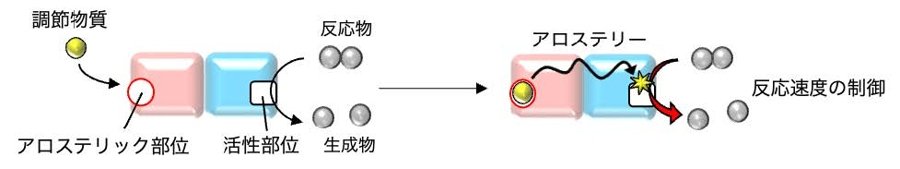
図1 タンパク質複合体の機能を制御するメカニズム、アロステリー。調節物質がアロステリック部位に結合することで構造変化が起こり、別のサブユニットにある活性部位の機能を制御します。
概要
多くのタンパク質複合体が生体内で重要な働きをしており、その複雑で協奏的な機能は、「アロステリー」と呼ばれる分子機構をもとに制御されています。新しいアロステリーをタンパク質複合体に付与することができれば、機能を自在に制御することが可能となります。この研究は、アロステリーの一般的な理解を進展させるだけでなく、工業・農業・医療への貢献も期待されます。
自然科学研究機構分子科学研究所(協奏分子システム研究センター)/生命創成探究センターの小杉貴洋助教、古賀信康教授(現所属:大阪大学・蛋白質研究所)は、同じく自然科学研究機構分子科学研究所(生命・錯体分子科学研究領域)の飯田龍也大学院生(総合研究大学院大学、現所属:理化学研究所)、飯野亮太教授らの研究チームおよび高エネルギー加速器研究機構(KEK) 物質構造科学研究所の田辺幹雄特任准教授らと共同で、計算機を使ったタンパク質設計により回転型モータータンパク質V1(V1-ATPase)に新しいアロステリック部位を設計することで、V1の回転速度を速くすることに成功しました。このようにタンパク質複合体にアロステリーを付与することができたのは世界で初めてのことです。
本研究の成果は、「Nature Chemistry」誌に2023年7月7日(金)0時(日本時間)に公開されました。
1. 研究の背景
生体内では、複数のタンパク質(サブユニット)が集まって複合体を形成し、お互いに協同しながら動作することで協奏的な機能を発揮しています。この協同性は、あるサブユニットの活性部位の機能を、異なるサブユニットに存在するアロステリック部位に調節物質が結合することにより制御するというアロステリーで実現されます(図1)。例えば、血液中のヘモグロビンの酸素への結合能は、このアロステリーで制御されていることが知られています。アロステリーは、半世紀以上も前にMonod(1965年のノーベル生理学・医学賞受賞者)らによって提唱され、現在でもタンパク質研究における重要なテーマの1つです。しかしながら、このようなアロステリーを新規に人工設計することに成功した研究例はこれまで報告されていませんでした。研究チームは、世界で初めてタンパク質複合体のサブユニット間の協奏的な機能を制御するアロステリーの設計に成功しました。
研究チームが着目したのは、進化の過程で機能を失った「擬似酵素」と呼ばれるタンパク質です。擬似酵素は、失われた活性部位の痕跡と考えられる部位、擬似活性部位を持ちます。これはヘビが進化の過程で失われたと思われる脚の痕跡を現在でも持っている、ということに似ています。近年、この擬似酵素が、タンパク質複合体を構成するサブユニットとしても存在し、その機能を制御するアロステリーと関係していることが報告されるようになってきました。研究チームは、擬似酵素の機能を復活するように改造することで、タンパク質複合体に新規アロステリーを付与できるのではないかと考え研究を行いました。
2. 研究の成果
研究チームは、タンパク質複合体の中でもATP加水分解のエネルギーを用いて回転運動を行う分子モーターV1(V1-ATPase)に着目して研究を行いました。V1は2つの異なるサブユニット(図2のピンクとシアン)が交互に3つずつ並んだリング状の構造の中心に回転子となるサブユニットを持ちます(図2)。ピンクとシアンのサブユニットの界面のうち、実線の黒四角で示された部位と点線の赤丸で示された部分は、お互いに構造がよく似ています。しかしながら、前者はATPを加水分解してV1の回転エネルギーを生み出すことができるのに対して、後者はATPを加水分解しないだけでなくATPを結合さえできず、進化の過程でATP結合能および加水分解能を失ったと考えられていました。つまり、点線の赤丸で示された部分は擬似活性部位であると考えることができます。
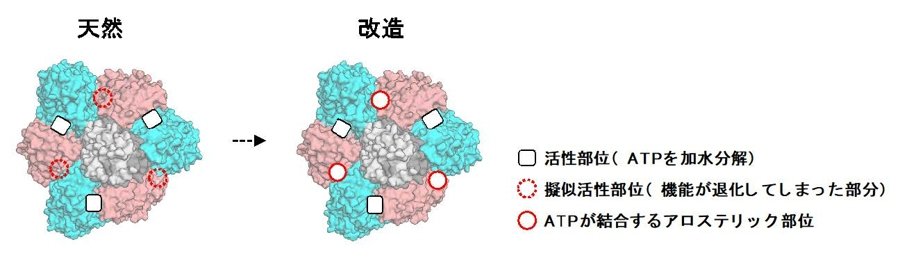
図2 回転モータータンパク質にアロステリック部位を設計。進化の過程で機能を失った擬似活性部位に、元々あった機能(A T P結合能)を復活させることで、アロステリック部位を設計しました。
研究チームは、独自の計算機を用いたタンパク質設計技術により、この擬似活性部位のATP結合能を復活させようと試みました。まず、天然のATP加水分解能を持つタンパク質に特徴的な保存されたATP結合配列(リン酸結合ループ:P-loop)に着目しました。P-loopを持つ天然のタンパク質構造を解析することで、P-loopの構造的特徴を見つけ出し、それらを基にして計算機を用いてV1の擬似活性部位にATP結合部位を設計しました(図2、図3)。続いて、設計したATP結合部位を持つ改造V1を実際に発現・精製し、タンパク質X線結晶構造解析(2)を行うことで、設計部位がATP結合能を持つことを確認しました。さらにATP結合能を復活させたV1の軸となるタンパク質に金コロイドを結合させることで標識し、1分子実験でその回転速度を計測したところ、天然のものより速くなっていることを見出しました(図4)。これは、回転分子モーターを改造することで回転を速くした初めての例です。さらに1分子実験による詳細な回転の観測とさまざまな状態で解かれた結晶構造により、この加速は、設計したATP結合部位(図2赤丸)にATPが結合することで、活性部位(図2黒四角)の機能を向上させるアロステリーにより起こっていることが判明しました。
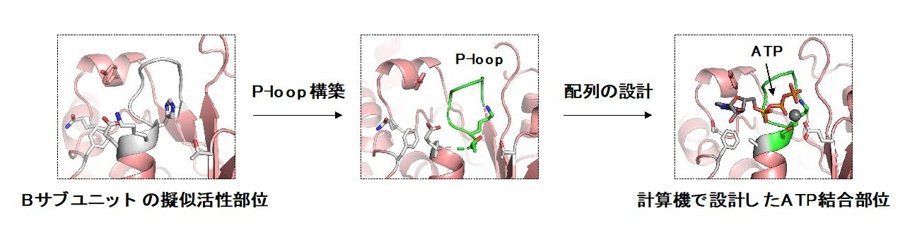
図3 計算機を用いてATP結合部位を設計。計算機を用いたタンパク質設計技術で、擬似活性部位をATP結合部位へと改造しました。ATP結合に特徴的なループ(緑)を構築し、結合部位のアミノ酸配列を設計しました。
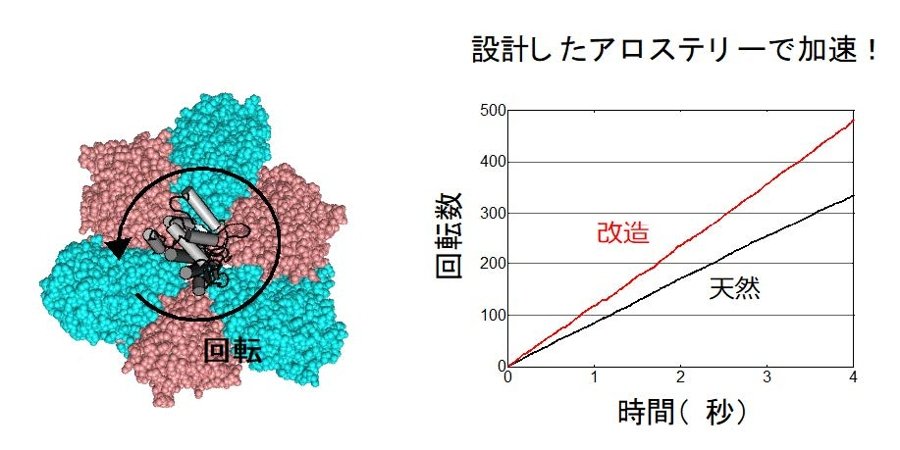
図4 改造したV1は設計したアロステリーで加速された。1分子実験で回転速度を測定すると、改造したV1は天然のものより速くなっていました。また、その加速メカニズムは、設計したアロステリーで生じていることが確認されました。
3. 今後の展開・この研究の社会的意義
自然界のタンパク質には擬似酵素が多く存在すると考えられており、例えばリン酸化酵素のうち5-10%は擬似酵素と考えられています。これらの擬似酵素の機能を復活させることで、様々なタンパク質複合体に新規のアロステリーを付与することができると考えられます。さらに、本研究では擬似酵素に元来結合していたと考えられる化合物(ATP)が結合できるよう機能を復活させましたが、タンパク質設計技術を用いて、ATPとは異なる化合物が結合できるよう改造しアロステリーを付与することで、任意の化合物による協奏的機能の制御の可能性が拓けます。タンパク質複合体に自在にアロステリーを付与することが可能になれば、アロステリーの分子機構の解明を進展させるのみならず、工業・農業・医療への貢献も期待されます。
4. 用語解説
(1) アデノシン三リン酸(ATP):生体内でリン酸が離れたり結合したりすることで、エネルギーの放出・貯蔵を行う。あらゆる生命活動に必要なエネルギーがATPを経由して供給されるため、「生体のエネルギー通貨」として知られている。
(2) X線結晶構造解析:タンパク質の立体構造を決定するための方法。精製したタンパク質を様々な条件で静置しタンパク質分子が規則的に並んだ結晶を作成する。できたタンパク質結晶にX線を照射し、結晶からの散乱の回折パターンを観察する。この散乱データを元に解析して物質の詳細な構造を決定することができる。
5. 論文情報
掲載誌:Nature Chemistry
論文タイトル:“Design of allosteric sites into rotary motor V1-ATPase by restoring lost function of pseudo-active sites”(「擬似活性部位の失われた機能を復活させることで回転分子モーターV1-ATPaseにアロステリック部位を設計する」)
著者:Takahiro Kosugi, Tatsuya Iida, Mikio Tanabe, Ryota Iino and Nobuyasu Koga
掲載日:2023年7月6日(オンライン公開、現地時間)
DOI:10.1038/s41557-023-01256-4
6. 研究グループ
本研究は、自然科学研究機構分子科学研究所(協奏分子システム研究センター)/生命創成探究センターの小杉貴洋助教、古賀信康教授の研究グループ、自然科学研究機構分子科学研究所(生命・錯体分子科学研究領域)の飯田龍也大学院生(当時)、飯野亮太教授の研究グループおよび高エネルギー加速器研究機構の田辺幹雄特任准教授の共同研究により行われました。
7. 研究サポート
本研究は、科学研究費補助金(18H05420、18H05424)、JST戦略的創造研究推進事業さきがけ(JPMJPR20E6、JPMJPR13AD)、日本医療研究開発機構(AMED)、創薬等ライフサイエンス研究支援基盤事業「創薬等ライフサイエンス研究のための相関構造解析プラットフォームによる支援と高度化 (PFにおけるタンパク質立体構造解析の支援と高度化 、相関構造解析への展開」(JP20am0101071)などの支援を受けて実施されました。また、本研究の計算には、自然科学研究機構岡崎共通研究施設計算科学研究センターのスーパーコンピューターを用いました(16-IMS-C129、17-IMS-C147、18-IMS-C155、19-IMS-C175、20-IMS-C157、21-IMS-C174、22-IMS-C188)。X線結晶構造解析の回折実験は、KEKフォトンファクトリーBL-1Aで行いました。
8. 研究に関するお問い合わせ先
小杉 貴洋(こすぎ たかひろ)
自然科学研究機構 分子科学研究所 助教
古賀 信康(こが のぶやす)
大阪大学 蛋白質研究所 教授
(兼任:自然科学研究機構 生命創成探究センター/分子科学研究所)
9. 報道担当
自然科学研究機構 分子科学研究所 研究力強化戦略室 広報担当
自然科学研究機構 生命創成探究センター 研究戦略室
高エネルギー加速器研究機構 広報室
科学技術振興機構 広報課
<JST事業に関すること>
保田 睦子(やすだ むつこ)
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ