2023-07-07 基礎生物学研究所
筋萎縮性側索硬化症(ALS)や前頭側頭型認知症(FTD)は難治性の神経変性疾患であり、これらの疾患ではFUSやTDP-43といった原因タンパク質がRNA顆粒に集積して凝集化することが知られています。しかし、この集積が引き起こすRNA顆粒や神経機能の異常については多くが未解明でした。基礎生物学研究所/生命創成探究センターの堀尾朋世大学院生(総合研究大学院大学)と椎名伸之准教授の研究グループは、FUSやTDP-43の集積がRNA顆粒からRNG105(caprin1)を解離させ、RNA顆粒の機能低下とシナプスの損失を引き起こすことを明らかにしました。
RNA顆粒は神経細胞内でmRNAをシナプスの近くに輸送し、シナプス入力に応じた局所的な翻訳を制御します。この制御はシナプスの形成・増強、そして学習・記憶に必要です。FUSやTDP-43は通常、細胞核内でmRNAの代謝に関与していますが、上記の疾患では細胞質に移行し、RNA顆粒に集積します。研究グループはマウス脳由来の神経細胞での実験により、FUSやTDP-43の集積がRNG105のダイナミクスを上昇させ、顆粒から解離させることを見出しました。これにより、RNA顆粒へのmRNAの取り込みが減少し、顆粒周辺での局所的な翻訳が低下し、さらにシナプスの形成・増強が低下することが示されました。RNA顆粒から解離しない改変型RNG105の導入により、これらの異常が抑制されたことから、FUSやTDP-43によるRNG105の解離がこれらの異常の一因であると考えられました。従来の仮説では、FUSやTDP-43の集積がRNA顆粒内の分子を凝集化させると考えられてきましたが、本研究はそれとは異なり、RNG105の解離が病態と関連することを示唆しました。
この研究成果は、2023年6月7日に国際学術誌「Heliyon」にオンライン公開されました。
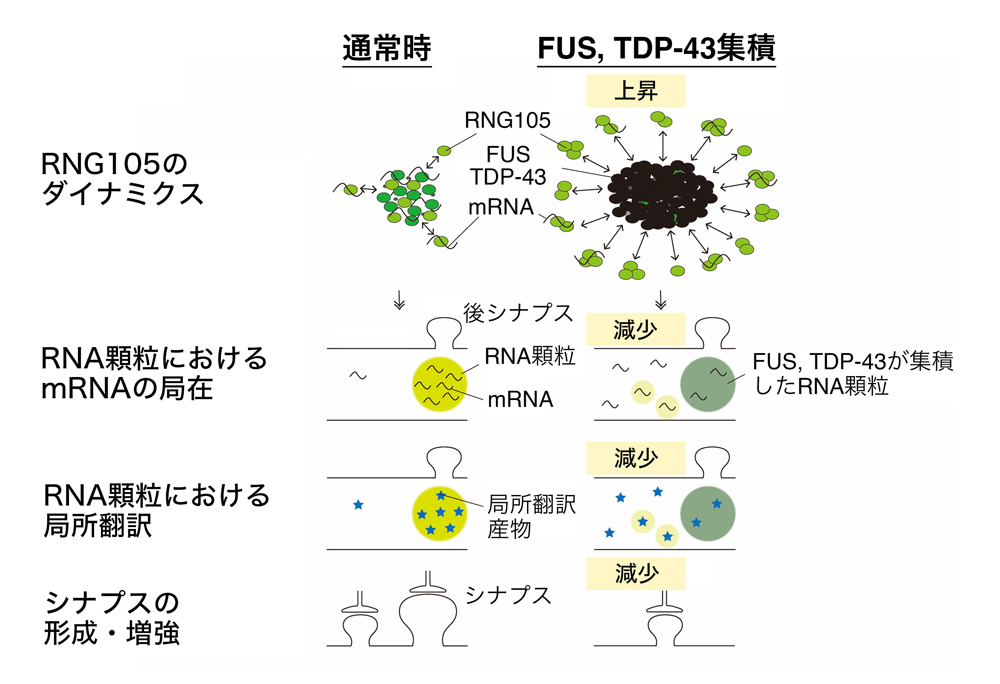 図1:本研究成果のまとめ
図1:本研究成果のまとめ
FUSおよびTDP-43のRNA顆粒への集積は、RNG105の顆粒からの解離を引き起こし、mRNAの取り込み減少、局所翻訳の低下、シナプスの損失をもたらす。
【研究の背景】
FTDおよびALSの両疾患において、脳内の神経細胞間のシナプス形成や増強が障害されることが報告されています。シナプスの形成や増強は、脳の情報処理や学習・記憶にとって重要な制御機構です。しかし、FTDやALSにおけるシナプス形成・増強の障害メカニズムは未解明の部分が多く、それが治療法の開発を困難にしている要因の一つです。
シナプス形成・増強における重要な制御機構の一つは、局所翻訳です。局所翻訳では、シナプス形成・増強に必要なタンパク質をコードしたmRNAがRNA顆粒に取り込まれ、細胞体から樹状突起に輸送され、シナプス入力に応答して局所的に翻訳されます(図2左)。このように、局所翻訳はRNA顆粒による制御が重要です。RNA顆粒は、mRNAとRNA結合タンパク質からなる主要な構成分子が液-液相分離することにより形成され、分子の出入りが可能です。樹状突起への輸送中は分子の出入りが制限される一方、シナプス入力によって分子の出入りが促進されて翻訳が活性化すると考えられています。このような分子の出入りが時空間的に正しく制御されることが、局所翻訳の制御ひいてはシナプス形成・増強に重要だと考えられています(図2左)。
FTD/ALSの原因因子であるFUSおよびTDP-43は通常、核内で機能しますが、疾患では核外に移行し、RNA顆粒内で凝集化します(図2右)。しかし、この凝集化がRNA顆粒の構成や機能に及ぼす影響はほとんど知られていません。そこで本研究では、その影響を解明すると共に、シナプス形成・増強への影響も明らかにすることを目指しました。
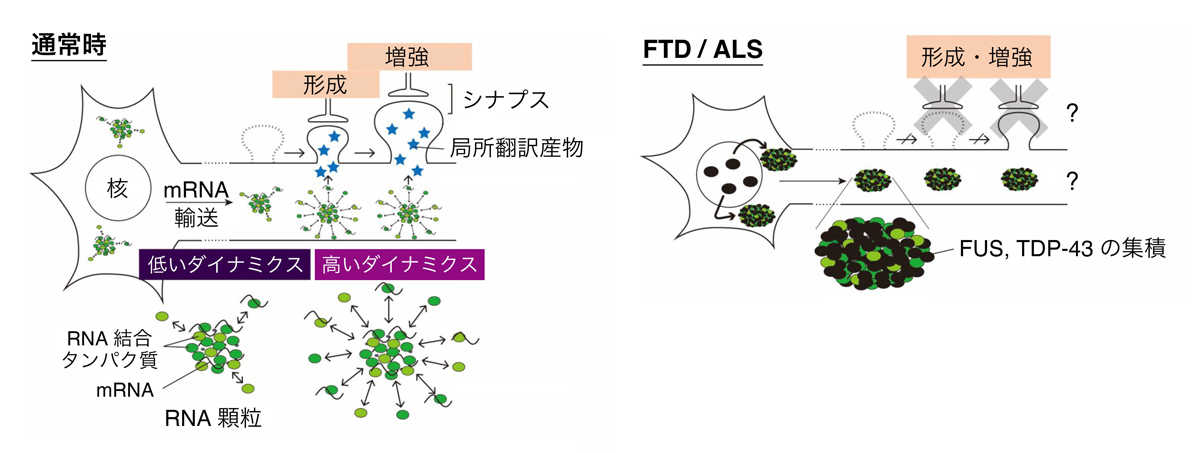 図2:RNA顆粒による局所翻訳及びシナプス形成・増強制御
図2:RNA顆粒による局所翻訳及びシナプス形成・増強制御
RNA顆粒は樹状突起へのmRNA輸送およびシナプス付近での局所翻訳を担う。輸送中は顆粒のダイナミクスが低く保たれて翻訳は抑制されるが、シナプス入力に応じてダイナミクスが上昇して局所翻訳が活性化すると考えられている。局所翻訳産物は近くのシナプスに供給されてシナプス形成・増強に寄与する。FTD/ALSではFUSやTDP-43がRNA顆粒内で凝集化するが、それが局所翻訳やシナプス形成・増強にどのような影響を与えるのかは未知の点が多い。
【研究の成果】
1. FUSおよびTDP-43の集積により、RNA顆粒内でRNG105の流動性が増加し、顆粒から解離する
マウス大脳皮質の神経初代培養細胞に、細胞質に移行する変異型FUSおよびTDP-43(FUSΔNLS, TDP-43G348C)を発現させました。そして、それらのRNA顆粒への集積が、RNA顆粒形成の足場となるタンパク質(RNG105、FMRP、Stau1、Stau2、Pum2)のダイナミクスに与える影響を解析しました。その結果、RNA顆粒内のRNG105の流動性が上昇し、RNG105のみが顆粒から解離することを明らかにしました(図3)。
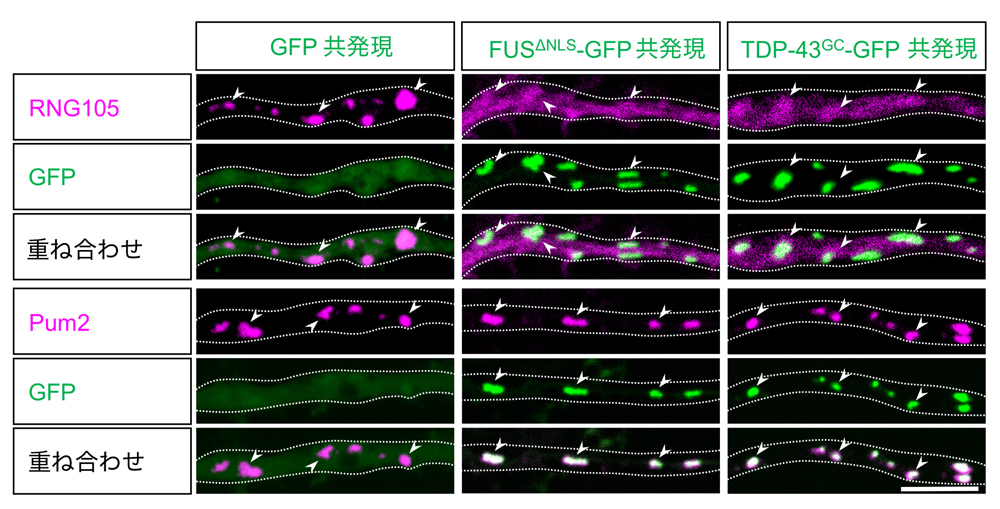 図3:FUSΔNLSおよびTDP-43G348CのRNA顆粒への集積はRNG105を特異的に解離させる
図3:FUSΔNLSおよびTDP-43G348CのRNA顆粒への集積はRNG105を特異的に解離させる
神経初代培養の樹状突起内において、RNG105とPum2はRNA顆粒に局在している。FUSΔNLS, TDP-43G348Cの共発現および顆粒への集積により、RNG105は顆粒から解離した。一方、Pum2などの他のタンパク質への影響はなかった。点線:樹状突起の輪郭、矢頭:代表的なRNA顆粒、スケールバー:5 μm。
2. FUSおよびTDP-43の集積により、RNA顆粒内のmRNA量が減少し、顆粒周辺での局所翻訳が低下する
次に、FUSおよびTDP-43の集積がRNA顆粒におけるmRNA局在と局所翻訳に及ぼす影響を解析しました。mRNAの細胞内分布はpoly(dT)プローブを用いたin situハイブリダイゼーショで調べ、翻訳活性の細胞内分布はSunTagシステムを用いて調べました。FUSΔNLSおよびTDP-43G348Cを発現しない神経細胞では、mRNAや翻訳はRNG105が局在するRNA顆粒に集中していることが観察されました(図4)。一方、FUSΔNLSまたはTDP-43G348Cを発現し、これらが集積した顆粒では、mRNAや翻訳の集中が見られませんでした(図4)。これらの結果は、FUSおよびTDP-43が集積したRNA顆粒ではmRNA量が減少し、その顆粒付近での局所翻訳が低下することを示しました。
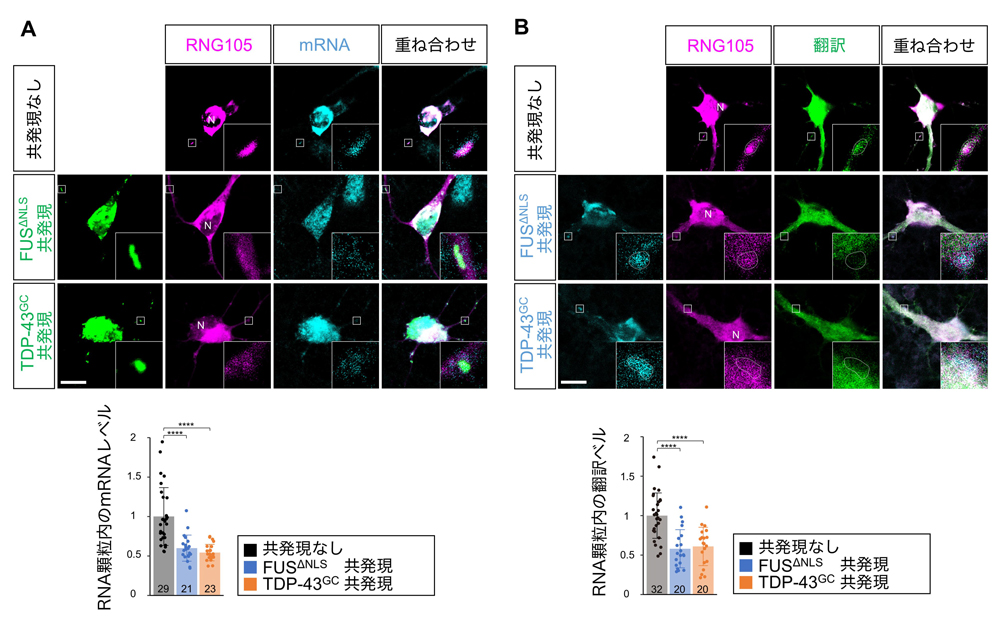 図4:FUSおよびTDP-43のRNA顆粒への集積はmRNA量を減少させ、局所翻訳を低下させる
図4:FUSおよびTDP-43のRNA顆粒への集積はmRNA量を減少させ、局所翻訳を低下させる
RNG105を発現した神経初代培養細胞にFUSΔNLSまたはTDP-43G348Cを共発現させた。poly(dT)によりmRNAの細胞内分布を可視化し(A)、SunTagにより翻訳活性の細胞内分布を可視化した(B)。挿入図は樹状突起のRNA顆粒の拡大図。Bの点線はRNA顆粒の輪郭。スケールバー:10 μm。
3. FUSおよびTDP-43による顆粒内mRNA量の減少と局所翻訳の低下は非解離型RNG105によって抑制される
FUSおよびTDP-43によるRNA顆粒内のmRNA量の減少と局所翻訳の低下は、RNG105の顆粒からの解離による可能性が示唆されました。この可能性を検証するため、FUSやTDP-43による顆粒からの解離が起きない改変型RNG105の作製を試みました。網羅的なドメインの欠損と置換実験の結果、RNG105のRNA結合ドメイン(RBD1)を、Pum2またはStau1由来のRNA結合ドメインに置換することで、FUSおよびTDP-43による顆粒からの解離を免れる非解離型RNG105(RNG105-Pum2RBDおよびRNG105-Stau1RBD)を作製できることが分かりました(図5)。これとは逆に、RNA結合ドメインをRNG105のRBD1に置換した改変型Stau1は、FUSおよびTDP-43によって解離されるようになりました。これらの結果は、RNG105のRBD1がFUSおよびTDP-43に感受性を持つドメインであることを示しています。
非解離型RNG105を発現した神経細胞では、FUSΔNLSやTDP-43G348CによるRNA顆粒でのmRNA量の減少および局所翻訳の低下が防がれました(図6)。したがって、FUSおよびTDP-43による影響は、RNG105の顆粒からの解離を介して生じることが示されました。
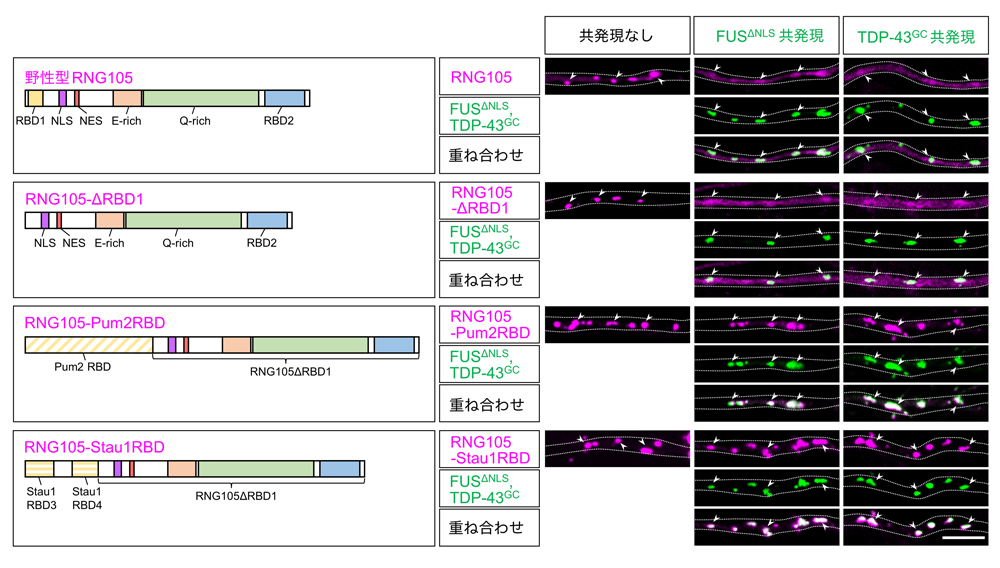 図5:非解離型RNG105の作製
図5:非解離型RNG105の作製
RNG105のRNA結合ドメインRBD1をPum2またはStau1由来のRNA結合ドメインに置換することによって、FUSΔNLSやTDP-43G348Cによる顆粒からの解離を免れる非解離型RNG105を作製できた。点線:樹状突起の輪郭、矢頭:代表的なRNA顆粒、スケールバー:5 μm。
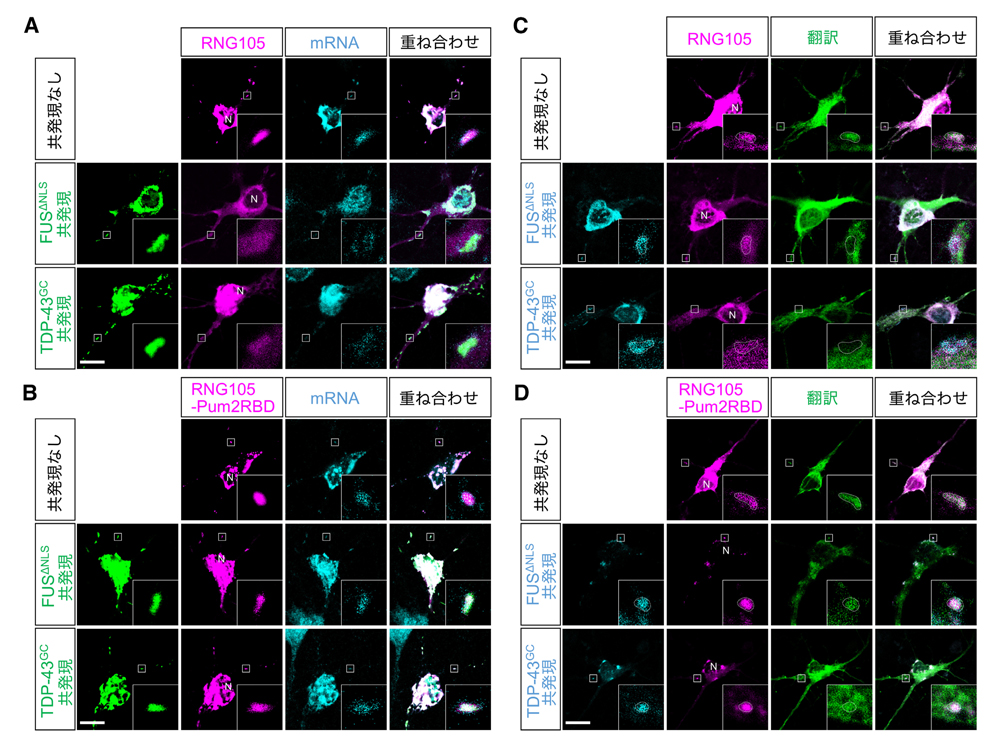 図6:非解離型RNG105はFUSおよびTDP-43によるRNA顆粒でのmRNA量の減少および局所翻訳の低下を防ぐ
図6:非解離型RNG105はFUSおよびTDP-43によるRNA顆粒でのmRNA量の減少および局所翻訳の低下を防ぐ
野生型RNG105 (RNG105)または非解離型RNG105 (RNG105-Pum2RBD)を発現した神経初代培養細胞に、FUSΔNLSまたはTDP-43G348Cを共発現させた。A, B: poly(dT)によりmRNAの細胞内分布を可視化し(A, B)、SunTagによ翻訳活性の細胞内分布を可視化した(C, D)。挿入図は樹状突起のRNA顆粒の拡大図。C, Dの点線はRNA顆粒の輪郭。スケールバー:10 μm。
4. FUSおよびTDP-43によるシナプスの損失は非解離型RNG105によって抑制される
最後に、非解離型RNG105が、FUSやTDP-43によって引き起こされる樹状突起シナプスの形成や増強の低下に対して効果を持つかどうかを解析しました。その結果、非解離型RNG105は、FUSΔNLSおよびTDP-43G348Cによるシナプス形成障害を防ぐことが示されました。以上の結果をまとめると、FUSおよびTDP-43のRNA顆粒への集積によるRNG105の解離が、RNA顆粒におけるmRNA量減少および顆粒周辺での局所翻訳の低下、さらにシナプス形成障害を引き起こしていることが示唆されました(図1)。
【本研究の意義と今後の展望】
神経変性疾患の原因として、FUSおよびTDP-43の核内での機能喪失や細胞質での有害な凝集化が考えられています。本研究では、細胞質におけるRNA顆粒での凝集化がRNG105の解離を引き起こし、シナプス形成・増強にとって有害な要因となる新たなメカニズムを示しました。今後、このメカニズムを疾患モデルマウスなどを用いて個体レベルで検証することで、神経変性疾患における認知機能障害などの基盤となるメカニズムの理解に寄与することが期待されます。
【発表雑誌】
論文タイトル:Regulation of RNG105/caprin1 dynamics by pathogenic cytoplasmic FUS and TDP-43 in neuronal RNA granules modulates synaptic loss
著者:Tomoyo Horio, Yui Ishikura, Rie Ohashi and Nobuyuki Shiina
雑誌名:Heliyon 9, e17065 (2023)
DOI:https://doi.org/10.1016/j.heliyon.2023.e17065
【研究グループ】
本研究は、基礎生物学研究所/生命創成探究センターの堀尾朋世大学院生、石倉有唯大学院生、大橋りえ助教、椎名伸之准教授の研究グループによって実施されました。
【研究サポート】
本研究は、科学研究費助成事業(19H03161、22H02552)および武田科学振興財団生命科学研究助成による支援を受けて行われました。
【本研究に関するお問い合わせ先】
自然科学研究機構 基礎生物学研究所 神経細胞生物学研究室
自然科学研究機構 生命創成探究センター 神経分子動態生物学研究グループ
准教授 椎名伸之