2023-03-26 理化学研究所,順天堂大学,東京大学
理化学研究所(理研)脳神経科学研究センター 分子精神病理研究チームの中村 匠 研究員(研究開始当時:東京大学 大学院総合文化研究科 広域科学専攻 博士課程)、髙田 篤 チームリーダー、順天堂大学大学院 医学研究科 精神・行動科学の加藤 忠史 主任教授、東京大学 大学院総合文化研究科 広域科学専攻 生命環境科学系の坪井 貴司 教授らの共同研究グループは、自閉スペクトラム症(ASD)の有力な関連遺伝子[1]KMT2Cの変異マウスを樹立し、その変異マウスがASD患者と似た行動変化を示すこと、ASDに関連する遺伝子群の発現変化が脳内で起こっていること、このような行動変化や遺伝子発現変化の一部が薬剤投与によって回復することを明らかにしました。
本研究成果は、ASDの病態理解を深めるとともに、治療方法の開発につながることが期待されます。
今回、共同研究グループは、有力なASD関連遺伝子であり、ヒストンメチル化[2]を促進するKMT2C遺伝子に着目し、Kmt2c遺伝子を欠損する遺伝子改変マウスをCRISPR/Cas9システム[3]によって樹立しました。Kmt2c変異マウスは、社会性や柔軟性の低下といったASD様行動を現し、ASDモデルマウスとして妥当と考えられる行動変化を示しました。また、遺伝子発現に着目したオミクス解析(トランスクリプトーム解析[4])により、変異マウスの脳では、既知のASDリスク遺伝子の発現変化が生じ、これらがASDの病態に寄与している可能性を見いだしました。さらに、KMT2Cの欠損によるヒストンメチル化変化を打ち消すと予測される、ヒストン脱メチル化酵素LSD1の阻害剤投与によって、Kmt2c変異マウスにおける社会性の低下や遺伝子の発現変化が回復することを突き止めました。
本研究は、科学雑誌『Molecular Psychiatry』オンライン版(3月26日付:日本時間3月26日)に掲載されました。
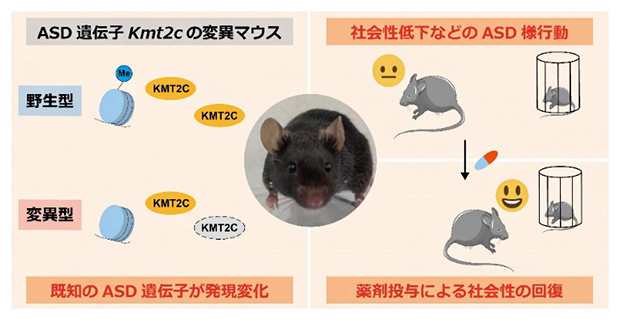
Kmt2c遺伝子欠損マウスが呈したASD様行動は、薬剤投与で改善
背景
自閉スペクトラム症(ASD:Autism Spectrum Disorder)は、社会的コミュニケーションの問題と、限局された行動・興味を主な症状とする発達障害の一群です。最近のアメリカでの疫学調査では、8歳の子どもの2.8%程度がASDと診断されると報告されています注1)。ASDは遺伝的要因が強く関与する疾患であることが知られており、近年で最も大規模な遺伝学的解析によって、統計学的に有意[5]にASDと関連する有力なASD関連遺伝子が報告されました。これらのASD関連遺伝子群の中には、クロマチン[6]修飾に関わるエピジェネティック因子[7]が多く含まれ、このような分子機能がASD病態に関与すると考えられます。
クロマチン修飾の機能を持つ有力なASD関連遺伝子の一つが、KMT2C(Lysine methyltransferase 2C)遺伝子で、そのヘテロ欠損[8]がASDに関与することが示唆されています。KMT2C遺伝子は、クロマチン修飾の一つであるヒストンH3の4番目のリジン(H3K4)にメチル基を付加する酵素をコードします。このようなH3K4のメチル化[2]に関与する遺伝子群は、他の神経発達障害や統合失調症などの精神神経疾患と関与することが報告されています。そのため、H3K4メチル化関連遺伝子の機能変化は、さまざまな精神神経疾患の病態に関与し、認知機能や脳の発達にも大きな役割を果たしていることが分かってきました。
しかしながらこれまで、KMT2C遺伝子のヘテロ欠損によるASDの病態メカニズムは、明らかにされていませんでした。
注1)アメリカ疾病予防管理センター「Key Findings from the ADDM Network | Autism | NCBDDD | CDC」
研究手法と成果
共同研究グループは、遺伝子編集技術CRISPR/Cas9システムによって、ASD患者で顕著に見られるKMT2Cのヘテロ欠損を再現した、Kmt2cヘテロ変異マウスを樹立しました。まず、この変異マウスがASDモデルマウスとして妥当かどうかを評価するために、複数の一般的な行動テストを行い、Kmt2c変異マウスの行動変化を観察しました。
その結果、Kmt2c変異マウスは、マウスの社会性を評価するスリーチャンバー社会性試験[9]において顕著な所見を示しました。この試験では、通常、野生型マウスは、空のケージの近くに滞在する時間に比べて、未知のマウスがいるケージの近くに滞在する時間が有意に長くなり、マウスの社会性を示唆する行動を示します(図1A)。しかしKmt2c変異マウスは、そのような滞在時間の偏りを示さず、社会性の低下を示唆する結果を示しました(図1B)。また、インテリケージ[10]を用いて、マウスの柔軟性を評価したところ、顕著な行動変化を見いだしました。この行動試験では、四つのコーナーにある飲水ボトルのうち一つだけをマウスが飲めるようにし、その飲水可能コーナーを毎日対角線上に規則的に移動させ、そのような状況変化へのマウスの対応を評価しました(図1C上)。Kmt2c変異マウスは、飲水コーナーが往復する対角線を変更した日、すなわち移動ルールを変更した日において、前日に飲水可能であったコーナーに、野生型マウスよりも有意に長い時間滞在しました(図1C下)。この結果は、Kmt2c変異マウスにおいて、急な環境の変化に対する柔軟性が低下していることを示すと考えられます。
社会性や柔軟性の低下は、ASD患者の特徴的な表現型です。樹立したKmt2c変異マウスは、ASD研究のモデルマウスとしての妥当性を満たし、このマウスを対象とした病態研究が有効であると考えられました。
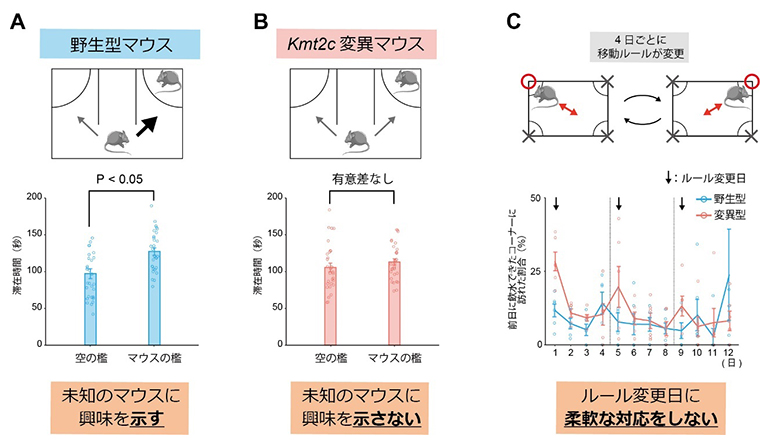
図1 Kmt2c変異マウスの行動変化
A:野生型マウスにおけるスリーチャンバー社会性試験の結果。野生型マウスは、未知のマウスがいるケージの近くに有意に長く滞在し、未知のマウスに興味を示した。
B:Kmt2c変異マウスにおけるスリーチャンバー社会性試験の結果。Kmt2c変異マウスは、空のケージと未知のマウスのケージの近くの滞在時間に差が無く、未知のマウスに興味を示していないことが示唆された。
C:インテリケージによる柔軟性の評価試験の結果。Kmt2c変異マウスでは、ルール変更日において、前日に飲水できたコーナーに訪れた割合が顕著に大きくなっていた。
そこで共同研究グループは、Kmt2c変異マウスが示したASD様行動に関係すると予測される分子メカニズムの解明を目指しました。KMT2Cタンパク質が制御するH3K4のメチル化は、メッセンジャーRNA(mRNA)の転写の活性への関与が知られていることから、Kmt2c変異マウスにおいても遺伝子転写制御の広範な変化が起こっているとの仮説を立て、生後11週の成体マウスの前脳サンプルから抽出した全mRNAを対象に、RNAシークエンシング(RNA-seq)によるトランスクリプトーム解析を行いました。
その結果、Kmt2c変異マウスの脳において、統計学的に有意に発現が上昇または低下している遺伝子群を同定しました(図2)。同定した発現変動遺伝子群について、既知のASD遺伝リスクとの重なりを調べてみたところ、変異マウスで発現が有意に上昇していた遺伝子群と、有力なASD関連遺伝子とが、偶然以上の確率で重なっていました(図2)。そのほか、ASDのゲノムワイド関連解析(GWAS)[11]データによって推定されるASDリスクと関与するゲノム領域や、ASD患者の死後脳における発現変動遺伝子群なども、Kmt2c変異マウスで発現上昇している遺伝子群に有意に集積していました。さらに、ASDとの関連が示唆されるシナプス機能に関わる遺伝子群なども、やはり発現上昇していました。このような、ASDに関連している可能性の高い既知の遺伝リスクの発現上昇が、KMT2Cのヘテロ欠損によるASDの病態に寄与している可能性が示されました。
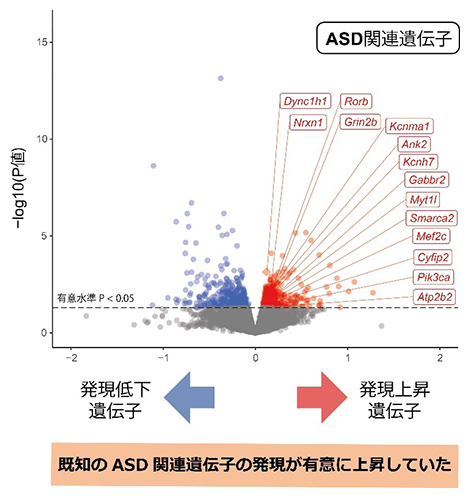
図2 Kmt2c変異マウスの成体脳におけるトランスクリプトーム変化
Kmt2c変異マウスの脳においてさまざまな遺伝子が有意に発現変動しており(赤または青の点)、特に発現が上昇していた遺伝子群において、偶然以上の確率でASD関連遺伝子(枠線で示す遺伝子)が含まれていた。
共同研究グループは次に、ASDは幼少期、すなわち発達の初期から症状が見られる神経発達障害であることを考慮して、生後4日齢のマウスの脳におけるトランスクリプトーム変化を解析しました。共同研究グループは、より高解像度の遺伝子発現情報を取得するために、理研によって開発されたトランスクリプトーム解析手法、Quartz-Seq2による1細胞RNAシークエンス(シングルセルRNA-seq)注2)を行い、各細胞クラスタにおける、Kmt2c変異マウスの発現変動遺伝子を同定しました。同定した各クラスタの発現変動遺伝子群に対して、成体マウスのRNA-seq解析で行ったASD遺伝リスクの集積度や、発現変動遺伝子の観測数と期待値の間の乖離(かいり)度を求め、それに基づいて、同定した細胞クラスタのランク付けを行いました。その結果、放射状グリア[12]や未成熟な神経細胞などが高いランクを示し、神経系分化の比較的初期の細胞群において、発現変動遺伝子数の顕著な増加やASDリスクの集積が見られました(図3)。本結果は、Kmt2cのヘテロ欠損の影響が神経系分化の初期の段階から生じており、このような発生の早い段階での影響が病態に関与しているという可能性を示唆しています。
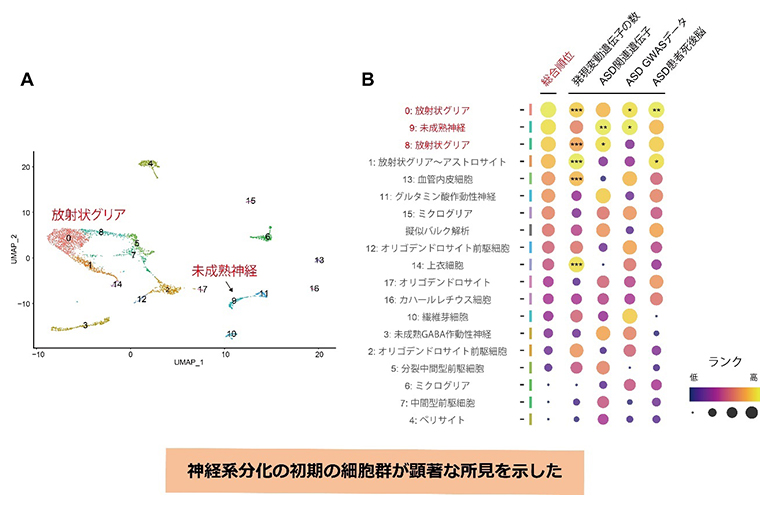
図3 新生児脳シングルセルRNA-seqによる病態に関与し得る細胞クラスタの解析
A:生後4日齢のマウス脳サンプルにおいて同定した細胞クラスタのマップ。各番号は、Bの細胞クラスタ名の番号と対応している。
B:同定した細胞クラスタのランク付け。Kmt2c変異マウスにおける各細胞クラスタの発現変動遺伝子群について、発現変動遺伝子の数、ASD関連遺伝子との重複、GWASデータによるASDリスクSNPの集積、ASD患者死後脳における発現変動遺伝子との重複という四つの尺度についての解析を行い、各解析で得られたP値(統計的な仮説検定において、実際に観測した値となる確率)に基づいてランク付けを行った。神経系分化の初期の細胞群が一貫して高いランクを示した。
この結果は、Kmt2cのヘテロ欠損の影響が、脳発達の初期の段階から生じている可能性を示唆しています。一方で、特定の種類の細胞が著しく増減しているという所見はKmt2c変異マウスでは観察されませんでした。
最後に共同研究グループは、治療介入の可能性を探るために、Kmt2c変異マウスのASD様行動が薬剤投与実験によって改善されるかを検討しました。
この実験では、ヒストンにメチル基を付与する機能を有するKMT2Cの欠損による影響を打ち消す効果が期待される、ヒストン脱メチル化酵素LSD1の阻害剤をKmt2c変異マウスに投与しました。LSD1の阻害効果を有する薬剤の一つであるVafidemstat(バフィデムスタット)を、Kmt2c変異マウスに4週間飲水投与し、いろいろな行動試験を行ったところ、変異マウスで見られた社会性の低下が、薬剤を投与した変異マウスで回復しており、Kmt2c変異マウスのASD様行動の一部が改善されることを見いだしました(図4)。
同定した治療効果の分子メカニズムを明らかにするために、野生型マウス、薬剤未投与のKmt2c変異マウス、薬剤を投与したKmt2c変異マウスの三群から摘出した脳サンプルを用いて、改めてRNA-seqによるトランスクリプトーム解析を行いました。すると、薬剤未投与のKmt2c変異マウスにおいて有意に発現変動していた427の遺伝子のうち、88.3%の377の遺伝子が、薬剤投与によって逆方向に発現変動していることを突き止めました。すなわち、Kmt2c変異マウスで発現上昇していた遺伝子が薬剤投与によって発現低下し、Kmt2c変異マウスで発現低下していた遺伝子が薬剤により発現上昇していました。
これにより、本研究で着目したLSD1阻害剤であるVafidemstatは、Kmt2c変異マウスにおける、一部のASD様行動およびトランスクリプトーム変化に対して、改善効果を有していることが判明しました。
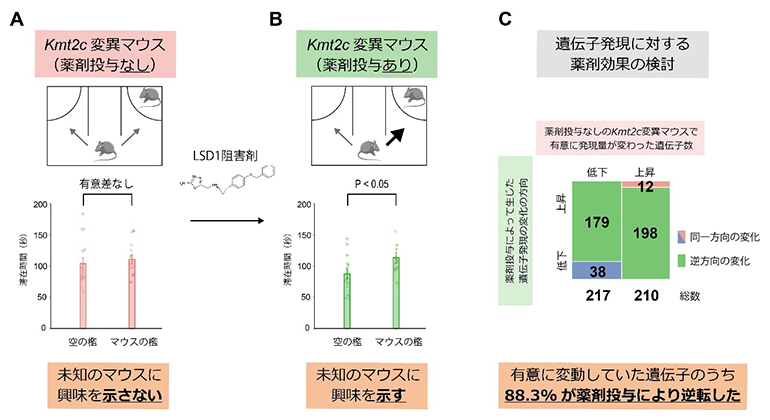
図4 LSD1阻害剤によるKmt2c変異マウスの行動・トランスクリプトーム変化の回復
A:薬剤を投与していないKmt2c変異マウスにおけるスリーチャンバー社会性試験の結果。やはり空のケージと未知のマウスのケージの近くの滞在時間に差が無く、未知のマウスに興味を示していないことが再現された。
B:薬剤を投与したKmt2c変異マウスにおけるスリーチャンバー社会性試験の結果。未知のマウスがいるケージの近くに有意に長く滞在しており、未知のマウスに興味を示した。
C:薬剤を投与していないKmt2c変異マウスの脳において有意に発現変動していた計427(発現低下遺伝子217+発現上昇遺伝子210)のうち、88.3%の377の遺伝子の発現が、薬剤の効果によって逆方向に変動していた。
注2)2018年3月13日プレスリリース「数千個の1細胞からRNA量と種類を正確に計測」
今後の期待
今回の研究は、ASDの病態理解および治療法開発に大きく貢献することが期待されます。また、KMT2Cが関与するH3K4のメチル化は、脳の機能や発達に重要であり、Kmt2c変異マウスは、それらの理解を目指した基礎研究にも応用できます。
Kmt2c変異マウスに治療効果を示したLSD1阻害剤については、同じくH3K4のメチル化を制御する統合失調症関連遺伝子Setd1aの変異マウスや、ヒストン修飾に変化を示す他のASDモデルマウスにおける行動変化に対する治療効果が報告されていることを考えると、ASDをはじめとする精神神経疾患患者の一部に対する治療効果が期待されます。また、今回の研究で使用したVafidemstatは第Ⅱ相臨床試験まで進んでおり注3)、さらなる検証が必要ですが、ASDおよび他の精神神経疾患の病態解明および治療法開発に向けて、今後の展開が期待されます。
注3)S. Hofmann et al., Eur. Phys. J. A 48, 62 (2012).
補足説明
1.自閉スペクトラム症(ASD)の有力な関連遺伝子
2022年にJack M.Fuらによって報告された遺伝子。ASD患者における希少な遺伝子変異に着目し、20,627人のASD患者群と42,610人の対照群のコホートから成る大規模遺伝学的解析おいて、非常に厳しい有意水準を超えた遺伝子として報告された。詳細は英語原著論文を参照(10.1038/s41588-022-01104-0)。
2.ヒストンメチル化、H3K4のメチル化
ヒストンはH1、H2A、H2B、H3、H4の5種類から成り、DNAを巻き付かせて核内に高密度にパッキングさせる役割を担っている。ヒストンのN末端のリジン残基またはアルギニン残基のメチル化は、遺伝子発現制御やクロマチンの高次構造の形成に関わっていると考えられている。ヒストンH3K4のメチル化は、エピジェネティック修飾の一つで、ヒストンH3の4番目のリジン(H3K4)において起こるメチル基修飾。メチル基が付与されたH3K4は、mRNAの転写が活発な領域のマーカーとして知られている。
3.CRISPR/Cas9システム
ゲノム編集技術の一つ。標的ゲノム領域を認識する配列を含むガイドRNAと、DNA切断酵素のCas9タンパク質から構成され、ゲノム中の任意の領域を切断できる。細胞がゲノムを修復する際、ゲノムの欠失、挿入が起こり、任意の遺伝子の機能を破壊することができる。
4.トランスクリプトーム解析
組織や細胞で発現している転写産物(RNA)の網羅的な解析のこと。次世代シークエンサーによりRNAの配列断片情報を網羅的に取得し、遺伝子発現量の定量を行う。
5.統計学的に有意
統計的解析において、観察された影響について、その確実性を評価し、偶然によって生ずる確率が低い場合には統計的に有意とされる。
6.クロマチン
ヒストン(補足説明[2]参照)8量体の周りにDNAが巻き付いた構造をヌクレオソームと呼び、真核生物においてヌクレオソームを基本単位とするゲノムDNAとタンパク質の高次複合体をクロマチンと呼ぶ。
7.エピジェネティック因子
DNAの塩基配列に依存しない遺伝子の調節機構をエピジェネティクスと呼び、その制御に関わる要因をエピジェネティック因子と呼ぶ。
8.ヘテロ欠損
ヒトやマウスなどの有性生殖を行う生物の多くが持つ2組の相同なゲノムのうち、片方の遺伝子を欠損すること。
9.スリーチャンバー社会性試験
自由に行き来ができる三つに区切られた部屋を用いて、マウスの行動を観察する試験。マウスの社会性などを調べることができる。
10.インテリケージ
マウスの行動や記憶学習行動、空間認知機能を、集団環境下で半自動的に評価することができるマウス用行動試験装置。飲水ボトルと飲水を制御するためのドアが設置された実験チャンバーが、ケージの各コーナーに設置されており、設定した行動課題に成功するとドアが開き、水が飲めるようになる。
11.ゲノムワイド関連解析(GWAS)
ゲノム中の数十万から数百万のSNP(ゲノム配列中で見られる個人間での一塩基の違いのうち、集団内で1%以上の頻度で認められる遺伝子多型の一つ。SNPはsingle nucleotide polymorphismの略)を網羅的に調べ上げ、疾患の有無や、身長・体重などの形質と関連するゲノム領域を同定する研究手法。GWASはgenome-wide association studyの略。
12.放射状グリア
神経幹細胞として働き、神経、アストロサイト、オリゴデンドロサイトなどの脳内の主要な細胞種に分化する機能を有している。
共同研究グループ
理化学研究所
脳神経科学研究センター
分子精神病理研究チーム
チームリーダー 髙田 篤(タカタ・アツシ)
研究員 中村 匠(ナカムラ・タクミ)
(研究開始当時:東京大学大学院 総合文化研究科 広域科学専攻 博士課程)
テクニカルスタッフⅠ 本多 久楽々(ホンダ・クララ)
テクニカルスタッフⅠ 上田 順子(ウエダ・ジュンコ)
客員研究員 原 伯徳(ハラ・トモノリ)
精神疾患動態研究チーム(研究当時)
副チームリーダー(研究当時)笠原 和起(カサハラ・タカオキ)
研究員(研究当時)中島 一夫(ナカジマ・カズオ)
テクニカルスタッフⅠ(研究当時)石渡 みずほ(イシワタ・ミズホ)
行動遺伝学技術開発チーム(研究当時)
チームリーダー(研究当時)糸原 重美(イトハラ・シゲヨシ)
研究員(研究当時)小林 祐樹(コバヤシ・ユウキ)
精神生物学研究チーム(研究当時)
チームリーダー(研究当時)内匠 透(タクミ・トオル)
基礎科学特別研究員(研究当時)仲西 萌絵(ナカニシ・モエ)
生命機能科学研究センター
分子配列比較解析チーム(研究当時)
チームリーダー(研究当時)工樂 樹洋(クラク・シゲヒロ)
テクニカルスタッフⅡ(研究当時)種子島 千春(タネガシマ・チハル)
技師(研究当時)門田 満隆(カドタ・ミツタカ)
順天堂大学 大学院医学研究科 精神・行動科学
主任教授 加藤 忠史(カトウ・タダフミ)
東京大学 大学院総合文化研究科 広域科学専攻 生命環境科学系
教授 坪井 貴司(ツボイ・タカシ)
京都大学 大学院医学研究科 附属動物実験施設
教授 浅野 雅秀(アサノ・マサヒデ)
特定講師(研究当時)吉原 亨(ヨシハラ・トオル)
研究支援
本研究は、日本医療研究開発機構(AMED)革新的技術による脳機能ネットワークの全容解明プロジェクト「脳ゲノム情報解析による精神疾患関連神経回路の同定と機能解明(研究代表者:岩本和也)」、同脳とこころの研究推進プログラム「視床室傍核を起点とした精神疾患の病態解明(研究代表者:加藤忠史)」、同脳科学研究戦略推進プログラム「トリオサンプルのシーケンス解析による、遺伝子型によって定義される双極性障害の一群の同定(研究代表者:髙田篤)」、同ゲノム医療実現推進プラットフォーム事業(先端ゲノム研究開発:GRIFIN)「オリゴジェニックモデルに基づくヒト疾患の遺伝的構造の解析(研究代表者:髙田篤)」、同戦略的国際脳科学研究推進プログラム「双極性障害に対する体細胞変異の意義の解明と神経ゲノム病理学的手法の開発(研究代表者:西岡将基)」、日本学術振興会(JSPS)科学研究費助成事業新学術領域研究(研究領域提案型)「双極性障害・統合失調症のトランスオミックス・モデリングによる構成的理解(研究代表者:加藤忠史)」、同学術変革領域研究(B)「クラスタ/ハブ細胞を決定する遺伝子・鍵分子経路の特定およびヒト疾患との関連解析(研究代表者:髙田篤)」、同基盤研究(B)「双極性障害大規模シーケンス解析による稀な生殖細胞系列変異と体細胞変異の包括的研究(研究代表者:髙田篤)」、同特別研究員奨励費「遺伝子改変マウスを用いた双極性障害患者デノボ変異の機能解析(特別研究員:中村匠)」、同若手研究「エピジェネティック制御機能を有するメチル基転移酵素に着目した自閉症病態の解明(研究代表者:中村匠)」による助成を受けて行われました。
原論文情報
Takumi Nakamura, Toru Yoshihara, Chiharu Tanegashima, Mitsutaka Kadota, Yuki Kobayashi, Kurara Honda, Mizuho Ishiwata, Junko Ueda, Tomonori Hara, Moe Nakanishi, Toru Takumi, Shigeyoshi Itohara, Shigehiro Kuraku, Masahide Asano, Takaoki Kasahara, Kazuo Nakajima, Takashi Tsuboi, Atsushi Takata* & Tadafumi Kato*(*責任著者), “Transcriptomic dysregulation and autistic-like behaviors in Kmt2c haploinsufficient mice rescued by an LSD1 inhibitor”, Molecular Psychiatry, 10.1038/s41380-024-02479-8
発表者
理化学研究所
脳神経科学研究センター 分子精神病理研究チーム
チームリーダー 髙田 篤(タカタ・アツシ)
研究員 中村 匠(ナカムラ・タクミ)
(研究開始当時:東京大学大学院 総合文化研究科 広域科学専攻 博士課程)
順天堂大学 大学院医学研究科 精神・行動科学
主任教授 加藤 忠史(カトウ・タダフミ)
東京大学 大学院総合文化研究科 広域科学専攻 生命環境科学系
教授 坪井 貴司(ツボイ・タカシ)
報道担当
理化学研究所 広報室 報道担当
順天堂大学 総務局 総務部 文書・広報課
東京大学 大学院総合文化研究科 広報室